Amina
| Substància química | classe estructural d'entitats químiques |
|---|---|
| Estructura química | |
 | |

Una amina és un compost orgànic caracteritzat per contenir el grup funcional amino. Les amines es poden considerar formalment derivades de l'amoníac com a resultat de la substitució dels hidrògens per radicals alquil. Segons siguin substituïts un, dos o tres hidrògens, les amines seran amines primàries , amines secundàries o amines terciàries , respectivament. Les amines simples són aquelles en les que els grups alquil són iguals, com la dimetilamina o la trietilamina . Les amines mixtes són les que els grups alquil són diferents, com ara l'etilmetilamina. Les amines aromàtiques són amines on l'àtom de nitrogen està connectat a un anell aromàtic, com en l'anilina. Les amines cícliques són hidrocarburs cíclics que inclouen amines dins dels anells. Com per exemple en els anells no aromàtics; pirrolidina i piperidina o en els anells aromàtics; pirrole, piridina, pirimidina, purina...
Història
[modifica]
La primera amina aïllada fou l'anilina () el 1826 en la destil·lació de l'anyil autèntic (Indigofera tinctoria) d'on s'extreia el colorant indi pel químic alemany Otto Unverdorben (1806–1873), que l'anomenà «cristal·lina». Poc després, el 1834, Friedlieb Runge (1795–1867) aïllà una substància del quitrà d'hulla que anomenà «cianol». El 1840 el químic alemany Carl Julius Fritzsche (1808–1871), tractà l'indi amb hidròxid de potassi i obtingué un oli que anomenà «anilina». Més tard es reconegué que totes aquestes substàncies eren la mateixa i s'acceptà el nom d'anilina.[1]

El 1849 pel químic francès Charles Adolphe Würtz (1817–1884) sintetitzà les primeres amines de la sèrie homòloga (metanamina, etanamina…).[2] Mitjançant la reacció d'isocianats amb amoníac i aigua obtingué diverses urees substituïdes, sintetitzant així els primers membres d'aquests composts. Després les feu reaccionar amb hidròxid de potassi i aconseguí composts d'amoníac totalment desconeguts fins aleshores. La reacció produí carbonat de potassi i un gas amb olor amoniacal que, al principi, Würtz suposà que era amoníac. Molt aviat s'adonà que no només els gasos eren combustibles, sinó que també eren diferents de l'amoníac i que la diferència depenia del compost original. Havia descobert les amines.[3]
Würtz utilitzà per primer cop el mot «amina», derivat d'amoníac amb la terminació «-ina», emprada aleshores per anomenar els composts químics que tenien propietats bàsiques («anilina», «odorina»...), el mateix any.[4] Inicialment havia anomenat aquests composts «metanamida», «etanamida»... però canvià el nom per «metanamina», «etanamina»... per deixar constància de les seves propietats bàsiques.[5]
A aquest nou grup de composts Würtz l'anomenà «amoníacs compostos». Posteriorment, el 1858 el químic alemany August Wilhelm von Hofmann (1818 – 1892) els anomenà «amines».[6][7]
Nomenclatura
[modifica]
Les amines primàries es poden anomenar d’acord amb un dels tres mètodes que segueixen:
- Esmentant el nom del grup R com a prefix al nom de l’hidrur fonamental azà , per exemple etilazà.
- Afegint el sufix «–amina» al nom de l’hidrur fonamental , per exemple etanamina.
- Afegint «–amina» al nom del substituent per al grup , per exemple etilamina.

Si el grup no és el grup característic principal, s’anomena amb el prefix «amino-». Per exemple, àcid 4-aminobenzoic.[8]


Les amines secundàries i terciàries simètriques ( i ) es poden anomenar d’acord amb dos mètodes:
- Esmentant el nom del grup substituent , precedit del prefix numèric «di–» o «tri–», respectivament, com a prefix del nom de l’hidrur fonamental azà . Per exemple difenilazà, trifenilazà.
- Esmentant el nom del grup substituent , precedit del prefix numèric «di-» o «tri-», segons que convingui, i seguit directament, sense espai, per la paraula «amina». Per exemple difenilamina, trifenilamina.[8]
Les amines secundàries i terciàries no simètriques , i es poden anomenar d’acord amb els tres mètodes següents. Els grups substituents en els noms d’amines secundàries i terciàries no simètriques s’ordenen alfabèticament.
- Com a derivats substituïts de l’hidrur fonamental azà . Per exemple (etil)(propil)azà, butil(etil)metilazà
- Com a derivats N-substituïts d’una amina primària o una amina secundària . Per exemple N-(etil)propan-1-amina o N-(etil)propilamina, N-etil-N-metilbutan-1-amina o N-etil-N-metilbutilamina.
- Esmentant els noms de tots els grups substituents, , i , precedits pels prefixos numèrics adequats, i seguits, directament, sense espai, pel nom de classe amina. Per exemple (etil)(propil)amina, butil(etil)metilamina.[8]
Estat natural
[modifica]
Els productes naturals nitrogenats foren dels primers composts orgànics que s'aïllaren i estudiaren. La facilitat amb què les amines s'extreuen amb les dissolucions àcides, unida a la seva regeneració en tractar-les amb bases, simplifica la tasca de separar-les amines d'altres materials vegetals. Per les seves propietats alcalines a les amines vegetals se les anomenà alcaloides. La quantitat d'alcaloides coneguts actualment és superior als 5 000. Són d'especial interès perquè la majoria es caracteritzen per un alt grau d'activitat biològica. Entre ells hi ha la cocaïna, un estimulant del sistema nerviós central obtingut de les fulles de la planta de coca; la coniïna, un dels alcaloides presents a l'extracte de cicuta emprat per enverinar Sòcrates; i la morfina, alcaloide opiaci que és un excel·lent analgèsic, però el seu ús està restringit per la potencial addicció que pot generar (l'heroïna és l'èster diacetat de la morfina). Molts alcaloides, com la nicotina, present al tabac, compost molt tòxic, que de vegades s'usa com a insecticida; i la quinina, alcaloide de l'escorça de la quina que s'usa en el tractament de la malària; contenen dos (o més) àtoms de nitrogen.[9]

Les amines bioactives també existeixen als animals. S'ha trobat una diversitat d'estructures i propietats a les substàncies aïllades de granotes. Per exemple l'epibatidina és un analgèsic natural que s'aïlla de la pell d'una granota equatoriana l'Epipedobates tricolor. Una altra família de granotes, els dendrobàtids, produeix sobre la seva pell una barreja tòxica de diverses amines estereoisomèriques anomenades dendrobines, que les protegeix contra atacs.
Algunes amines d'origen natural són intermediàries a la transmissió dels impulsos nerviosos, i s'anomenen neurotransmissors. Exemples són el GABA (àcid 4-aminobutanoic); l'epinefrina, o adrenalina; hormona que secreta les glàndules suprarenals i prepara l'organisme per lluitar o fugir; i la serotonina, hormona sintetitzada a la glàndula pineal la qual concentració al cervell és creu relacionada amb certes afeccions mentals.[9] L'adrenalina, la noradrenalina, la mescalina, etc., són compostos similars anomenats β-feniletilamines.
-
Àcid 4-aminobutanoic o GABA.
-
Epibatidina extreta de la rana Epipedobates tricolor.
-
Dendrobina, de les granotes de punta de fletxa.
-
Adrenalina o epinefrina.
Els aminoàcids són un tipus d'amines. Contenen un grup amino i un grup carboxil enllaçats al mateix àtom de carboni. Els aminoàcids s'enllacen entre si a través d'aquests dos grups donant un enllaç amida formant les proteïnes. En un extrem queda un grup amino terminal. Com a conseqüència dels processos de degradació, les proteïnes es descomponen donant diferents amines. Per exemple, la pentan-1,5-diamina (cadaverina), l'escatol (un compost heterocíclic), la butan-1,4-diamina (putrescina), etc.[9]
Les sulfamides contenen un grup amino i són compostos que afecten els bacteris, però no en ser humà, a causa del fet que inhibeixen a l'enzim responsable de la síntesi d'àcid fòlic, necessari per als bacteris. Per altra banda, alguns derivats de l'àcid p-aminobenzoic s'empren com a anestèsics.
Es troben amines secundàries en alguns aliments (carns i peixos) o en el fum del tabac. Aquestes amines poden reaccionar amb nitrits (presents en conservants emprats en l'alimentació i en plantes, procedents de l'ús de fertilitzants) donant N-nitrosamines secundàries, que són carcinògenes.
Estructura molecular
[modifica]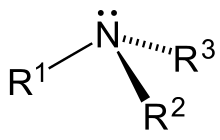
Les amines, igual que l'amoníac, presenten una geometria piramidal dels enllaços amb el nitrogen. Els angles són de 106°, una mica menors que el valor tetraèdric de 109,5°, mentre que l'angle és una mica més gran (112°). La distància de l'enllaç , 147 pm, està entre les distàncies característiques de als alcans (153 pm) i les de l'enllaç als alcohols (143 pm).[9]
El nitrogen i el carboni tenen hibridació sp3, i estan units per un enllaç σ a les amines. El parell electrònic no compartit del nitrogen ocupa un orbital híbrid sp3. Aquest parell no compartit intervé en reaccions en què les amines es comporten com a bases o nucleòfils.[9]
Propietats
[modifica]
Propietats físiques
[modifica]Les olors distintives que són de peix a pútrides caracteritzen les amines de menor massa molecular. Són gasos a temperatura ambient o líquids fàcilment vaporitzables. Les amines primàries i secundàries tenen punts d'ebullició menors que els dels alcohols, però majors que els dels èters de massa molecular semblant. Les amines terciàries, sense ponts d'hidrogen, tenen punts d'ebullició més baixos que les amines primàries i secundàries de masses moleculars semblants. Les amines alifàtiques són menys denses que l'aigua, amb densitats en el rang de 0,63 a 0,74 g/cm³. Les amines aromàtiques solen ser lleugerament més denses que l'aigua (per exemple, la densitat de l'anilina és d'1,02 g/cm³). Amb l'augment de la mida, es tornen menys volàtils; l'olor disminueix i finalment es fa imperceptible, encara que algunes diamines tenen olors ofensives. Per exemple, la putrescina, i la cadaverina, són compostos de mala olor que es troben a la carn en descomposició. Les amines són incolores; les amines alifàtiques són transparents a la llum ultraviolada, però les amines aromàtiques mostren una forta absorció de determinades zones de l'espectre. Les amines amb menys de sis carbonis es barregen amb aigua en totes les proporcions.[10]
| Amina | Fórmula | pKb[11] |
|---|---|---|
| Metilamina | 3,36 | |
| Dimetilamina | 3,29 | |
| Trimetilamina | 4,20 | |
| Etilamina | 3.34 | |
| Dietilamina | 3.02 | |
| Trietilamina | 3.26 | |
| n-propilamina | 3.42 | |
| Benzilamina | 4,64 | |
| Anilina | 9,38 | |
| N-metilanilina | 9,15 | |
| N,N-dimetilanilina | 8,95 | |
| Difenilamina | 13,15 |
Propietats químiques
[modifica]Les amines alifàtiques són bases més fortes que l'amoníac, i les aromàtiques són substancialment més febles. La basicitat és deguda a la parella d'electrons damunt del nitrogen que no formen enllaç i que poden enllaçar-se amb un protó. La intensitat de la basicitat es mesura en termes del valor de pKb, que és igual a −log Kb, on Kb és la constant d'equilibri de la reacció (B és l'amina). Així, un valor de pKb més gran indica una major força com a base. Per comparació, el pKb d'amoníac és de 4,75. Els hidròxids d'amoni quaternari són bases molt fortes, però els clorurs no són bàsics. Amb els àcids minerals forts (àcid sulfúric, àcid nítric o àcid clorhídric), la reacció és vigorosa.[10]
Les amines són compostos molt polars. Les amines primàries i secundàries poden formar ponts d'hidrogen. Les amines terciàries pures no poden formar ponts d'hidrogen, no obstant això, poden acceptar ponts d'hidrogen amb molècules que tinguin enllaços o . Com el nitrogen és menys electronegatiu que l'oxigen, l'enllaç és menys polar que l'enllaç . Per tant, les amines formen ponts d'hidrogen més febles que els alcohols de masses moleculars semblants.
Reaccions d'addició
[modifica]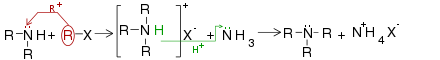
Els electròfils neutres (compostos atrets per regions de càrrega negativa) reaccionen amb les amines. Els halogenurs d'alquil i els agents alquilants anàlegs són exemples importants de reactius electròfils. Per addició es forma una sal, es converteix en .[10]
Tot i que les amines terciàries no reaccionen amb aldehids i cetones, i les amines secundàries només reaccionen de manera reversible, les amines primàries reaccionen fàcilment per formar imines .[10]
Reaccions de substitució
[modifica]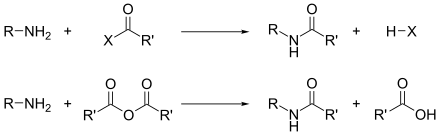
L'acilació és una de les reaccions més importants de les amines primàries i secundàries; un àtom d'hidrogen és substituït per un grup acil (un grup derivat d'un àcid, com o , per eliminació de , com , , etc. Els reactius poden ser clorurs d'àcids (, ), anhídrids () o fins i tot èsters (); els productes són amides dels àcids corresponents.[10]

La reacció amb el fosgen té una importància industrial important. Pot donar lloc a una simple acilació per formar urees , però normalment es realitza en condicions que afavoreixen la conversió d'amines primàries en isocianats: . Els isocianats són ells mateixos agents acilants, d'un tipus que també inclou isotiocianats , cetenes i diòxid de carboni . Reaccionen més o menys fàcilment amb les amines primàries i la majoria de secundàries per formar, respectivament, urees, tiourees , amides i sals d'àcid carbàmic .[10]
La reacció amb àcid nitrós que funciona com a agent acilant que és una font del grup nitrosil , converteix les amines primàries alifàtiques en nitrogen i mescles d'alquens i alcohols corresponents al grup alquil en un procés complex. Aquesta reacció s'ha utilitzat per a la determinació analítica de grups amino primaris en un procediment conegut com a mètode Van Slyke.[10]
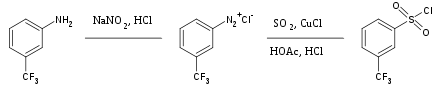
Amb les amines primàries aromàtiques, el nitrogen no es perd si la mescla de reacció es manté fresca (generalment 0 °C) i es forma una sal de diazoni, , on Ar és un grup aril: . Aquests compostos altament reactius tenen una gran importància en la síntesi orgànica i en la indústria de colorants.[10]

L'àcid nitrós converteix les amines secundàries (alifàtiques o aromàtiques) en nitrosamines: . Algunes nitrosamines són potents substàncies cancerígenes, i la seva possible formació és una consideració seriosa quan els nitrits, que són sals d'àcid nitrós, estan presents en aliments o preparats farmacèutics. Les amines terciàries donen lloc a nitrosamines més lentament; s'elimina un grup alquil com a aldehid o cetona, juntament amb el monòxid de dinitrogen .[10]

L'halogenació, en la qual un o més àtoms d'hidrogen d'una amina es substitueixen per un àtom d'halogen, es produeix amb clor , brom i iode , així com amb alguns altres reactius, especialment l'àcid hipoclorós . Amb les amines primàries, la reacció transcorre en dues etapes, produint N-cloro- i N,N-dicloro-amines, i , respectivament. Amb les amines terciàries, un grup alquil pot ser desplaçat per un halogen.[10]
Oxidació
[modifica]
Les amines poden cremar-se a l'aire, produint aigua, diòxid de carboni i nitrogen o els seus òxids. L'oxidació més suau, utilitzant reactius com l'hipoclorit de sodi , pot eliminar quatre àtoms d'hidrogen d'amines primàries del tipus per formar nitrils , i l'oxidació amb reactius com el diòxid de manganès pot eliminar dos àtoms d'hidrogen de les amines secundàries per formar imines . Les amines terciàries es poden oxidar a enamines mitjançant una varietat de reactius.[10]
El peròxid d'hidrogen i els peroxiàcids generalment afegeixen un àtom d'oxigen al nitrogen de les amines. Amb les amines primàries, aquest pas normalment és seguit d'una oxidació addicional, donant lloc a compostos nitrosos, , o compostos nitro, . Les amines secundàries es converteixen en hidroxilamines, , i les amines terciàries en òxids d'amina, .[10]
Eliminació
[modifica]
La reacció principal dels compostos d'amoni quaternari és l'eliminació de Hofmann, que té lloc quan els hidròxids s'escalfen fortament, generant una amina terciària; el grup alquil menys substituït es perd com alquè.[10]
Síntesi
[modifica]Alquilació de l'amoníac
[modifica]
En principi, les amines es poden preparar per reaccions de substitució nucleofílica entre halogenurs d'alquil i amoníac . Encara que aquesta reacció és útil per preparar α-aminoàcids, no és un mètode general de síntesi d'amines. La seva limitació principal és que l'amina primària que s'espera obtenir és nucleofílica en si mateixa, i competeix amb l'amoníac per l'halogenur d'alquil. Això fa que s'obtengui una mescla d'amines primària, secundària i terciària. És útil si es vol sintetitzar una amina terciària.[9]
Síntesi de Gabriel
[modifica]
La síntesi de Gabriel es basa en els treballs del químic alemany Siegmund Gabriel (1851–1924) a la Universitat de Berlín, a la dècada de 1880. És un mètode que assoleix el mateix resultat final que l'alquilació de l'amoníac, però que evita la formació d'amines secundàries i terciàries com a subproductes. Els halogenurs d'alquil es converteixen en amines primàries, sense contaminar-les amb amines secundàries i terciàries. El reactiu clau és la sal de potassi de la ftalimida, que es prepara in situ. La ftalimida té un valor de pKa de 8,3, i es pot convertir quantitativament en la sal de potassi amb hidròxid de potassi. Aquesta sal de potassi de la ftalimida té un àtom de nitrogen amb càrrega negativa, que es comporta com a nucleòfil cap als halogenurs d'alquil primaris, en un procés de substitució nucleofílica bimolecular (SN2).[9]
El producte d'aquesta reacció és una imida. Per hidrolitzar els dos enllaços d'amida i alliberar l'amina primària desitjada, es pot fer servir ja sigui un àcid o una base aquosos. Un mètode més eficaç per trencar els dos enllaços d'amida és per transferència de l'acil a la hidrazina.[9]
Els halogenurs d'aril no es poden convertir en arilamines amb la síntesi de Gabriel, perquè no pateixen substitució nucleofílica amb la N-potasioftalimida en el primer pas del procediment. Entre els compostos diferents dels halogenurs d'alquil simples, les halocetones i els haloèsters s'han emprat com a substrats en la síntesi de Gabriel. També s'han usat èsters de p-toluenosulfonat d'alquil. Com que la ftalimida només pot tenir una alquilació, no succeeix la formació d'amines secundàries i terciàries, i la síntesi de Gabriel és un procediment valuós per a la preparació d'amines primàries al laboratori.[9]
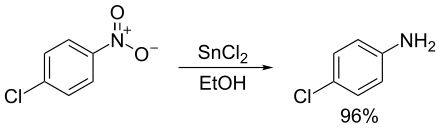
Reducció de composts nitrogenats
[modifica]Quasi qualsevol compost orgànic nitrogenat es pot reduir a una amina. En aquest cas, la síntesi de les amines depèn de la disponibilitat dels precursors adequats i de l'elecció dun agent reductor adequat. Les azides d'alquil, que es preparen per la substitució nucleofílica d'halogenurs d'alquil amb azida de sodi, es redueixen a alquilamines mitjançant diversos reactius, que inclouen l'hidrur d'alumini i liti.[9]
Aplicacions
[modifica]
La morfolina s'empra com a inhibidora de la corrosió en calderes i en olis lubricants, les diarilamines s'empren com a antioxidants per a cautxú i asfalt de cobertes i com a protectors contra les radiacions gamma, la difenilamina s'empra com a estabilitzadors d'explosius de nitrat de cel·lulosa, les diamines aromàtiques s'empren com a reveladors en fotografia, i altres com a agents de flotació en mineria, com a agent anticling i impermeabilitzant per a tèxtils, com a suavitzant de teixits, en recobriment de paper i per a herbicides solubilitzants. Algunes amines polifuncionals són productes farmacèutics valuosos, com l'efedrina i l'adrenalina, i anestèsics, com la novocaïna.[10] Molts altres fàrmacas contenen en la seva molècula grups funcionals amina, com per exemple l'etambutol, emprat en el tractament de la tuberculosi; el bisoprolol, s'utilitza per prevenir l'infart de miocardi i la insuficiència cardíaca i per tractar la hipertensió lleu a moderada; o el salbutamol (Ventolin), que s'utilitza per tractar l'asma, la bronquitis, així com per prevenir els broncoespasmes induïts per l'exercici.[12]
Molts productes importants requereixen amines com a part de la seva síntesi. La metilamina s'utilitza en la producció de l'analgèsic meperidina (nom comercial Demerol) i el desenvolupador fotogràfic Metol (marca comercial), i la dimetilamina s'utilitza en la síntesi de l'antihistamínic difenhidramina (nom comercial Benadryl), el dissolvent dimetilformamida (DMF) i el propulsor de coets 1,1-dimetilhidrazina. La síntesi del repel·lent d'insectes N,N-dietil-m-toluamida (DEET) incorpora dietilamina mentre que la de la fibra sintètica Kevlar requereix amines aromàtiques. Els poliuretans es formen a partir de la metilendianilina mitjançant el seu diisocianat. Altres productes que utilitzen amines en la seva síntesi inclouen spandex, cafeïna, explosius (per exemple, 2,3,4,6-tetranitro-N-metilanilina [TNA] i 2,4,6-N-tetranitroanilina [Tetryl]), pesticides, fungicides, herbicides, colorants azoics i alguns colorants de trifenilmetà.[10]
Toxicitat
[modifica]La majoria de les amines alifàtiques no són altament tòxiques, i moltes són components naturals inofensius dels aliments i productes farmacèutics. En concentracions elevades, però, les amines més petites són molt irritants per a la pell i especialment per a les mucoses dels ulls, el nas, la gola i els pulmons, a les quals poden causar danys aguts en exposició prolongada. Les amines més grans (12 o més àtoms de carboni) solen ser menys irritants. Les amines aromàtiques també són irritants i es poden absorbir a través de la pell. Poden ser verins perillosos. L'anilina, per exemple, destrueix l'hemoglobina de la sang, i l'exposició prolongada s'ha relacionat amb el càncer. Les amines poden ser corrosives per a alguns metalls i plàstics; per tant, s'han d'emmagatzemar en recipients de vidre o d'acer.[10]
Referències
[modifica]- ↑ Travis, Anthony S. Anilines: Historical Background. Chichester, UK: John Wiley & Sons, Ltd, 2007, p. 1–73.
- ↑ Würtz, A. «Sur une série d’alcalis organiques homologues avec l’ammoniaque». Compt. Rend., 28, 1849, pàg. 223.
- ↑ Wisniak, Jaime «Charles-Adolphe Wurtz». Educación Química, 16, 2, 25-08-2018, pàg. 347. DOI: 10.22201/fq.18708404e.2005.2.66127. ISSN: 1870-8404.
- ↑ Würtz, A. «Recherches sur les ammoniaques composées». Compt. Rend. Hebd. Séances Acad. Sci., 29, 1849, pàg. 169-172.
- ↑ Würtz, A. «Mémoire sur una sèrie d'alcaloïdes homologues avec l'ammoniaque». Ann. Chim. Ph., 1850, pàg. 443-506.
- ↑ Hofmann, A. «XXI. On Ammonia and its Derivatives». The Quarterly journal of the Chemical Society of London, 11, 1859, pàg. 252-319.
- ↑ Pelouze, Théophile Jules. Traité de Chimie Général, Analytique, Industrielle et Agricole (1860-1866). IV. París: Victor Masson et Fils, 1860-1866, p. 455.
- ↑ 8,0 8,1 8,2 Unió Internacional de Química Pura i Aplicada. Comissió de Nomenclatura de Química Orgànica. Guia de la IUPAC per a la nomenclatura de compostos orgànics : recomanacions del 1993 (incloent-hi les revisions, tant publicades com no publicades fins ara, de l'edició del 1979 de la Nomenclature of organic chemistry), febrer del 2017. ISBN 978-84-9965-333-4.
- ↑ 9,00 9,01 9,02 9,03 9,04 9,05 9,06 9,07 9,08 9,09 Carey, Francis A. Química orgánica. 6a ed. México: McGraw Hill, 2006. ISBN 970-10-5610-8.
- ↑ 10,00 10,01 10,02 10,03 10,04 10,05 10,06 10,07 10,08 10,09 10,10 10,11 10,12 10,13 10,14 10,15 «amine» (en anglès). Encyclopædia Britannica, 2003.
- ↑ Madan, R. L.. Organic chemistry. Multicolour ed. New Delhi: Tata McGraw-Hill, 2013. ISBN 978-1-259-00618-0.
- ↑ «Amines | DrugBank Online». [Consulta: 10 abril 2022].