Óxidos de nitrógeno
El término (NxOy) se aplica a varios compuestos químicos binarios gaseosos formados por la combinación de oxígeno y nitrógeno. El proceso de formación más habitual de estos compuestos inorgánicos es la combustión a altas temperaturas, proceso en el cual habitualmente el aire es el comburente.
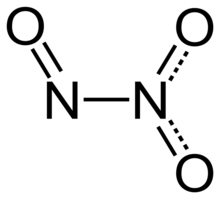
En función de la valencia atómica que utilice el nitrógeno, los óxidos de nitrógeno tienen distintas formulaciones y se aplican para ellos diferentes nomenclaturas:[1][2]
| Fórmula | Nomenclatura sistemática | Nomenclatura de Stock | Nomenclatura tradicional |
|---|---|---|---|
| N2O | Monóxido de dinitrógeno | Óxido de nitrógeno (I) | Óxido nitroso (anhídrido hiponitroso) |
| NO | Monóxido de nitrógeno | Óxido de nitrógeno (II) | Óxido nítrico |
| N2O3 | Trióxido de dinitrógeno | Óxido de nitrógeno (III) | Anhídrido nitroso |
| N2O4 | Tetraóxido de dinitrógeno | Óxido de nitrógeno(IV) | Tetraóxido de nitrógeno |
| NO2 | Dióxido de nitrógeno | Óxido de nitrógeno (IV) | Dióxido de nitrógeno |
| N2O5 | Pentaóxido de dinitrógeno | Óxido de nitrógeno (V) | Anhídrido nítrico |
El monóxido de nitrógeno y el dióxido de nitrógeno constituyen dos de los óxidos de nitrógeno más importantes toxicológicamente; ninguno de los dos es inflamable.
El monóxido de nitrógeno es un gas a temperatura ambiente de olor dulce penetrante, fácilmente oxidable a dióxido de nitrógeno. Mientras que el dióxido de nitrógeno tiene un fuerte olor desagradable. El dióxido de nitrógeno es un líquido a temperatura ambiente, pero se transforma en un gas pardo-rojizo a temperaturas sobre los 21 °C.
El nitrógeno diatómico gaseoso al estar formado por un enlace triple, es muy poco reactivo, pero en las combustiones llevadas a cabo a altas temperaturas, el nitrógeno logra reaccionar con el oxígeno (que es muy reactivo) formando diversos tipos de óxidos de nitrógeno.
Los óxidos de nitrógeno son liberados al aire desde los tubos de escape de vehículos motorizados (sobre todo diésel y de mezcla pobre), de la combustión del carbón, petróleo o gas natural, y durante procesos tales como la soldadura por arco, galvanoplastia, grabado de metales y detonación de dinamita. También son producidos comercialmente al hacer reaccionar el ácido nítrico con metales o con celulosa.
Los óxidos de nitrógeno también se generan en la naturaleza, siendo las causas más frecuentes los rayos, los incendios forestales, la actividad volcánica y la descomposición bacteriana de determinados nitratos.
Los óxidos de nitrógeno, una vez liberados al aire por las combustiones (NOx) forman, a través de reacciones fotoquímicas, contaminantes secundarios, por ejemplo el PAN (nitrato de peroxiacetilo), formando el smog fotoquímico o niebla tipo Los Ángeles, típica de las zonas con gran concentración de vehículos de motor. Las reacciones producidas en la atmósfera por estos compuestos son muy complejas, e intervienen radicales OH, O3, NO, y otros.
Los óxidos también indica varios compuestos cuya combinación viene del oxígeno mezclado con el nitrógeno. Los óxidos de nitrógeno son usados en la producción de ácido nítrico, lacas, tinturas y otros productos químicos, como combustibles para cohetes, en la nitrificación de compuestos químicos orgánicos y en la manufactura de explosivos. Los motores que más los producen son los diésel y los motores de mezcla pobre.
Debido a sus efectos adversos en la salud se han regulado sus niveles con normas ambientales y/o sanitarias. En la Unión Europea, la Directiva europea 50/2008 (que cada estado miembro debe trasponer a su legislación, en España lo hizo el RD 102/2011) fija los niveles máximos horarios, el nivel máximo de media anual, y el número máximo de días en que se pueden superar los niveles máximos horarios. En España muchas zonas urbanas no cumplen estos niveles.
A partir de la norma Euro 3 (año 2000) se establecen unos límites de NOx para los fabricantes de automoción
Véase también
editarReferencias
editar- ↑ Formulación y nomenclatura en Química Inorgánica. Universidad de Cádiz, España.
- ↑ Chang, Raymond. Química, Cuarta Edición, McGraw-Hill, 1997.