Espermatozoide
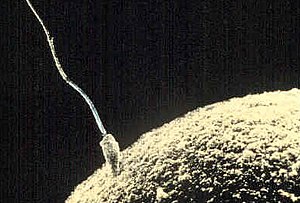
Un espermatozoide (del francés spermatozoïde, derivado del griego σπέρμα, (spérma) ‘semilla’, ζῷον (zôion) 'animal' y el sufijo -oïde ‘parecido a’)[1] es una célula haploide que constituye el gameto masculino.[2] Es una de las células más diferenciadas y su función es la formación de un cigoto totipotente al fusionarse su núcleo con el del gameto femenino, fenómeno que dará lugar, posteriormente, al embrión y al feto. En la fecundación de los mamíferos, los espermatozoides son los que determinan el sexo de la nueva célula diploide (embrión), ya que contienen un cromosoma sexual X o un cromosoma Y.[3]
Historia
[editar]El espermatozoide fue descrito por primera vez en 1677 por el científico Anton van Leeuwenhoek y visualizado por Johan Ham, un estudiante de medicina que comentó haber visto unos pequeños 'animálculos' en el semen. Ham pensaba que esos pequeños animales eran fruto de la putrefacción del líquido seminal. Leeuwenhoek, al contrario, supuso que se trataba de un componente habitual del semen y realizó la primera descripción detallada de los espermatozoides. Además, fue la primera persona en proponer que la fecundación ocurría por la entrada del espermatozoide dentro del óvulo.
En 1694 el científico holandés Nicolás Hartsocker propuso la teoría del homúnculo. Hartsocker estaba dedicado a investigar sobre el origen de la vida, y la observación de los espermatozoides al microscopio le llevó a pensar que dentro de cada uno de ellos había un homúnculo o ser humano en miniatura. Su teoría establecía que en cada uno de los espermatozoides ya se encuentra en potencia el ser humano que después va a ir desarrollándose en el vientre femenino.
Posteriormente fue Lazzaro Spallanzani, un fisiólogo y sacerdote italiano, quien investigó la incógnita de la fecundación y el papel que jugaba el espermatozoide en aquel proceso. En uno de sus experimentos tomó huevos vírgenes y líquido seminal de ranas y los puso en contacto, logrando la fecundación de los primeros. Este trabajo se podría considerar como el primer trabajo sobre fecundación (o inseminación) artificial realizado a partir del método experimental.[cita requerida] Alrededor de 1790 se dedicó a investigar la inseminación artificial en perros; inyectó con una jeringa espermatozoides a una perra y esta quedó preñada. Estos experimentos demostraron la importancia del espermatozoide en el proceso de la fecundación, y los consecuentes descubrimientos sirvieron de base para que el cirujano inglés Hunter intentara su aplicación a la especie humana.
Espermatogénesis
[editar]
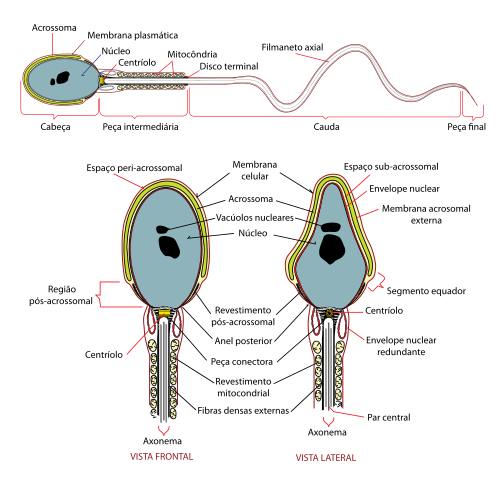
La espermatogénesis es el proceso en el cual los espermatozoides se producen a partir de las células germinales primordiales del hombre (espermatogonias) mediante mecanismos de mitosis y meiosis. Es el mecanismo de gametogénesis en el hombre y se desarrolla en los testículos (gónadas masculinas), aunque la maduración final de los espermatozoides se lleva a cabo en el epidídimo. Este proceso de espermatogénesis en el humano dura aproximadamente 64-74 días, de esta forma, cualquier mutación, exposición a radiación u otros factores, afectan al semen secretado 74 días después de la exposición.[4] Los espermatozoides son células reproductoras masculinas, destinadas a la fecundación del óvulo; miden de diez a sesenta micras de longitud y están compuestas de una cabeza que contiene el material cromosómico y de una cola o flagelo que actúa como propulsor.[4][5][6]
Estructura del espermatozoide humano
[editar]Los espermatozoides en el ser humano son de forma piriforme, solo sobreviven en un medio ambiente cálido, aunque entre 1 y 3 °C por debajo de la temperatura corporal, y son las únicas células humanas en poseer flagelo; esto la ayuda a ser una célula con alta movilidad, capaz de nadar libremente.
Se componen principalmente de dos partes: una cabeza y su flagelo, pero dentro de ellas podemos distinguir varias estructuras, las cuales, en orden cefálico-caudal (de la cabeza a la cola, es decir, de arriba abajo), son: acrosoma, núcleo, membrana, cuello, pieza media, cola y pieza terminal.
Viven de media 24 horas, aunque es posible que lleguen a fecundar el óvulo después de tres días.[cita requerida]
Cabeza: acrosoma, membrana y núcleo
[editar]La cabeza contiene dos partes principales: el acrosoma, que cubre los dos tercios anteriores de la cabeza; y el núcleo, que contiene la carga genética del espermatozoide (23 cromosomas, en el pronúcleo, que, unidos a los 23 del óvulo dan lugar a la célula madre, al sumarse el total de 46 cromosomas, agrupados en pares). En los seres humanos la medida de la cabeza del espermatozoide es de 5 µm (micrómetros) de longitud. Tanto el pronúcleo como el acrosoma están envueltos en medio de una pequeña cantidad de citoplasma y revestidos por una membrana plasmática que une la cabeza al cuerpo del espermatozoide. Es la parte más importante adjunto con el cuerpo. Esta membrana tiene altos niveles de ácidos grasos poliinsaturados que son las principales responsables de la movilidad del esperma.[7]

El acrosoma es una capa formada por las enzimas hialuronidasa, acrosina y neuraminidasa que favorecerán la rotura de la zona pelúcida para la penetración, la cual rodea al ovocito. También, la hialuronidasa se ha demostrado ser (junto con el movimiento producido por la cola, el flagelo) los responsables de nadar a través del cúmulo de células (cumulus oophorus) que rodea al gameto femenino apartándolas y permitiendo llegar hasta el ovocito. La función de la enzima hialuronidasa consiste en degradar la matriz en la cual las células se encuentran unidas.
El núcleo, después de que el acrosoma abra la zona pelúcida del ovocito, es la única parte que entra a su citoplasma,[cita requerida] dejando atrás la membrana ya vacía, para luego fusionarse con el núcleo del óvulo, completarse como célula diploide y empezar la división celular (mitosis).
Por lo tanto, como las mitocondrias y todo lo demás del gameto masculino no se unen al cigoto, todas las mitocondrias de la nueva célula provienen de la parte materna.
La cromatina de un espermatozoide maduro está altamente condensada debido al reemplazo de las histonas con protaminas durante la espermatogénesis.[8]
Flagelo: cuello, pieza media, cola, pieza terminal
[editar]
El cuello es muy corto, por lo que no es visible mediante el microscopio óptico. Es ligeramente más grueso que las demás partes del flagelo y contiene residuos citoplasmáticos de la espermátida. Tras estos elementos contiene dos centriolos: el distal, que origina la pieza media, y el otro, el proximal, desaparece luego de haber dado origen al flagelo.[9] Contiene una placa basal de material denso que lo separa de la cabeza y es donde se anclan 9 columnas proteicas, que son centriolos modificados, continuándose por toda la cola. De uno de ellos (el distal) se origina la pieza media.
- La pieza media (de unos 4 o 5 μm de longitud) posee una gran cantidad de mitocondrias concentradas en una vaina helicoidal, que proveen de energía al espermatozoide, produciendo ATP. El espermatozoide necesita esta energía para realizar su recorrido por el cérvix, el útero y las trompas de Falopio femeninas hasta llegar al ovocito para fecundarlo.
- La cola (de 35 μm) le proporciona movilidad (zona flagélica funcional recubierta solo de membrana).
- La cola le proporciona movilidad, y ésta puede ser de tipo A, B, C o D; según se observe en el seminograma. Tipo A correspondería a los espermatozoides con movimiento rectilíneo a una velocidad mayor de 25 micras/s, frente a las 5-24 micras/s del tipo B los cuales tienen un movimiento sin trayectoria definida, una velocidad inferior a 5 micras/s para el tipo C, los cuales apenas se desplazan aunque sí se detecta movimiento en ellos, y un movimiento nulo para el tipo D. Por tanto, se agrupan en movimientos progresivos (tipo A y B) y no progresivos (C).
Movilidades anormales se corresponden con porcentajes menores al 50 % de A+B o 25 % de A —anotar que la movilidad de tipo A es poco común en el esperma de la población (en torno al 1 %)—. Estas anormalidades reciben el nombre de astenozoospermia o astenospermia; distinguiéndose entre leve, moderada y grave.
Características exclusivas según especie
[editar]Existe una relación indirecta entre el volumen de eyaculado y la concentración de espermatozoides en las distintas especies:
- En los seres humanos, los espermatozoides poseen una cabeza de 5 a 8 µm y una cola de 50 µm de longitud. Poseen una velocidad de 3 milímetros por minuto. El eyaculado humano normal es de 2 a 6 ml (mililitros), y transporta entre 60 y 300 millones de espermatozoides (según la duración de la abstinencia previa). Para fertilizar al óvulo ha de haber más de 20 millones de espermios por ml.
- En los cerdos, la eyaculación es de unos 100 a 600 ml, con una concentración de 300 000 a 1 000 000 de espermatozoides/mm³.[10] La longitud de los espermatozoides es de unos 90 μm.
En parte de los mamíferos, incluidos los seres humanos, los espermatozoides deben ser producidos a una temperatura más baja que la media del organismo (2 °C menos de lo normal en humanos), por ello las gónadas masculinas se encuentran fuera del cuerpo.
Epigenética en el espermatozoide
[editar]El desarrollo de las células germinales primordiales hasta espermatozoides maduros es una etapa clave para la reprogramación epigenética. La metilación del ADN y la modificación de histonas producen cambios en la gametogénesis; y alteraciones a cualquier nivel del epigenoma del espermatozoide puede afectar a la fertilidad y al correcto desarrollo del embrión.
Patrones de metilación en las células germinales masculinas
[editar]Estudios recientes en ratones y humanos muestran que las células germinales masculinas poseen un único patrón de metilación en comparación con los tejidos somáticos. Los patrones de metilación de promotores en el esperma, como la hipometilación, permitirían la expresión de genes específicos de las células germinales involucrados en la espermatogénesis; mientras que la hipermetilación daría lugar a la represión de la pluripotencia y de genes específicos de tejidos somáticos. Muchos de estos sitios con metilación diferente en el esperma y en tejidos somáticos se encuentran fuera de regiones génicas y de islas CpG, por lo que parece que juegan otros papeles además de controlar la expresión génica. Los patrones de metilación en secuencias centroméricas e intergénicas pueden ser necesarias para que se forme la estructura cromatínica especializada que encontramos en las células germinales.
Los patrones de metilación de las células somáticas se establecen temprano durante la vida embrionaria y se mantienen en el desarrollo y en el adulto. Las células germinales, sin embargo, van a sufrir dos oleadas de desmetilación para poder establecer patrones específicos de sexo que dan lugar a los genes improntados. Al contrario que en el óvulo, los patrones epigenéticos de los espermatozoides se empiezan a adquirir prenatalmente. La adquisición inicial se relaciona con la expresión de Dnmt3a y Dnmt3L, lo cual es consistente con el papel de las enzimas DNMT3 como metiltransferasas de novo. Estos patrones se completan después del nacimiento en la fase paquinema de la meiosis.[11]
Remodelación de la cromatina
[editar]La cromatina del esperma de los mamíferos es única, pues está altamente organizada, condensada y compactada. La remodelación cromatínica está facilitada por la hiperacetilación de las histonas y por el ADN topoisomerasa II, la cual produce mellas temporales en el ADN para aliviar el estrés torsional debido al superenrollamiento.
Las protaminas condensan las cadenas de ADN y forman una unidad de empaquetamiento básica de la cromatina llamada toroide. Confieren un nivel mayor de empaquetamiento del ADN al de las células somáticas. Todo esto protege a la cromatina durante el transporte a través del tracto reproductivo masculino y femenino. Además, las protaminas son necesarias para el silenciamiento del genoma paterno y la reprogramación del patrón de impronta del gameto. Sin embargo, un 15 % de las histonas no son reemplazadas en la cromatina del esperma humano, causando que esté menos compactada.
En la espermatogénesis, las protaminas sustituyen progresivamente las histonas de forma escalonada. Primero, las histonas somáticas se reemplazan por variantes de histonas específicas de los testículos. En la espermiogénesis las variantes de histonas específicas de tejido se cambian por proteínas de transición (TP1 y TP2) en un proceso que requiere la remodelación del ADN. Las proteínas de transición son necesarias para la normal condensación de la cromatina, para reducir el número de roturas del ADN y para prevenir la formación de defectos secundarios en los espermatozoides y la pérdida eventual de la integridad genómica. Finalmente, en la elongación de las espermátides, las proteínas de transición se sustituyen por protaminas. Este proceso secuencial facilita la remodelación molecular del genoma masculino en la diferenciación de la espermátida.
En humanos, la ratio P1/P2 es aproximadamente de 1.0 y alteraciones en este cociente se asocian con infertilidad. Las protaminas tienen aproximadamente la mitad del tamaño de las histonas. Son proteínas nucleares básicas que se caracteriza por un núcleo rico en argininas y residuos de cisteínas. Los niveles altos de arginina causan una carga neta positiva, facilitando así su unión al ADN. Asimismo, los residuos de cisteína facilitan la formación de múltiples puentes disulfuro inter e intraprotaminas, que son esenciales para el empaquetamiento en orden superior de la cromatina. Las protaminas P2 contienen menos grupos de cisteínas, lo que provoca que el ADN sea más susceptible al daño.[12]
Véase también
[editar]Referencias
[editar]- ↑ Real Academia Española y Asociación de las Academias de la lengua española. «Diccionario de la lengua española: espermatozoide». Consultado el 20 de febrero de 2021.
- ↑ Audesirk, Teresa; Audesirk, Gerald; Byers, Bruce E. (2003). Biología: la vida en la tierra. Pearson Educación. ISBN 9789702603702. Consultado el 9 de agosto de 2017.
- ↑ Scott F. Gilbert (2005). «17:Determinación del sexo». Biología del desarrollo (7.ª edición). Médica Panamericana. p. 586.
- ↑ a b «Tema 26.4C: Spermatogenesis». Medicine LibreTexts (en inglés). 24 de julio de 2018. Consultado el 23 de agosto de 2020.
- ↑ Alan W. Partin (2021). «Male Reproductive Physiology». Campbell-Walsh-Wein Urology.
- ↑ Tharu Tharakan, Suks Minhas, Channa N. Jayasena (2021). 2:Physiology. «Male Sexual and Reproductive Health». Comprehensive Pharmacology.
- ↑ Lozano, G. M., Bejarano, I., Espino, J., González, D., Ortiz, A., García, J. F., Rodríguez, A. B., Pariente, J. A. (2009). «Relationship between Caspase Activity and Apoptotic Markers in Human Sperm in Reponse to Hydrogem Peroxide and Progesterone.» Journal of Reproduction and Development 55(6): 615-621.
- ↑ Lozano, G. M., Bejarano, I., Espino, J., González, D., Ortiz, A., García, J. F., Rodríguez, A. B., Pariente, J. A. (2009). «Density gradient capacitation is the most suitable method to improve fertilization and to reduce DNA fragmentation positive spermatozoa of infertile men.» Anatolian Journal of Obstetrics & Gynecology 3(1): 1-7.
- ↑ Real Academia Nacional de Medicina (ed.). «espermatozoide». Diccionario de términos médicos. Consultado el 12 de septiembre de 2020.
- ↑ Padilla Pérez, Manuel (2007). «Uso de la inseminación artificial porcina: lo que aún no sabiamos | Razas Porcinas - Cría y Producción Porcina y de Carne». razasporcinas.com. Consultado el 28 de enero de 2021.
- ↑ Zini, Armand; Ashok Agarwal (2011). «7». Sperm Chromatin (en inglés). Springer. ISBN 978-1-4419-1781-2.
- ↑ «7». Sperm Chromatin (en inglés). Springer. 2011. ISBN 978-1-4419-1781-2.
Enlaces externos
[editar]- Nature.com («La vida secreta del espermatozoide», artículo de la revista Nature).
- La longitud de cabeza y cola no aportan ventaja a los espermatozoides en su carrera hasta el óvulo.