Tautómero
Tautómeros (del griego tauto = igual y griego meros = la parte) se denominan dos isómeros que se diferencian solo en la posición de un grupo funcional. Entre las dos formas existe un equilibrio químico. En un equilibrio tautomérico hay migración de un grupo o átomo.
Puede clasificarse en:
- Desmotropía o seudomería cuando los tautómeros pueden ser aislados o no.
- Cationotropía o anionotropía cuando el grupo que migra es un catión o un anión respectivamente. El caso en que el grupo migrante sea el catión hidrógeno recibe el nombre de prototropía.
Los tautómeros a menudo difieren en la posición de un grupo y en la posición de un doble enlace:
Los cationes monovalentes como el protón o los aniones monovalentes como los iones cloruro, hidróxido o acetato pueden considerarse como un grupo migratorio. Si un doble enlace se reemplaza por una formación de anillo a partir de enlaces simples, se habla del tautomerismo de la cadena de anillo:[1]
La tautomería no debe confundirse con la mesomería, en la que una misma molécula se describe mediante diferentes fórmulas resonantes.
Prototropía
[editar]La prototropía es la forma más común de tautomería y se refiere a la reubicación de un protón.[1] La tautomería prototrópica puede considerarse un subconjunto del comportamiento ácido-base. Los tautómeros prototrópicos son conjuntos de estados de protonación isoméricos con la misma fórmula empírica y carga total. Las tautomerizaciones son catalizadas por:
- Bases, que implican una serie de pasos: desprotonación, formación de un anión deslocalizado (por ejemplo, un enolato) y protonación en una posición diferente del anión; y
- Ácidos, que implican una serie de pasos: protonación, formación de un catión deslocalizado y desprotonación en una posición diferente adyacente al catión).
Dos subcategorías específicas adicionales de tautomerizaciones:
- La tautomería anular es un tipo de tautomería prototrópica en la que un protón puede ocupar dos o más posiciones de un sistema heterocíclico, por ejemplo, 1H- y 3H-imidazol; 1H-, 2H- y 4H- 1,2,4-triazol; 1H- y 2H-isoindol.[2]
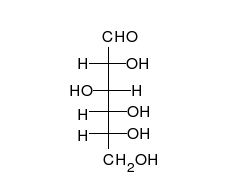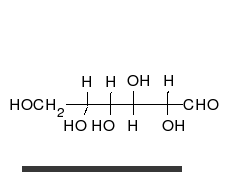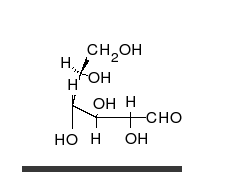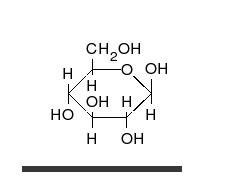
- Los tautómeros de cadena-anillo se producen cuando el movimiento del protón se acompaña de un cambio de una estructura abierta a un anillo, como la cadena abierta y el hemiacetal cíclico (típicamente formas de piranosa o furanosa) de muchos azúcares.[3]
Tautomería de valencia
[editar]
La tautomería de valencia es un tipo de tautomería en la que los enlaces simples y/o dobles se forman y rompen rápidamente, sin migración de átomos o grupos.[4] Es distinto de la tautomería prototrópica e implica procesos con una rápida reorganización de los electrones de enlace.
Un ejemplo de par de tautómeros de valencia con fórmula C6H6O son el óxido de benceno y la oxepina.[4][5]
Otros ejemplos de este tipo de tautomería se pueden encontrar en bullvaleno y en formas abiertas y cerradas de ciertos heterociclos, como las azidas orgánicas y tetrazoles,[6] o la münchnona mesoiónica y acilaminocetena.
La tautomería de valencia requiere de un cambio en la geometría molecular y no debe confundirse con estructuras de resonancia canónica o mesómeros.
La tautomería ceto-enol
[editar]
La tautomería más conocida es la tautomería ceto-enol. Los enoles (compuestos que cuentan con un grupo hidroxilo unido a un carbono con un doble enlace carbono-carbono) resultantes de la migración formal de un hidrógeno de un carbono en posición alfa al oxígeno del grupo carbonilo.
Generalmente se trata de un equilibrio con predominio de la forma ceto aunque la cantidad de cada forma depende de la estabilidad relativa de ambos tautómeros;[7] afectada por la capacidad de formación de puentes de hidrógeno por parte del disolvente, una posible conjugación de los dobles enlaces o la formación de un puente de hidrógeno intramolecular como en el caso de la acetilacetona que desplaza el equilibrio hacia la forma enólica.
La tautomerización puede ser catalizada tanto por ácidos como por bases.[8][9]
En la catálisis por bases, la base extrae un hidrógeno alfa de la forma cetónica formando un anión enolato; la deslocalización de la carga y posterior protonación del anión lleva a la forma enólica, como muestra la siguiente imagen

En la catálisis por ácidos, se protona el oxígeno del grupo carbonilo. La desprotonación de un carbono alfa da la forma enolíca.

A su vez, este tautomerismo nos permite reemplazar los hidrógenos con deuterio al hacer reaccionar una cetona con un ácido o una base en presencia de deuterio D2O utilizado como disolvente, proceso que puede ser seguido mediante 1H RMN y que nos da la ventaja de saber cuántos hidrógenos alfa posee la molécula en cuestión.
Otra característica interesante de esta tautomería es que la misma puede inducir la estereoisomerización, como nos muestra esta cis-ciclopentanona 2,3-disustiuida que se transforma en su isómero trans que se encuentra menos impedido y por lo tanto es energéticamente más favorable.

Porcentaje de la forma enol en el equilibrio para diferentes compuestos
[editar]- Propanona (=acetona): 0,00025 %
- 2,3-Butanodiona (=diacetil o diacetilo): 0,0056 %
- Ciclohexanona: 0,02 %
- Acetilacetona: 84,2%
Tautomería ceto-enodiol
[editar]Las α-hidroxicetonas (aciloínas) tienen una forma especial de tautomerismo ceto-enólica. Cuando el tautómero ceto se encuentra vecino a un hidroxilo, procede la Transposición de Lobry de Bruyn–van Ekenstein:
El 2-hidroxipropanal tiene un grupo hidroxilo en el átomo α del carbono carbonílico (el segundo átomo de carbono). Esto también polariza el enlace C-H en el átomo α a través de su efecto inductivo negativo y, por lo tanto, facilita la separación de un protón. Un enodiol se forma como una molécula con un doble enlace y dos grupos hidroxi vecinos. La reorganización de un protón puede convertirlo nuevamente en una molécula con un oxígeno carbonílico, en este caso una cetona:
 | |
|
Aquí también hay isomería de posición, ya que la 2-hidroxipropanal y la 1-hidroxipropanona difieren solo en las posiciones de los grupos hidroxilo y carbonilo.
La epimerización es también una tautomerización: en disolución acuosa, los epímeros, como las aldosas, que difieren solo en la posición del grupo hidroxilo en el segundo átomo de carbono, se convierten entre sí. Ejemplos de epímeros pares: glucosa/manosa, ribosa/arabinosa, eritrosa/treosa , D-gliceraldehído/L-gliceraldehído...
Tautomería imina-enamina
[editar]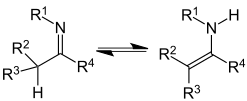 |

|
| Tautomería imina-enamina | La histidina presenta tautomería imina-enamina. |
Tautomería nitroso-oxima
[editar]Los compuestos con un grupo nitroso están en equilibrio con su forma oxima en disolución ácida. El rendimiento suele ser del 100% en el lado de la oxima.
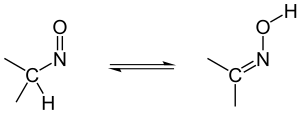
|
Tautomería fosfito-fosfonato
[editar]Al igual que con el ácido fosforoso, los H-fosfonatos, como los H-fosfinatos, y los óxidos de fosfina secundarios, muestran un equilibrio tautomérico prototrópico entre la forma tautomérica del óxido (O=PH<) tetracoordinado y la forma hidróxido (HO-P<) tricoordinada (un átomo de hidrógeno se mueve de un átomo de P al oxígeno).

|
Referencias
[editar]- ↑ a b IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Online version (2019-) created by S. J. Chalk. ISBN 0-9678550-9-8. https://doi.org/10.1351/goldbook.T06252
- ↑ Roman M. Balabin (2009). «Tautomeric equilibrium and hydrogen shifts in tetrazole and triazoles: Focal-point analysis and ab initio limit». J. Chem. Phys. 131 (15): 154307. Bibcode:2009JChPh.131o4307B. PMID 20568864. doi:10.1063/1.3249968.
- ↑ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed. edición). New York: Wiley-Interscience. ISBN 978-0-471-72091-1.
- ↑ a b IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Online version (2019-) created by S. J. Chalk. ISBN 0-9678550-9-8. https://doi.org/10.1351/goldbook.V06591
- ↑ E. Vogel and H. Günther (1967). «Benzene Oxide-Oxepin Valence Tautomerism». Angewandte Chemie International Edition in English 6 (5): 385-401. doi:10.1002/anie.196703851.
- ↑ Lakshman Mahesh K., Singh Manish K., Parrish Damon, Balachandran Raghavan, Day Billy W. (2010). «Azide−Tetrazole Equilibrium of C-6 Azidopurine Nucleosides and Their Ligation Reactions with Alkynes». The Journal of Organic Chemistry 75 (8): 2461-2473. PMC 2877261. PMID 20297785. doi:10.1021/jo902342z.
- ↑ Vollhardt, K.P. Schore, N. Química Orgánica. 3.ª edición. Barcelona. Omega. 2000. pp 784 y ss. ISBN 84-282-1172-8.
- ↑ Antonov, L (editor). Tautomerism: Methods and Theories. Wiley-VCH, 2013. ISBN 978-3-527-33294-6
- ↑ McMurry, John. Química Orgánica. 6a edición. México DF. Thomson. 2004. pp 820 y ss. ISBN 970-686-354-0



