Ion
Un ion est un atome ou un groupe d'atomes portant une charge électrique, parce que son nombre d'électrons est différent de son nombre de protons. On distingue deux grandes catégories d'ions : les cations, chargés positivement, et les anions, chargés négativement.

Le signe et la valeur de cette charge électrique sont indiqués en exposant à la fin de la formule chimique de l'ion, en multiple de la charge élémentaire e (quand l'ion ne porte qu'une charge, on n'indique que le signe). Exemples : Cu2+ représente l'ion cuivre (II) de charge 2e, Na+ l'ion sodium de charge e, Cl− l'ion chlore de charge −e.
Un composé ionique est un composé chimique constitué d'ions positifs et négatifs, mais globalement neutre.
Étymologie
modifierLe substantif masculin[1],[2],[3] ion a été emprunté à l'anglais ion[1],[2],[3], mot formé en 1834 par le physicien britannique Michael Faraday[2] par emprunt au grec ancien ἰόν[2] (ion), se traduisant par « allant, qui va », participe présent neutre du verbe ἰέναι, « aller ».
Histoire
modifierLe nom « ion » a été donné en 1834 par Michael Faraday, pour désigner les espèces chimiques responsables de la conductivité électrique dans les solutions. Faraday voulait expliquer le transport du courant dans les solutions d'électrolytes. Ce néologisme sert d'abord à désigner les espèces chimiques migratrices vers l'anode ou la cathode d'une pile ou d'une batterie : il provient simplement du grec ἰών / iốn, participe présent de εἶμι / eĩmi, « aller ». L'Académie des sciences l'enregistre dans la langue française en 1842. Faraday pense que la décomposition ionique est provoquée par le courant électrique. Mais les études ultérieures au voisinage des électrodes montrent des difficultés, en particulier pour comprendre l'apparition des produits de l’électrolyse aux électrodes. Pour garder une cohérence à la théorie, il faut se résoudre à affirmer que les ions apparaissent simplement, lorsque les sels se dissolvent naturellement dans des phases liquides et sont donc présents, antérieurement à toute excitation électrique ou application d'un champ électrique important. L'explication de la dissolution des sels est longtemps restée une énigme : ce sont les physiciens et chimistes pionniers en électrochimie qui, étudiant la conductibilité électrique des solutions, ont soupçonné une possible voie de recherche. Theodor Grotthuss, Rudolf Clausius, Johann Wilhelm Hittorf, Edward Frankland, Wilhelm Ostwald, Svante August Arrhenius sont des partisans de la théorie de l'ionisation en solution.
Dès 1853, Hittorf étudie les variations de concentrations au voisinage des électrodes. Il en conclut que les ions d'une solution migrent avec des vitesses différentes vers les électrodes. Il caractérise les ions par un nombre de transport et affirme que la conductivité est fonction de la réactivité chimique. Clausius démontre en 1857 la validité de la loi d'Ohm pour la solution d'électrolytes et postule l'existence d'ions libres avant toute application du champ électrique. Kohlrausch étudiant les électrolytes forts (entièrement dissociés) démontre que la conductivité limite d'une solution est la somme des mobilités électriques des ions. Les travaux théoriques de Jacobus Henricus van 't Hoff et François-Marie Raoult sur les solutions salines permettent vers 1880 la prise en compte globale de leurs propriétés : osmotiques, tonométriques, cryoscopiques et ébulliométriques.
En 1885, le Suédois Svante August Arrhenius répond à ce « cahier des charges » en proposant une explication théorique, acceptée non sans une profonde résistance durable par une majeure partie de la communauté scientifique, du mécanisme de conduction en solution, théorie pour laquelle il est récompensé plus tard par le prix Nobel de chimie en 1903. Cette théorie qui pose les fondements de la chimie ionique met aussi à l'épreuve : les considérations sur les équilibres, validant ainsi la loi de Guldberg et Waage, et les raisonnements de Marcellin Berthelot sur l'effet thermique des réactions.
Des faisceaux d’ions de haute énergie sont utilisés en physique atomique, physique nucléaire et physique des particules (voir accélérateur de particules). Des faisceaux de basse énergie sont utilisés dans l'analyse des surfaces (voir SIMS).
Cations et anions
modifierPuisque la charge électrique d'un proton (+) est égale en intensité à la charge d'un électron (−), la charge électrique de l'ion est égale au nombre de protons moins le nombre d'électrons.
Un anion (−), du ἄνω / ánō, « vers le haut », est un ion ayant plus d'électrons que de protons, ce lui donne une charge nette négative (car les électrons sont chargés négativement et les protons sont chargés positivement)[4]. Exemples : Cl− pour l'ion chlorure (ou chlorure), Br− pour l'ion bromure (ou bromure).
Un cation (+), du grec κάτω / kátō, « vers le bas », est un ion ayant moins d'électrons que de protons, ce lui donne une charge nette positive. Exemples : K+ pour l'ion potassium, Ca2+ pour l'ion calcium.
Il existe d'autres noms pour les ions à charge multiple. Par exemple, un ion avec une charge −2 est connu comme un dianion, et un ion avec une charge +2 est connu comme un dication.
On notera le cas particulier du zwitterion, qui est une molécule neutre avec des charges positives et négatives à différents endroits de la molécule[5].
Les cations et les anions peuvent être classés en fonction de la taille de leur rayon ionique. Les cations sont relativement de petite taille : la plupart d'entre eux ont un rayon de 0,8 × 10−10 m (0,8 Å), tandis que les anions sont généralement plus grands, avec un rayon de 1,3 × 10−10 m (1,3 Å). De ce fait, il est évident que la majorité de l'espace dans les cristaux ioniques est occupé par les anions, avec les cations qui s'insèrent entre eux[6].
Classification
modifierLes ions sont caractérisés par :
- la nature de leur charge :
- cations : ions chargés positivement,
- anions : ions chargés négativement,
- zwitterions : molécules neutres mais possédant des charges positives et négatives (acides aminés…) ;
- le nombre d'atomes qui les composent :
- monoatomiques : ions constitués d’un seul atome,
- polyatomiques : ions constitués d’au moins deux atomes ;
- leur composition :
- leur dépendance du pH :
- ions forts : dissociation complète quel que soit le pH :
- anions : sulfonate, sulfate, halogénures, etc.,
- cations : ammonium quaternaire, Na+, K+, Mg2+, Ca2+, etc.,
- ions faibles : dissociation partielle dépendante du pH :
- anions : carboxylate…,
- cations : ammoniums tertiaire, secondaire et primaire, etc.
- ions forts : dissociation complète quel que soit le pH :
Composés ioniques
modifierUn composé ionique est un composé chimique créé par association d'ions.
| Composés ioniques | Formules | Ions |
|---|---|---|
| Chlorure de sodium (sel) | NaCl | Na+ et Cl− |
| Hydroxyde de sodium (soude) | NaOH | Na+ et OH− |
| Hydroxyde de potassium (potasse) | KOH | K+ et OH− |
| Sulfate de cuivre | CuSO4 | Cu2+ et SO42− |
| Nitrate d'argent | AgNO3 | Ag+ et NO3− |
| Chlorure d'argent | AgCl | Ag+ et Cl− |
| Permanganate de potassium | KMnO4 | K+ et MnO4− |
| Dichromate de potassium | K2Cr2O7 | 2 K+ et Cr2O72− |
| Chlorure de fer (III) | FeCl3 | Fe3+ et 3 Cl− |
Électroneutralité
modifierComme tous les composés chimiques, les composés ioniques sont électriquement neutres. De ce fait, ils contiennent à la fois des cations et des anions, dans des proportions telles que les charges positives des cations compensent exactement les charges négatives des anions. Cette propriété est valable pour les corps purs (solides ou liquides) comme pour les solutions ioniques.
Exemple : le chlorure de calcium (CaCl2) solide est constitué d'ions calcium Ca2+ et d'ions chlorure Cl−. La charge d'un ion calcium vaut +2e (deux charges élémentaires), tandis que celle d'un ion chlorure vaut −e : pour que l'ensemble soit neutre, les proportions des ions sont de deux ions chlorure pour un ion calcium. La formule ionique de ce sel est donc (Ca2+, 2 Cl−), sa formule statistique est CaCl2.
Solides ioniques
modifierLes solides ioniques sont constitués d'un empilement alterné de cations et d'anions reliés par des liaisons dites « ioniques » ; la cohésion de l'ensemble est assurée par les forces électrostatiques. Par exemple, le sel de table (chlorure de sodium) est un empilement d'ions chlorure et d'ions sodium. De nombreux solides ioniques sont très solubles dans l'eau ou d'autres solvants polaires, car les ions y sont facilement solvatés (interaction favorable avec les molécules du solvant), même s'il existe des solides ioniques très peu solubles dans l'eau comme le chlorure d'argent ou le sulfate de baryum. Ces derniers composés sont obtenus comme précipités dans des méthodes analytiques basées sur des titrages.
Solutions ioniques
modifierUn liquide contenant des ions parmi le solvant est appelé « solution ionique ». Dans la solution, les ions se déplacent facilement sous l'effet d'un champ électrique, d'où la forte conductibilité électrique des solutions ioniques. La mesure de la conductivité électrique d'une solution (conductimétrie) permet donc d'estimer sa teneur globale en ions. Une solution ionique est électriquement neutre.
Ainsi, l'eau des océans, qui constituent la plus importante réserve hydrique de la Terre, est riche en ions :
| Concentration approximative des principaux ions dans l'eau de mer normale | ||||||||||
| Ions | Cl− | Na+ | SO42− | Mg2+ | Ca2+ | HCO3− | Br− | CO32− | Sr2+ | F− |
| mg/l | 19 000 | 11 000 | 2 700 | 1 300 | 420 | 110 | 73 | 15 | 8,1 | 1,3 |
La quantité de matière d'une espèce ionique dans un volume de solution est appelé « concentration molaire » de cette espèce d'ions. Si S est la solution et X l'espèce ionique, la concentration molaire [X] est donnée par :
- ou ,
où est le nombre de moles de X dissoutes dans le volume de solution, la masse de X dissoute et la masse molaire de X.
Cependant, dans le langage courant, on utilise davantage la concentration massique, donnée par :
- .
Ionisation de composés moléculaires
modifierDans certains corps moléculaires, certains atomes attirent plus les électrons de liaisons que d'autres. On dit alors que les liaisons entre atomes sont polarisées. Au contact d'un solvant polaire, comme l'eau, les molécules de ces composés, tels l'acide sulfurique, l'ammoniac ou le dioxyde de carbone, se dissocient en ions au cours de la dissolution.
Notation
modifierLes ions sont notés en tenant compte de la différence entre le nombre de protons et le nombre d'électrons. Par exemple, le sodium perd facilement son électron de valence pour prendre la configuration d'un gaz noble. Lorsqu'il a perdu cet électron, il a un proton de plus que d'électrons : l'ion est noté Na+. Le magnésium, qui perd facilement deux électrons, devient l'ion Mg2+, etc.
En astronomie, les atomes ionisés sont notés sous la forme « symbole chimique - numération romaine ». Le chiffre romain « I » désigne l'atome neutre, alors que les suivants désignent l'état d'ionisation. Par exemple, l'hydrogène ionisé est ainsi noté « HII » ou « H II ». L'oxygène neutre est noté O I, alors que l'oxygène doublement ionisé est noté O III. Ces notations sont utilisées pour qualifier les régions d'hydrogène ionisé (régions HII ou H II), qui sont des nébuleuses en émission majoritairement composées d'hydrogène ionisé.
Lorsqu'elles concernent des raies d'émission interdites ou semi-interdites, les notations sont entourées d'un ou deux crochets ([ ]). Ainsi, [Fe II] désigne les raies d'émission interdites de la première ionisation du fer, alors que [Ca III] désigne les raies semi-interdites du calcium doublement ionisé.
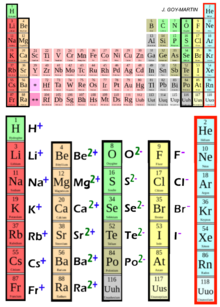
Ions communs
modifier
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Notes et références
modifier- « Ion », dans le Dictionnaire de l'Académie française, sur Centre national de ressources textuelles et lexicales (consulté le 3 septembre 2016).
- Informations lexicographiques et étymologiques d'« ion » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales (consulté le 3 septembre 2016).
- Entrée « ion », sur Dictionnaires de français en ligne, Larousse (consulté le ).
- « Geology Class Notes », sur ruby.colorado.edu (consulté le ).
- « The Amino Acids », sur chemed.chem.purdue.edu (consulté le ).
- (en) Linus Pauling, The nature of the chemical bond and the structure of molecules and crystals : an introduction to modern structural chemistry, Ithaca/New York, Cornell University Press, , 644 p. (ISBN 0-8014-0333-2, lire en ligne).
Voir aussi
modifierBibliographie
modifier- Pierre Bianco, De la pile de Volta à la conquête de l'espace, deux siècles d'électrochimie 1799-1999, publication de l'université de Provence, 1998, 266 p. (ISBN 978-2-85399-432-3). Voir en particulier le chapitre 9 sur l'étude des solutions d'électrolytes, intitulé « Une nouvelle voie pour l'électrochimie… ».
Articles connexes
modifier- Énergie d'ionisation
- Charge électrique
- Atome
- Accélérateur de particules
- Polymère ionique
- Théorie de Debye-Hückel
Liens externes
modifier- Ressources relatives à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :