« Triphénylphosphine » : différence entre les versions
m r2.7.1) (robot Ajoute : pt:Trifenilfosfina |
m (GR) File renamed: File:Préapration sel de phosphonium.GIF → File:Préparation sel de phosphonium.gif Criterion 3 (obvious error) · erreur typographique |
||
| (35 versions intermédiaires par 25 utilisateurs non affichées) | |||
| Ligne 1 : | Ligne 1 : | ||
{{Infobox Chimie |
|||
{{Chimiebox |
|||
| nom = Triphénylphosphine |
| nom = Triphénylphosphine |
||
| image = Triphenylphosphine structure.svg |
| image = Triphenylphosphine structure.svg |
||
| image2 = Triphenylphosphine-3D-vdW.png |
| image2 = Triphenylphosphine-3D-vdW.png |
||
| |
| taille image = 180 |
||
| |
| légende = |
||
<!-- Général --> |
<!-- Général --> |
||
| DCI = |
| DCI = |
||
| Ligne 11 : | Ligne 11 : | ||
| CAS = {{CAS|6|0|3|3|5|0}} |
| CAS = {{CAS|6|0|3|3|5|0}} |
||
| EINECS = {{EINECS|2|1|0|0|3|6|0}} |
| EINECS = {{EINECS|2|1|0|0|3|6|0}} |
||
| RTECS = |
|||
| ATC = {{ATC|}} |
| ATC = {{ATC|}} |
||
| DrugBank = |
|||
| PubChem = |
| PubChem = |
||
| |
| chEBI = |
||
| NrE = |
|||
| FEMA = |
|||
| SMILES = C1=CC=C(C=C1)P(C2=CC=CC=C2)C3=CC=CC=C3 |
| SMILES = C1=CC=C(C=C1)P(C2=CC=CC=C2)C3=CC=CC=C3 |
||
| InChI=1/C18H15P/c1-4-10-16(11-5-1)19(17-12-6-2-7-13-17)18-14-8-3-9-15-18/h1-15H |
| InChI = 1/C18H15P/c1-4-10-16(11-5-1)19(17-12-6-2-7-13-17)18-14-8-3-9-15-18/h1-15H |
||
| InChIKey = |
|||
| StdInChI = |
|||
| StdInChIKey = |
|||
| apparence = cristaux blancs sans odeur<ref name="ICSC">{{ICSC|603-35-0}}</ref>. |
| apparence = cristaux blancs sans odeur<ref name="ICSC">{{ICSC|603-35-0}}</ref>. |
||
<!-- Propriétés chimiques --> |
<!-- Propriétés chimiques --> |
||
| Ligne 22 : | Ligne 29 : | ||
| pKa = |
| pKa = |
||
| momentDipolaire = |
| momentDipolaire = |
||
| susceptibiliteMagnetique = |
|||
| rayonVanderWaals = |
|||
| diametreMoleculaire = |
|||
| indiceIode = |
|||
| indiceAcide = |
|||
| indiceSaponification = |
|||
<!-- Propriétés physiques --> |
<!-- Propriétés physiques --> |
||
| TTransitionVitreuse = |
|||
| fusion = {{tmp|80|°C}}<ref name="ICSC"/> |
| fusion = {{tmp|80|°C}}<ref name="ICSC"/> |
||
| ebullition = {{tmp|377|°C}}<ref name="ICSC"/> |
| ebullition = {{tmp|377|°C}}<ref name="ICSC"/> |
||
| solubilite = dans l'eau : nulle<ref name="ICSC"/> |
| solubilite = dans l'eau : nulle<ref name="ICSC"/> |
||
| miscibilite = |
|||
| masseVolumique = {{Unité/2|1.1|g||cm|-3}} |
| masseVolumique = {{Unité/2|1.1|g||cm|-3}} |
||
| ⚫ | |||
| TAutoInflammation = |
| TAutoInflammation = |
||
| pointEclair = {{tmp|180|°C}} (coupelle ouverte)<ref name="ICSC"/> |
| pointEclair = {{tmp|180|°C}} (coupelle ouverte)<ref name="ICSC"/> |
||
| Ligne 34 : | Ligne 46 : | ||
| pressionVapeur = |
| pressionVapeur = |
||
| viscosite = |
| viscosite = |
||
| pointCritique = |
|||
| pointTriple = |
|||
| conductivitéThermique = |
|||
| conductivitéÉlectrique = |
|||
| vitesseSon = |
|||
<!-- Thermochimie --> |
<!-- Thermochimie --> |
||
| emsGaz = |
| emsGaz = |
||
| Ligne 41 : | Ligne 58 : | ||
| esfLiquide = |
| esfLiquide = |
||
| esfSolide = |
| esfSolide = |
||
| enthFus = |
|||
| ⚫ | |||
| enthVap = |
|||
| capaciteTherm = |
|||
| ⚫ | {{Infobox Chimie/Capacité thermique|facteur=1E3|CpUnite=J·mol<sup>-1</sup>·K<sup>-1</sup>|etat=gaz|masseMol=262.2855|A=-140.077|B=1.8099|C=-1.7088E-3|D=8.3604E-7|E=-1.6512E-10|Tmin=298|Tmax=1500|arrondi=0|graphique=|tailleGraphique=500px|ref=<ref name="Yaws">{{Ouvrage | langue=en | auteur1=Carl L. Yaws | titre=Handbook of Thermodynamic Diagrams | sous-titre=Organic Compounds C8 to C28 | volume=3 | lieu=Huston, Texas | éditeur=Gulf Pub. Co. | année=1996 | pages totales=396 | isbn=0-88415-859-4}}</ref>}} |
||
| PCS = |
|||
| PCI = |
|||
<!-- Propriétés biochimiques --> |
<!-- Propriétés biochimiques --> |
||
| codons = |
| codons = |
||
| Ligne 48 : | Ligne 70 : | ||
<!-- Propriétés électroniques --> |
<!-- Propriétés électroniques --> |
||
| bandeInterdite = |
| bandeInterdite = |
||
| mobiliteElectronique = |
|||
| mobilitEelectronique = |
|||
| mobiliteTrous = |
| mobiliteTrous = |
||
| 1reEnergieIonisation = |
|||
| constanteDielectrique = |
|||
<!-- Cristallographie --> |
<!-- Cristallographie --> |
||
| systemeCristallin = |
|||
| reseauBravais = |
|||
| Pearson = |
|||
| classe = |
| classe = |
||
| |
| Schoenflies = |
||
| |
| Strukturbericht = |
||
| structureType = |
|||
| parametresMaille = |
|||
| volume = |
|||
| macle = |
| macle = |
||
<!-- Propriétés optiques --> |
<!-- Propriétés optiques --> |
||
| Ligne 63 : | Ligne 93 : | ||
| absorption = |
| absorption = |
||
| transparence = |
| transparence = |
||
| ⚫ | |||
| cteVerdet = |
|||
<!-- Précautions --> |
<!-- Précautions --> |
||
| |
| radioactif = |
||
| 67548EEC = |
|||
| 67548EECref = |
|||
| symboles = Xn |
|||
| numeroIndex = |
| numeroIndex = |
||
| classificationCE = |
| classificationCE = |
||
| r = |
| r = R22, R43, R53 |
||
| s = |
| s = S24, S37, S61 |
||
| transportRef = |
|||
| transport = |
|||
| NFPA704ref = |
|||
| NFPA704 = {{NFPA 704|603-35-0}} |
| NFPA704 = {{NFPA 704|603-35-0}} |
||
| SIMDUTref = |
|||
| SIMDUT = |
|||
| SGHref = |
|||
| SGH = |
|||
| CIRC = |
|||
| inhalation = |
| inhalation = |
||
| peau = |
| peau = |
||
| yeux = |
| yeux = |
||
| ingestion = |
| ingestion = |
||
<!-- Écotoxicologie --> |
|||
| DL50 = {{unité/2|700|mg||kg|-1}} (rats, oral) |
| DL50 = {{unité/2|700|mg||kg|-1}} (rats, oral) |
||
{{ |
{{Infobox Chimie/Autre| [[Valeur d'exposition]] | {{unité/2|5|mg||m|-3}} }} |
||
| CL50 = |
| CL50 = |
||
| LogP = |
|||
<!-- Classe thérapeutique --> |
|||
| |
| DJA = |
||
| odorat = |
|||
<!-- Données pharmacocinétiques --> |
<!-- Données pharmacocinétiques --> |
||
| CAM = |
| CAM = |
||
| Ligne 89 : | Ligne 134 : | ||
| excretion = |
| excretion = |
||
<!-- Considérations thérapeutiques --> |
<!-- Considérations thérapeutiques --> |
||
| classeTherapeutique = |
|||
| voieAdministration = |
| voieAdministration = |
||
| grossesse = |
| grossesse = |
||
| Ligne 99 : | Ligne 145 : | ||
| autresNoms = |
| autresNoms = |
||
| risqueDependance = |
| risqueDependance = |
||
<!-- Composés apparentés --> |
|||
| autres = |
|||
| autrescations = |
|||
| autresanions = |
|||
| isomères = |
|||
<!-- Supplément --> |
<!-- Supplément --> |
||
| supplement = |
| supplement = |
||
}}<!-- ----------------------------- Fin de l'infoboite ----------------------------- --> |
}}<!-- ----------------------------- Fin de l'infoboite ----------------------------- --> |
||
La '''triphénylphosphine''' |
La '''triphénylphosphine''' ou le '''triphénylphosphane''' (IUPAC), est un [[composé organophosphoré]] de formule P(C<sub>6</sub>H<sub>5</sub>)<sub>3</sub> - parfois abrégé en [[Phosphore|P]][[phényl|Ph<sub>3</sub>]] ou Ph<sub>3</sub>P. Elle est largement utilisée dans la synthèse de [[Composé organique|composés organiques]] et [[Composé organométallique|organométalliques]]. C'est un composé relativement stable qui existe sous la forme d'un solide cristallin à température ambiante et qui se dissout dans les [[solvant]]s [[polarité (chimie)|non polaires]] comme le [[benzène]]. |
||
==Préparation== |
==Préparation== |
||
La triphénylphosphine peut être préparée en laboratoire par traitement du [[trichlorure de phosphore]] avec le bromure de phénylmagnésium ou le phényllithium. La synthèse industrielle met en jeu la [[réaction de Friedel-Crafts]] entre le trichlorure de phosphore et le [[benzène]]. La triphénylphosphine peut être [[Cristallisation (chimie)|recristallisée]] soit dans l'[[éthanol]] chaud soit dans l'[[isopropanol]] chaud. Cette purification est parfois conseillée pour enlever l'oxyde de triphénylphosphine, de formule OP(C<sub>6</sub>H<sub>5</sub>)<sub>3</sub>, qui s'est formé par oxydation lente par l'air. |
|||
[[Image:Réaction triphénylphosphine sur O2.GIF|center]] |
[[Image:Réaction triphénylphosphine sur O2.GIF|center]] |
||
| Ligne 112 : | Ligne 163 : | ||
P(C<sub>6</sub>H<sub>5</sub>)<sub>3</sub> est largement utilisé en [[Synthèse chimique|synthèse]] organique. La réaction du P(C<sub>6</sub>H<sub>5</sub>)<sub>3</sub> sur les [[halogénoalcane]]s conduit à des sels phosphoriques appelés aussi sels de phosphonium. |
P(C<sub>6</sub>H<sub>5</sub>)<sub>3</sub> est largement utilisé en [[Synthèse chimique|synthèse]] organique. La réaction du P(C<sub>6</sub>H<sub>5</sub>)<sub>3</sub> sur les [[halogénoalcane]]s conduit à des sels phosphoriques appelés aussi sels de phosphonium. |
||
[[Image: |
[[Image:Préparation sel de phosphonium.gif|center]] |
||
Ces sels réagissent avec des [[Base (chimie)|base]]s fortes (type [[organométallique]] |
Ces sels réagissent avec des [[Base (chimie)|base]]s fortes (type [[Composé organométallique|organométalliques]] par exemple les [[organolithien]]s, ions [[amidure]]s -NH<sub>2</sub><sup>−</sup> ou [[hydrure]] H<sup>−</sup>, des bases moins fortes pouvant être utilisées dans certains cas) pour former des [[Ylure de phosphore|ylures de phosphore]], appelés aussi ''phosphoranes''. |
||
[[Image:Préparation ylure de phosphore.GIF|center]] |
[[Image:Préparation ylure de phosphore.GIF|center]] |
||
Ces molécules sont utilisées en particulier dans la [[ |
Ces molécules sont utilisées en particulier dans la [[réaction de Wittig]], où, créées ''in situ'', elles réagissent avec des [[composé carbonylé|composés carbonylés]], [[aldéhyde]]s ou [[cétone]]s, pour former des dérivés éthyléniques, voire des [[alcène]]s. |
||
| ⚫ | |||
<center>'''réaction de Wittig'''</center> |
|||
| ⚫ | |||
<center>'''réaction de Wittig'''</center> |
|||
La réaction de P(C<sub>6</sub>H<sub>5</sub>)<sub>3</sub> sur le [[dichlore]] donne Cl<sub>2</sub>P(C<sub>6</sub>H<sub>5</sub>)<sub>3</sub>, |
La réaction de P(C<sub>6</sub>H<sub>5</sub>)<sub>3</sub> sur le [[dichlore]] donne Cl<sub>2</sub>P(C<sub>6</sub>H<sub>5</sub>)<sub>3</sub>, créé ''in situ'' pour transformer les [[alcool (chimie)|alcools]] en dérivés chlorés, formant par la même occasion HCl et un oxyde de tryphénylphosphine O=P(C<sub>6</sub>H<sub>5</sub>)<sub>3</sub>. |
||
== Réactions avec les composés inorganiques et les organométalliques == |
== Réactions avec les composés inorganiques et les organométalliques == |
||
| Ligne 130 : | Ligne 179 : | ||
La triphénylphosphine est souvent utilisée comme [[ligand (chimie)|ligand]] d'un cation métallique pour former un [[complexe (chimie)|complexe de coordination]]. Elle se lie à la plupart des [[métal de transition|métaux de transition]], en particulier aux métaux du milieu et de la fin du bloc ''d'' comme le [[Palladium (chimie)|palladium]], le [[platine]], le [[ruthénium]], le [[nickel]] et l'[[osmium]]. Exemple : le [[Tetrakis(triphenylphosphine) de palladium(0)]]. Les triphénylamines correspondantes ont une faible affinité pour les [[métal de transition|métaux de transition]]. Cette différence s'explique par la plus petite taille de l'atome d'[[azote]], ce qui entraîne une plus grande gène stérique limitant l'approche du ligand vers le centre métallique. |
La triphénylphosphine est souvent utilisée comme [[ligand (chimie)|ligand]] d'un cation métallique pour former un [[complexe (chimie)|complexe de coordination]]. Elle se lie à la plupart des [[métal de transition|métaux de transition]], en particulier aux métaux du milieu et de la fin du bloc ''d'' comme le [[Palladium (chimie)|palladium]], le [[platine]], le [[ruthénium]], le [[nickel]] et l'[[osmium]]. Exemple : le [[Tetrakis(triphenylphosphine) de palladium(0)]]. Les triphénylamines correspondantes ont une faible affinité pour les [[métal de transition|métaux de transition]]. Cette différence s'explique par la plus petite taille de l'atome d'[[azote]], ce qui entraîne une plus grande gène stérique limitant l'approche du ligand vers le centre métallique. |
||
Les composés de type metal-P(C<sub>6</sub>H<sub>5</sub>)<sub>3</sub> sont caractérisés par [[Résonance magnétique nucléaire|spectroscopie RMN]] du <sup>31</sup>P. |
Les composés de type metal-P(C<sub>6</sub>H<sub>5</sub>)<sub>3</sub> sont caractérisés par [[Résonance magnétique nucléaire|spectroscopie RMN]] du <sup>31</sup>P. Le [[Phosphore|P]][[phényl|Ph<sub>3</sub>]] a un signal entre -5 et -6 ppm. |
||
La triphénylphosphine capte le [[soufre]] à partir de nombreux [[Composé |
La triphénylphosphine capte le [[soufre]] à partir de nombreux [[Composé organosulfuré|composés sulfurés]], y compris du soufre élémentaire. Le produit phosphoré est SP(C<sub>6</sub>H<sub>5</sub>)<sub>3</sub>. Cette réaction peut être utilisée pour analyser les taux de soufre. |
||
==Utilisation en chimie organophosphorique == |
==Utilisation en chimie organophosphorique == |
||
La triphénylphosphine est couramment employée comme précurseur pour d'autres organophosphines. Du [[lithium]] dans du [[THF]] et du sodium (Na) ou potassium (K) dans de l'ammoniaque NH<sub>3</sub> réagissent pour donner (C<sub>6</sub>H<sub>5</sub>)<sub>2</sub>PM (M = Li, Na, K). Un des défauts de ces réactions est de générer autant de phényllithium (ou sodium, ou potassium) C<sub>6</sub>H<sub>5</sub>M, mais ces espèces peuvent être sélectivement converties en [[benzène]] par utilisation attentive d'acide. Le traitement du diphénylphosphure de métal alcalin par un agent d'[[alkylation]] RX donne PRC<sub>6</sub>H<sub>5</sub>)<sub>2</sub>. Cette méthode peut être utilisée pour préparer des [[ligand (chimie)|ligand]]s comme PMe(C<sub>6</sub>H<sub>5</sub>)<sub>2</sub> ( |
La triphénylphosphine est couramment employée comme précurseur pour d'autres organophosphines. Du [[lithium]] dans du [[Tétrahydrofurane|THF]] et du sodium (Na) ou potassium (K) dans de l'ammoniaque NH<sub>3</sub> réagissent pour donner (C<sub>6</sub>H<sub>5</sub>)<sub>2</sub>PM (M = Li, Na, K). Un des défauts de ces réactions est de générer autant de phényllithium (ou sodium, ou potassium) C<sub>6</sub>H<sub>5</sub>M, mais ces espèces peuvent être sélectivement converties en [[benzène]] par utilisation attentive d'acide. Le traitement du diphénylphosphure de métal alcalin par un agent d'[[alkylation]] RX donne PRC<sub>6</sub>H<sub>5</sub>)<sub>2</sub>. Cette méthode peut être utilisée pour préparer des [[ligand (chimie)|ligand]]s comme PMe(C<sub>6</sub>H<sub>5</sub>)<sub>2</sub> (méthyldiphénylphosphine). La réaction avec les dihalogénoalcanes correspondante donne des bis(diphénylphosphino)alcanes. Par exemple, le [[dibromure d'éthylène]] et Ph<sub>2</sub>PM réagissent pour donner (C<sub>6</sub>H<sub>5</sub>)<sub>2</sub>PCH<sub>2</sub>CH<sub>2</sub>P(C<sub>6</sub>H<sub>5</sub>)<sub>2</sub>, appelé [[1,2-bis(diphénylphosphino)éthane]] ou dppe. L'addition d'acide, même faibles comme le [[chlorure d'ammonium]], convertit (C<sub>6</sub>H<sub>5</sub>)<sub>2</sub>PM en (C<sub>6</sub>H<sub>5</sub>)<sub>2</sub>PH, ou diphénylphosphine. |
||
La [[sulfonation]] de P(C<sub>6</sub>H<sub>5</sub>)<sub>3</sub> donne la tris(3-sulfophényl)phosphine, P(C<sub>6</sub>H<sub>4</sub>-3-SO<sub>3</sub><sup> |
La [[sulfonation]] de P(C<sub>6</sub>H<sub>5</sub>)<sub>3</sub> donne la tris(3-sulfophényl)phosphine, P(C<sub>6</sub>H<sub>4</sub>-3-SO<sub>3</sub><sup>−</sup>)<sub>3</sub>. Cette phosphine anionique est habituellement isolée comme sel de trisodium et est connue comme '''[[TPPTS]]'''. Contrairement à P(C<sub>6</sub>H<sub>5</sub>)<sub>3</sub>, TPPTS est soluble dans l'eau, comme ses dérivés métalliques. Les complexes TPPTS de rhodium sont utilisés dans certaines réactions industrielles d'[[hydroformylation]] en raison d'un catalyseur hydrosoluble séparable des composés organiques. |
||
Autres réactions impliquant des triphénylphosphines : |
Autres réactions impliquant des triphénylphosphines : |
||
| Ligne 147 : | Ligne 196 : | ||
* Dans la production du [[catalyseur de Wilkinson]] et du [[complexe de Vaska]] |
* Dans la production du [[catalyseur de Wilkinson]] et du [[complexe de Vaska]] |
||
== |
== Voir aussi == |
||
=== Articles connexes === |
|||
* [[Organophosphoré]] |
|||
=== Liens externes === |
|||
*{{en}} [http://www.ilo.org/public/english/protection/safework/cis/products/icsc/dtasht/_icsc07/icsc0700.htm International Chemical Safety Card 0700] |
*{{en}} [http://www.ilo.org/public/english/protection/safework/cis/products/icsc/dtasht/_icsc07/icsc0700.htm International Chemical Safety Card 0700] |
||
*{{en}} [http://www.jtbaker.com/msds/englishhtml/t6916.htm J.T. Baker MSDS] |
*{{en}} [http://www.jtbaker.com/msds/englishhtml/t6916.htm J.T. Baker MSDS] |
||
| Ligne 156 : | Ligne 209 : | ||
{{Portail|chimie}} |
{{Portail|chimie}} |
||
[[Catégorie: |
[[Catégorie:Triphénylphosphine]] |
||
[[Catégorie:Composé du phosphore]] |
|||
[[Catégorie:Composé organo-phosphoré]] |
|||
[[ar:ثلاثي فينيل الفسفين]] |
|||
[[cs:Trifenylfosfan]] |
|||
[[de:Triphenylphosphan]] |
|||
[[en:Triphenylphosphine]] |
|||
[[es:Trifenilfosfina]] |
|||
[[fa:تریفنیلفسفین]] |
|||
[[fi:Trifenyylifosfiini]] |
|||
[[it:Trifenilfosfina]] |
|||
[[ja:トリフェニルホスフィン]] |
|||
[[nl:Trifenylfosfine]] |
|||
[[pt:Trifenilfosfina]] |
|||
[[ru:Трифенилфосфин]] |
|||
[[zh:三苯基膦]] |
|||
Dernière version du 27 août 2023 à 20:35
| Triphénylphosphine | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Triphenylphosphane | |
| No CAS | ||
| No ECHA | 100.009.124 | |
| No CE | 210-036-0 | |
| SMILES | ||
| InChI | ||
| Apparence | cristaux blancs sans odeur[1]. | |
| Propriétés chimiques | ||
| Formule | C18H15P [Isomères] |
|
| Masse molaire[2] | 262,285 5 ± 0,015 5 g/mol C 82,43 %, H 5,76 %, P 11,81 %, |
|
| Propriétés physiques | ||
| T° fusion | 80 °C[1] | |
| T° ébullition | 377 °C[1] | |
| Solubilité | dans l'eau : nulle[1] | |
| Masse volumique | 1,1 g·cm-3 | |
| Point d’éclair | 180 °C (coupelle ouverte)[1] | |
| Thermochimie | ||
| Cp | ||
| Précautions | ||
| NFPA 704 | ||
| Directive 67/548/EEC | ||
| Écotoxicologie | ||
| DL50 | 700 mg·kg-1 (rats, oral) | |
| Valeur d'exposition | 5 mg·m-3 | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
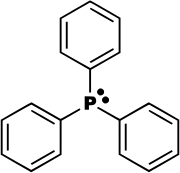
La triphénylphosphine ou le triphénylphosphane (IUPAC), est un composé organophosphoré de formule P(C6H5)3 - parfois abrégé en PPh3 ou Ph3P. Elle est largement utilisée dans la synthèse de composés organiques et organométalliques. C'est un composé relativement stable qui existe sous la forme d'un solide cristallin à température ambiante et qui se dissout dans les solvants non polaires comme le benzène.
Préparation
[modifier | modifier le code]La triphénylphosphine peut être préparée en laboratoire par traitement du trichlorure de phosphore avec le bromure de phénylmagnésium ou le phényllithium. La synthèse industrielle met en jeu la réaction de Friedel-Crafts entre le trichlorure de phosphore et le benzène. La triphénylphosphine peut être recristallisée soit dans l'éthanol chaud soit dans l'isopropanol chaud. Cette purification est parfois conseillée pour enlever l'oxyde de triphénylphosphine, de formule OP(C6H5)3, qui s'est formé par oxydation lente par l'air.
Principales réactions organiques
[modifier | modifier le code]P(C6H5)3 est largement utilisé en synthèse organique. La réaction du P(C6H5)3 sur les halogénoalcanes conduit à des sels phosphoriques appelés aussi sels de phosphonium.

Ces sels réagissent avec des bases fortes (type organométalliques par exemple les organolithiens, ions amidures -NH2− ou hydrure H−, des bases moins fortes pouvant être utilisées dans certains cas) pour former des ylures de phosphore, appelés aussi phosphoranes.
Ces molécules sont utilisées en particulier dans la réaction de Wittig, où, créées in situ, elles réagissent avec des composés carbonylés, aldéhydes ou cétones, pour former des dérivés éthyléniques, voire des alcènes.

La réaction de P(C6H5)3 sur le dichlore donne Cl2P(C6H5)3, créé in situ pour transformer les alcools en dérivés chlorés, formant par la même occasion HCl et un oxyde de tryphénylphosphine O=P(C6H5)3.
Réactions avec les composés inorganiques et les organométalliques
[modifier | modifier le code]La triphénylphosphine est souvent utilisée comme ligand d'un cation métallique pour former un complexe de coordination. Elle se lie à la plupart des métaux de transition, en particulier aux métaux du milieu et de la fin du bloc d comme le palladium, le platine, le ruthénium, le nickel et l'osmium. Exemple : le Tetrakis(triphenylphosphine) de palladium(0). Les triphénylamines correspondantes ont une faible affinité pour les métaux de transition. Cette différence s'explique par la plus petite taille de l'atome d'azote, ce qui entraîne une plus grande gène stérique limitant l'approche du ligand vers le centre métallique.
Les composés de type metal-P(C6H5)3 sont caractérisés par spectroscopie RMN du 31P. Le PPh3 a un signal entre -5 et -6 ppm.
La triphénylphosphine capte le soufre à partir de nombreux composés sulfurés, y compris du soufre élémentaire. Le produit phosphoré est SP(C6H5)3. Cette réaction peut être utilisée pour analyser les taux de soufre.
Utilisation en chimie organophosphorique
[modifier | modifier le code]La triphénylphosphine est couramment employée comme précurseur pour d'autres organophosphines. Du lithium dans du THF et du sodium (Na) ou potassium (K) dans de l'ammoniaque NH3 réagissent pour donner (C6H5)2PM (M = Li, Na, K). Un des défauts de ces réactions est de générer autant de phényllithium (ou sodium, ou potassium) C6H5M, mais ces espèces peuvent être sélectivement converties en benzène par utilisation attentive d'acide. Le traitement du diphénylphosphure de métal alcalin par un agent d'alkylation RX donne PRC6H5)2. Cette méthode peut être utilisée pour préparer des ligands comme PMe(C6H5)2 (méthyldiphénylphosphine). La réaction avec les dihalogénoalcanes correspondante donne des bis(diphénylphosphino)alcanes. Par exemple, le dibromure d'éthylène et Ph2PM réagissent pour donner (C6H5)2PCH2CH2P(C6H5)2, appelé 1,2-bis(diphénylphosphino)éthane ou dppe. L'addition d'acide, même faibles comme le chlorure d'ammonium, convertit (C6H5)2PM en (C6H5)2PH, ou diphénylphosphine.
La sulfonation de P(C6H5)3 donne la tris(3-sulfophényl)phosphine, P(C6H4-3-SO3−)3. Cette phosphine anionique est habituellement isolée comme sel de trisodium et est connue comme TPPTS. Contrairement à P(C6H5)3, TPPTS est soluble dans l'eau, comme ses dérivés métalliques. Les complexes TPPTS de rhodium sont utilisés dans certaines réactions industrielles d'hydroformylation en raison d'un catalyseur hydrosoluble séparable des composés organiques.
Autres réactions impliquant des triphénylphosphines :
- réaction d'Appel
- réaction de Mitsunobu
- réaction de Wittig
- réaction de Staudinger
- comme ligand dans la réaction de Heck
- Dans la production du catalyseur de Wilkinson et du complexe de Vaska
Voir aussi
[modifier | modifier le code]Articles connexes
[modifier | modifier le code]Liens externes
[modifier | modifier le code]Notes et références
[modifier | modifier le code]- TRIPHENYLPHOSPHINE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 3, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 0-88415-859-4)





