« Stilbène » : différence entre les versions
m correction d'un lien vers une page d'homonymie |
|||
| (80 versions intermédiaires par 43 utilisateurs non affichées) | |||
| Ligne 1 : | Ligne 1 : | ||
{{Infobox Chimie |
|||
{{Chimiebox général| |
|||
nom = |
| nom = |
||
image = Stilbene.png |
| image = Stilbene.png |
||
| taille image = 230 |
|||
tailleimage = 240 | |
|||
| image2 = Stilbene cis structure.svg |
|||
commentaire = représentation topologique du (E)-stilbène | |
|||
| taille image2 = 230 |
|||
formule = [[Carbone|C]]<sub>14</sub>[[Hydrogène|H]]<sub>12</sub> | |
|||
| légende = Représentation topologique du (''E'')- et du (''Z'')-stilbène. |
|||
nom scientifique = trans-1,2-diphényléthylène | |
|||
<!-- Général --> |
|||
CAS = 103-30-0 | |
|||
| DCI = |
|||
| nomIUPAC = ''trans''-1,2-diphényléthylène |
|||
apparence = [[État solide|solide]] blanc cassé |
|||
| synonymes = |
|||
* (''E'')-stilbène |
|||
* (''Z'')-stilbène |
|||
| CAS = {{CAS|1|0|3|3|0|0}} (''E'') <br /> {{CAS|6|4|5|4|9|8}} (''Z'') |
|||
| EINECS = {{EINECS|}} |
|||
| RTECS = |
|||
| ATC = {{ATC|}} |
|||
| DrugBank = |
|||
| PubChem = |
|||
| chEBI = |
|||
| NrE = |
|||
| FEMA = |
|||
| SMILES = <br />C(=C\c1ccccc1)\c2ccccc2 (Z)<br />C(=C/c1ccccc1)\c2ccccc2 (E) |
|||
| InChI = <div> |
|||
* 1/C14H12/c1-3-7-13(8-4-1)11-12-14-9-5-2-6-10-14/h1-12H/b12-11- (Z) |
|||
* 1/C14H12/c1-3-7-13(8-4-1)11-12-14-9-5-2-6-10-14/h1-12H/b12-11+ (E) |
|||
</div> |
|||
| InChIKey = |
|||
| StdInChI = |
|||
| StdInChIKey = |
|||
| apparence = [[État solide|solide]] blanc cassé |
|||
<!-- Propriétés chimiques --> |
|||
| formule = |C=14|H=12 |
|||
| masseMol = |
|||
| pKa = |
|||
| momentDipolaire = |
|||
| susceptibiliteMagnetique = <math>\chi_M</math> {{unité/2|120|e=-6|cm|3|mol|-1}}<ref>{{article |
|||
| langue = en |
|||
| auteurs = Hyp J. Dauben, {{Jr.}}, James D. Wilson et John L. Laity |
|||
| titre = Diamagnetic Susceptibility Exaltation in Hydrocarbons |
|||
| périodique = [[Journal of the American Chemical Society|J. Am. Chem. Soc.]] |
|||
| volume = 91 |
|||
| numéro = 8 |
|||
| jour = 9 |
|||
| mois = avril |
|||
| année = 1968 |
|||
| pages = 1991-1998 }}</ref> |
|||
| diametreMoleculaire = |
|||
| indiceIode = |
|||
| indiceAcide = |
|||
| indiceSaponification = |
|||
<!-- Propriétés physiques --> |
|||
| TTransitionVitreuse = |
|||
| fusion = {{tmp|122|125|°C}} |
|||
| ebullition = {{tmp|305|307|°C}} |
|||
| solubilite = Insoluble |
|||
| miscibilite = |
|||
| masseVolumique = |
|||
| TAutoInflammation = |
|||
| pointEclair = |
|||
| limitesExplosivite = |
|||
| pressionVapeur = |
|||
| viscosite = |
|||
| pointCritique = |
|||
| pointTriple = |
|||
| conductivitéThermique = |
|||
| conductivitéÉlectrique = |
|||
| vitesseSon = |
|||
<!-- Thermochimie --> |
|||
| emsGaz = |
|||
| emsLiquide = |
|||
| emsSolide = |
|||
| esfGaz = |
|||
| esfLiquide = |
|||
| esfSolide = |
|||
| enthFus = |
|||
| enthVap = |
|||
| capaciteTherm = {{Miniboîte|{{Infobox Chimie/Capacité thermique|boiteDeroulante=0|facteur=1E3|CpUnite=J·mol{{exp|-1}}·K{{exp|-1}}|etat=gaz|masseMol=180.2451|A=-96.782|B=1.2486|C=-1.0880E-3|D=5.0166E-7|E=-9.5052E-11|Tmin=298|Tmax=1500|arrondi=0|graphique=|tailleGraphique=500px|ref= (''cis'')<ref name="Yaws">{{Ouvrage | langue=en | auteur1=Carl L. Yaws | titre=Handbook of Thermodynamic Diagrams | sous-titre=Organic Compounds C8 to C28 | volume=3 | lieu=Huston, Texas | éditeur=Gulf Pub. Co. | année=1996 | pages totales=396 | isbn=0-88415-859-4}}</ref>}} |
|||
{{Infobox Chimie/Capacité thermique|boiteDeroulante=0|facteur=1E3|CpUnite=J·mol{{exp|-1}}·K{{exp|-1}}|etat=gaz|masseMol=180.2451|A=-68.882|B=1.1174|C=-8.3787E-4|D=3.0198E-7|E=-4.2209E-11|Tmin=298|Tmax=1500|arrondi=0|graphique=|tailleGraphique=500px|ref= (''trans'')<ref name="Yaws"/>}}}} |
|||
| PCS = |
|||
| PCI = |
|||
<!-- Propriétés biochimiques --> |
|||
| codons = |
|||
| pHisoelectrique = |
|||
| acideAmineEss = |
|||
<!-- Propriétés électroniques --> |
|||
| bandeInterdite = |
|||
| mobiliteElectronique = |
|||
| mobiliteTrous = |
|||
| 1reEnergieIonisation = |
|||
| constanteDielectrique = |
|||
<!-- Cristallographie --> |
|||
| systemeCristallin = |
|||
| reseauBravais = |
|||
| Pearson = |
|||
| classe = |
|||
| Schoenflies = |
|||
| Strukturbericht = |
|||
| structureType = |
|||
| parametresMaille = |
|||
| volume = |
|||
| macle = |
|||
<!-- Propriétés optiques --> |
|||
| refraction = |
|||
| birefringence = |
|||
| dispersion = |
|||
| polychroisme = |
|||
| fluorescence = |
|||
| absorption = |
|||
| transparence = |
|||
| pvrRotatoire = |
|||
| cteVerdet = |
|||
<!-- Précautions --> |
|||
| radioactif = |
|||
| 67548EEC = |
|||
| 67548EECref = |
|||
| symboles = |
|||
| numeroIndex = |
|||
| classificationCE = |
|||
| r = R22, R37, R38, R62 |
|||
| s = S22, S26, S36, S37, S45 |
|||
| transportRef = |
|||
| transport = <!--{{ADR|Kemler=|ONU=|Classe=|CodeClassification=|Etiquette=|Etiquette2=|Etiquette3=|Emballage=}}--> |
|||
| NFPA704ref = |
|||
| NFPA704 = {{NFPA 704|Flammability=1|Health=1|Reactivity=0|Other=}} |
|||
| SIMDUTref = |
|||
| SIMDUT = |
|||
| SGHref = |
|||
| SGH = |
|||
| CIRC = |
|||
| inhalation = irritant |
|||
| peau = irritant |
|||
| yeux = |
|||
| ingestion = nocif |
|||
<!-- Écotoxicologie --> |
|||
| DL50 = |
|||
| CL50 = |
|||
| LogP = |
|||
| DJA = |
|||
| odorat = |
|||
<!-- Données pharmacocinétiques --> |
|||
| CAM = |
|||
| biodisponibilite = |
|||
| liaisonProteique = |
|||
| metabolisme = |
|||
| demiVieDistrib = |
|||
| demiVieElim = |
|||
| stockage = |
|||
| excretion = |
|||
<!-- Considérations thérapeutiques --> |
|||
| classeTherapeutique = |
|||
| voieAdministration = |
|||
| grossesse = |
|||
| conduiteAuto = |
|||
| precautions = |
|||
| antidote = |
|||
<!-- Caractère psychotrope --> |
|||
| categoriePsycho = |
|||
| modeConsommation = |
|||
| autresNoms = |
|||
| risqueDependance = |
|||
<!-- Composés apparentés --> |
|||
| autres = |
|||
| autrescations = |
|||
| autresanions = |
|||
| isomères = |
|||
<!-- Supplément --> |
|||
| supplement = |
|||
}} |
}} |
||
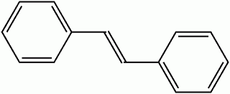
Le '''stilbène''', dont il existe deux formes [''trans''-1,2-diphényléthylène ((''E'')-stilbène) et ''cis''-1,2-diphényléthylène ((''Z'')-stilbène)], est un [[hydrocarbure aromatique]] de formule [[Carbone|C]]{{ind|14}}[[Hydrogène|H]]{{ind|12}}. |
|||
<!-- Ci-dessous, les infos du benzène. à changer avant de décommenter |
|||
{{Chimiebox physique}} |
|||
{{Chimiebox physique masse moléculaire|78,11 [[Unité de masse atomique|u]]}} |
|||
{{Chimiebox physique température fusion|278,7 [[kelvin|K]] (5,5 [[Degré Celsius|°C]])}} |
|||
{{Chimiebox physique température vaporisation|353,3 [[kelvin|K]] (80,1 [[Degré Celsius|°C]])}} |
|||
{{chimiebox physique solubilité|1,770 [[gramme|g]]/[[Litre|L]] dans l'eau}} |
|||
{{chimiebox physique densité|0,88 (liquide)}} |
|||
{{chimiebox physique propriété spéciale|Densité du gaz|2,7 (air<nowiki>=</nowiki>1)}} |
|||
{{chimiebox physique température d'auto-inflammation|555°C}} |
|||
{{chimiebox physique point d'éclair|-11°C}} |
|||
{{chimiebox physique limites d'explosivité|1,4-8%}} |
|||
{{chimiebox physique pression de vapeur saturante|10 [[Pascal (unité)|kPa]] à 20°C<br/>12,6 kPa à 25°C}} |
|||
{{chimiebox physique viscosité|0,65 [[poise|cP]] à 20°C}} |
|||
{{chimiebox physique propriété spéciale|[[Tension superficielle]]|28,9.10<sup>-3</sup> N/m à 20°C}} |
|||
{{Chimiebox physique fin}} |
|||
{{Chimiebox thermo}} |
|||
{{chimiebox thermo entropie| |
|||
gaz = 269 J/mol·K | |
|||
solide = | |
|||
liquide = 173,4 J/mol·K | }} |
|||
{{chimiebox thermo enthalpie| gaz = 83,0 [[joule (unité)|kJ]]/[[Mole (unité)|mol]] | |
|||
solide = | |
|||
liquide = 49,1 [[joule (unité)|kJ]]/[[Mole (unité)|mol]] }} |
|||
{{chimiebox thermo capacité calorifique|136,0 J/mol·K}} |
|||
{{chimiebox thermo fin}}--> |
|||
{{chimiebox précautions |
|||
| classification = |
|||
| r = R22, R37, R38, R62 |
|||
| s = S22, S26A, S36, S37, S45 |
|||
| inhalation= irritant |
|||
| peau= irritant |
|||
| yeux= |
|||
| ingestion = inoffensif |
|||
| autre= }} |
|||
{{Chimiebox fin}} |
|||
Le même terme de « stilbène » désigne aussi la ''classe'' des dérivés [[hydroxy]]-, [[alkoxy]]- du stilbène simple, ainsi que leurs formes [[Hétéroside|hétérosidiques]] ou [[polymère]]s. |
|||
Ce sont des [[polyphénol]]s naturels présents dans de nombreuses familles de plantes (comme le [[resvératrol|''trans''-resvératrol]] du raisin). |
|||
Le '''stilbène''', ou '''trans-1,2-diphényléthylène''', est [[hydrocarbure aromatique]], de formule [[Carbone|C]]{{ind|14}}[[Hydrogène|H]]{{ind|12}}. Son nom vient du [[Grec]] ''stilbos'' qui signifie ''brillant''. Le stilbène existe sous deux formes [[mésomère]]s (E) et (Z), cette dernière étant la moins stable pour cause de gênes stériques et présentant un point de fusion entre 5°C et 6°C, tandis que la forme (E) a un point de fusion avoisinant les 125°C. |
|||
<br />Rassemblés avec les bibenzyls et les phénanthrènes, ils forment la famille des [[stilbénoïde]]s. |
|||
Le stilbène est une des substances illicitement utilisées par certains [[élevage|éleveurs]] sous forme libre ou dérivée (sels ou [[ester]]s). |
|||
[[de:Stilben]] |
|||
<br />Cette substance est interdite en France, y compris dans les territoires d'outre-mer<ref>[http://www.legifrance.gouv.fr/jopdf/common/jo_pdf.jsp?numJO=0&dateJO=20081211&numTexte=32&pageDebut=18849&pageFin=18864 Arrêté du 4 décembre 2008] relatif à la mise en œuvre de la conditionnalité au titre de 2008, [[Légifrance]]</ref>. |
|||
[[en:Stilbene]] |
|||
[[ja:スチルベン]] |
|||
Son nom vient du [[Grec ancien|Grec]] ''stilbos'' qui signifie ''brillant'', lié à l'aspect de ses cristaux, ressemblant à de la [[stilbite]] |
|||
[[pl:Stylben]] |
|||
<ref>{{Ouvrage |
|||
[[zh:茋]] |
|||
| langue=en |
|||
| auteurs=H. W. Derby & Company |
|||
| titre=Outlines of Chemistry for the Use of Students |
|||
| éditeur= |
|||
| année=1851 |
|||
| pages totales=712 |
|||
| passage=353 |
|||
}}</ref>. |
|||
== Description == |
|||
Le stilbène est un liquide huileux, jaune, qui existe sous deux formes [[Diastéréoisomérie|diastéréoisomères]] (''E'') et (''Z''), cette dernière étant la moins stable pour cause de [[Encombrement stérique|gênes stériques]] et présentant un [[point de fusion]] compris entre {{tmp|5|°C}} et {{tmp|6|°C}}, tandis que la forme (''E'') possède un point de fusion avoisinant {{tmp|125|°C}}. |
|||
Le ''cis''-stilbène peut subir une [[photoisomérisation]] (qui dans ce cas déplace la configuration de la [[liaison double]]), il se forme l’isomère ''trans''-stilbène, doté d'une [[fluorescence]] bleue. |
|||
[[Fichier:Stilbene photoisomerization.svg|vignette|centre|400px|Photoisomérisation (conversion) du stilbène. En fonction de la [[Photoexcitation|longueur d’onde d'excitation]], le produit de la réaction est l’isomère ''cis'' ou ''trans''.]] |
|||
== [[Toxicologie]], [[écotoxicologie]] == |
|||
C'est un [[perturbateur endocrinien]]. |
|||
== Recommandation == |
|||
* Ne pas manger et ne pas boire pendant l'utilisation. |
|||
* Conserver dans un récipient hermétique. |
|||
== Les stilbènes == |
|||
Cette famille de [[polyphénol]]s naturels est constituée de dérivés hydroxy-, méthoxy- du stilbène simple, ainsi que leurs formes hétérosidiques ou polymères. On les trouve chez de nombreuses plantes. |
|||
En réponse à des attaques de pathogènes extérieurs (insectes, micro-organismes), les plantes se protègent en produisant des composés toxiques contribuant au blocage local des attaquants. Certaines de ces substances, comme des [[alcaloïde]]s (nicotine), des [[terpénoïde]]s (pyréthrines) ou des [[isoflavone]]s (roténoïdes) ont été très étudiées. D’autres comme les stilbènes sont beaucoup moins connues. |
|||
Les stilbènes permettraient pourtant de mieux comprendre pourquoi par exemple divers cépages de vignes sont plus ou moins résistants aux attaques fongiques. Pezet {{et al.}} (2004)<ref>{{article |
|||
| langue = en |
|||
| auteurs = R. Pezet, K. Gindro, O. Viret, J.-L. Spring |
|||
| titre = Glycosylation and oxidative dimerization of resveratrol are respectively associated to sensitivity and resistance of grapevine cultivars to downy mildew |
|||
| périodique = Physiological and Molecular Plant Pathology |
|||
| volume = 65 |
|||
| année = 2004 |
|||
}} |
|||
</ref> ont montré que les feuilles de vigne inoculées par le mildiou (''[[Plasmopara viticola]]'') vont au bout de quelques heures produire localement des stilbènes. Elles synthétisent tout d’abord du [[resvératrol]] en grande quantité mais suivant les variétés le destin de ce composé va varier. Pour les cultivars sensibles au mildiou, le resvératrol est glycosylé en un composé non toxique, le [[picéide]], alors que pour les cultivars résistants au mildiou, le resvératrol est oxydé en un composé toxique, la [[viniférine]]. |
|||
Le resvératrol s’est révélé être une molécule bénéfique, non seulement pour la plante mais aussi pour l’homme. Ces nombreuses propriétés thérapeutiques ont suscité et suscitent toujours un grand nombre d’études<ref> |
|||
{{Ouvrage |
|||
| langue=en |
|||
| auteurs=Bharat B. Aggarwal (Éd.), Shishir Shishodia (Éd.) |
|||
| titre=Resveratrol in Health and Disease |
|||
| éditeur=[[CRC Press]] |
|||
| année=2005 |
|||
| pages totales=712 |
|||
| isbn= |
|||
}} |
|||
</ref>. |
|||
Des observations semblables ont été faites sur les conifères. Un pin subissant une attaque fongique va se défendre en produisant des stilbènes comme le [[pinosylvine]]<ref>{{article |
|||
| langue =en |
|||
| auteurs = M. S. Kemp, R. S. Burden |
|||
| titre = Phytoalexins and stress metabolites in the sapwood of trees |
|||
| périodique = Phytochemistry |
|||
| volume = 25 |
|||
| numéro = 6 |
|||
| année = 1986 |
|||
}}</ref>, un épicéa produira plusieurs [[dimère]]s de [[glucoside]]s de stilbènes<ref>{{article |
|||
| langue = en |
|||
| auteurs = Sheng-Hong Li, Xue-Mei Niu, Stefan Zahn, Jonathan Gershenzon, Jennie Weston, Bernd Schneider |
|||
| titre = Diastereomeric stilbene glucoside dimers from the bark of Norway spruce (Picea abies) |
|||
| périodique = Phytochemistry |
|||
| volume = 69 |
|||
| année = 2008 |
|||
| pages = 772-782 |
|||
}} |
|||
</ref>. |
|||
{| class="wikitable" style="text-align:center; " border="3" |
|||
| colspan="9" align="center" | '''Stilbènes'''<br /> Gluc=O-β-D-glucosyl |
|||
|- |
|||
! scope=col |Nom |
|||
! scope=col | Origine |
|||
! scope=col | R{{Ind|3}} |
|||
! scope=col | R{{Ind|4}} |
|||
! scope=col | R{{Ind|5}} |
|||
! scope=col | R'{{Ind|3}} |
|||
! scope=col| R'{{Ind|4}} |
|||
! scope=col | R'{{Ind|5}} |
|||
! scope=col | Squelette carboné |
|||
|- |
|||
! scope=row | [[Pinosylvine]] |
|||
| Pinus strobus || H || H || H || OH || H || OH |
|||
| rowspan="9" | [[Image:Stilbenes2.png]] |
|||
|- |
|||
! scope=row | [[Piceatannol]] |
|||
| Picea abies || OH || H || OH || OH || OH || H |
|||
|- |
|||
! scope=row | [[resvératrol|''trans''-resvératrol]] |
|||
| Raisin, cacahuète, <br /> Polygonum, Picea <br />|| OH || H || OH || H || OH || H |
|||
|- |
|||
! scope=row | [[trans-ptérostilbène|''trans''-ptérostilbène]] |
|||
| Ptérocarpus, raisin || {{Formule chimique|O||CH|3}} || H || {{Formule chimique|O||CH|3}} || H || OH || H |
|||
|- |
|||
!scope=row|[[Rhapontigénine]] |
|||
|Vitis||OH||H||OH||H||{{Formule chimique|O||CH|3}}||OH |
|||
|- |
|||
! scope=row|[[Isorhapontigénine]] |
|||
|Vitis||OH||H||OH||{{Formule chimique|O||CH|3}}||OH||H |
|||
|- |
|||
! scope=row | [[Rhapontine]], Ponticine |
|||
| Rhubarbe, Picea abies || Gluc || H || OH || OH || {{Formule chimique|O||CH|3}} || H |
|||
|- |
|||
! scope=row | [[trans-picéide|''trans''-picéide]] |
|||
| Raisin, rhubarbe,<br />Picea, Polygonum || Gluc || H || OH || H || OH || H |
|||
|- |
|||
!scope=row | [[Astringine]] |
|||
| Picea abies || Gluc || H || OH || OH || OH || H |
|||
|} |
|||
Les stilbènes [[monomère]]s [[Polymérisation|polymérisent]] en de nombreux [[Oligomère|oligo]]stilbènes naturels. |
|||
La plupart d'entre eux sont des polymères du resvératrol : (–)-ε-viniférine. |
|||
== Utilisations == |
|||
* Les stilbènes sont utilisés dans l'industrie des colorants. Ils fournissent des groupes [[chromophore]]s jaunes ou orangés<ref>{{Lien web |url=http://colorants.aliments.free.fr/Production.html |titre=Les colorants alimentaires |consulté le=7 février 2010}}</ref>. |
|||
* Les stilbènes servent de milieu d'émission pour les lasers à colorant<ref> |
|||
{{Ouvrage |
|||
| langue=fr |
|||
| auteurs=B. Cagnac, J.-P. Faroux |
|||
| titre=Lasers |
|||
| éditeur=EDP Sciences, CNRS éditions |
|||
| année=2002 |
|||
| isbn= |
|||
}} |
|||
</ref>. |
|||
* Les stilbènes sont utilisés en cancérologie<ref> https://www.ncbi.nlm.nih.gov/pubmed?term=(Stilbene%5BTitle%5D)%20AND%20cancer%5BMeSH%20Terms%5D</ref>. |
|||
== Article connexe == |
|||
* [[Stilbénoïde]] |
|||
== Références == |
|||
{{Références}} |
|||
{{Portail|chimie|pharmacie}} |
|||
[[Catégorie:Diphényléthène]] |
|||
[[Catégorie:Colorant organique]] |
|||
[[Catégorie:Marqueur fluorescent]] |
|||
[[Catégorie:Milieu amplificateur pour laser]] |
|||
Dernière version du 7 juillet 2023 à 16:25
| Stilbène | ||
| ||
 | ||
| Représentation topologique du (E)- et du (Z)-stilbène. | ||
| Identification | ||
|---|---|---|
| Nom UICPA | trans-1,2-diphényléthylène | |
| Synonymes |
|
|
| No CAS | (E) (Z) |
|
| No ECHA | 100.008.748 | |
| SMILES | ||
| InChI | ||
| Apparence | solide blanc cassé | |
| Propriétés chimiques | ||
| Formule | C14H12 [Isomères] |
|
| Masse molaire[2] | 180,245 1 ± 0,012 g/mol C 93,29 %, H 6,71 %, |
|
| Susceptibilité magnétique | 120×10-6 cm3·mol-1[1] | |
| Propriétés physiques | ||
| T° fusion | 122 à 125 °C | |
| T° ébullition | 305 à 307 °C | |
| Solubilité | Insoluble | |
| Thermochimie | ||
| Cp | ||
| Précautions | ||
| NFPA 704 | ||
| Directive 67/548/EEC | ||
| Inhalation | irritant | |
| Peau | irritant | |
| Ingestion | nocif | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Le stilbène, dont il existe deux formes [trans-1,2-diphényléthylène ((E)-stilbène) et cis-1,2-diphényléthylène ((Z)-stilbène)], est un hydrocarbure aromatique de formule C14H12.
Le même terme de « stilbène » désigne aussi la classe des dérivés hydroxy-, alkoxy- du stilbène simple, ainsi que leurs formes hétérosidiques ou polymères.
Ce sont des polyphénols naturels présents dans de nombreuses familles de plantes (comme le trans-resvératrol du raisin).
Rassemblés avec les bibenzyls et les phénanthrènes, ils forment la famille des stilbénoïdes.
Le stilbène est une des substances illicitement utilisées par certains éleveurs sous forme libre ou dérivée (sels ou esters).
Cette substance est interdite en France, y compris dans les territoires d'outre-mer[4].
Son nom vient du Grec stilbos qui signifie brillant, lié à l'aspect de ses cristaux, ressemblant à de la stilbite [5].
Description
[modifier | modifier le code]Le stilbène est un liquide huileux, jaune, qui existe sous deux formes diastéréoisomères (E) et (Z), cette dernière étant la moins stable pour cause de gênes stériques et présentant un point de fusion compris entre 5 °C et 6 °C, tandis que la forme (E) possède un point de fusion avoisinant 125 °C.
Le cis-stilbène peut subir une photoisomérisation (qui dans ce cas déplace la configuration de la liaison double), il se forme l’isomère trans-stilbène, doté d'une fluorescence bleue.

C'est un perturbateur endocrinien.
Recommandation
[modifier | modifier le code]- Ne pas manger et ne pas boire pendant l'utilisation.
- Conserver dans un récipient hermétique.
Les stilbènes
[modifier | modifier le code]Cette famille de polyphénols naturels est constituée de dérivés hydroxy-, méthoxy- du stilbène simple, ainsi que leurs formes hétérosidiques ou polymères. On les trouve chez de nombreuses plantes.
En réponse à des attaques de pathogènes extérieurs (insectes, micro-organismes), les plantes se protègent en produisant des composés toxiques contribuant au blocage local des attaquants. Certaines de ces substances, comme des alcaloïdes (nicotine), des terpénoïdes (pyréthrines) ou des isoflavones (roténoïdes) ont été très étudiées. D’autres comme les stilbènes sont beaucoup moins connues.
Les stilbènes permettraient pourtant de mieux comprendre pourquoi par exemple divers cépages de vignes sont plus ou moins résistants aux attaques fongiques. Pezet et al. (2004)[6] ont montré que les feuilles de vigne inoculées par le mildiou (Plasmopara viticola) vont au bout de quelques heures produire localement des stilbènes. Elles synthétisent tout d’abord du resvératrol en grande quantité mais suivant les variétés le destin de ce composé va varier. Pour les cultivars sensibles au mildiou, le resvératrol est glycosylé en un composé non toxique, le picéide, alors que pour les cultivars résistants au mildiou, le resvératrol est oxydé en un composé toxique, la viniférine. Le resvératrol s’est révélé être une molécule bénéfique, non seulement pour la plante mais aussi pour l’homme. Ces nombreuses propriétés thérapeutiques ont suscité et suscitent toujours un grand nombre d’études[7].
Des observations semblables ont été faites sur les conifères. Un pin subissant une attaque fongique va se défendre en produisant des stilbènes comme le pinosylvine[8], un épicéa produira plusieurs dimères de glucosides de stilbènes[9].
| Stilbènes Gluc=O-β-D-glucosyl | ||||||||
| Nom | Origine | R3 | R4 | R5 | R'3 | R'4 | R'5 | Squelette carboné |
|---|---|---|---|---|---|---|---|---|
| Pinosylvine | Pinus strobus | H | H | H | OH | H | OH | 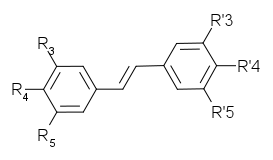
|
| Piceatannol | Picea abies | OH | H | OH | OH | OH | H | |
| trans-resvératrol | Raisin, cacahuète, Polygonum, Picea |
OH | H | OH | H | OH | H | |
| trans-ptérostilbène | Ptérocarpus, raisin | OCH3 | H | OCH3 | H | OH | H | |
| Rhapontigénine | Vitis | OH | H | OH | H | OCH3 | OH | |
| Isorhapontigénine | Vitis | OH | H | OH | OCH3 | OH | H | |
| Rhapontine, Ponticine | Rhubarbe, Picea abies | Gluc | H | OH | OH | OCH3 | H | |
| trans-picéide | Raisin, rhubarbe, Picea, Polygonum |
Gluc | H | OH | H | OH | H | |
| Astringine | Picea abies | Gluc | H | OH | OH | OH | H | |
Les stilbènes monomères polymérisent en de nombreux oligostilbènes naturels. La plupart d'entre eux sont des polymères du resvératrol : (–)-ε-viniférine.
Utilisations
[modifier | modifier le code]- Les stilbènes sont utilisés dans l'industrie des colorants. Ils fournissent des groupes chromophores jaunes ou orangés[10].
- Les stilbènes servent de milieu d'émission pour les lasers à colorant[11].
- Les stilbènes sont utilisés en cancérologie[12].
Article connexe
[modifier | modifier le code]Références
[modifier | modifier le code]- (en) Hyp J. Dauben, Jr., James D. Wilson et John L. Laity, « Diamagnetic Susceptibility Exaltation in Hydrocarbons », J. Am. Chem. Soc., vol. 91, no 8, , p. 1991-1998
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 3, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 0-88415-859-4)
- Arrêté du 4 décembre 2008 relatif à la mise en œuvre de la conditionnalité au titre de 2008, Légifrance
- (en) H. W. Derby & Company, Outlines of Chemistry for the Use of Students, , 712 p., p. 353
- (en) R. Pezet, K. Gindro, O. Viret, J.-L. Spring, « Glycosylation and oxidative dimerization of resveratrol are respectively associated to sensitivity and resistance of grapevine cultivars to downy mildew », Physiological and Molecular Plant Pathology, vol. 65,
- (en) Bharat B. Aggarwal (Éd.), Shishir Shishodia (Éd.), Resveratrol in Health and Disease, CRC Press, , 712 p.
- (en) M. S. Kemp, R. S. Burden, « Phytoalexins and stress metabolites in the sapwood of trees », Phytochemistry, vol. 25, no 6,
- (en) Sheng-Hong Li, Xue-Mei Niu, Stefan Zahn, Jonathan Gershenzon, Jennie Weston, Bernd Schneider, « Diastereomeric stilbene glucoside dimers from the bark of Norway spruce (Picea abies) », Phytochemistry, vol. 69, , p. 772-782
- « Les colorants alimentaires » (consulté le )
- B. Cagnac, J.-P. Faroux, Lasers, EDP Sciences, CNRS éditions,
- https://www.ncbi.nlm.nih.gov/pubmed?term=(Stilbene%5BTitle%5D)%20AND%20cancer%5BMeSH%20Terms%5D






