« Évaporation » : différence entre les versions
→Description : illustration |
m Style, mef réfs, wikif, typo, sources manquantes |
||
| Ligne 3 : | Ligne 3 : | ||
L{{'}}'''évaporation<ref>{{CNRTL|Évaporation}}, consulté le 30 juin 2015.</ref>''' est un passage progressif de l'[[état liquide]] à l'[[état gazeux]]. Ce phénomène est donc une [[vaporisation]] progressive qui a pour effet d'absorber de l'[[énergie thermique]] et donc de réduire la température de l’environnement. |
L{{'}}'''évaporation<ref>{{CNRTL|Évaporation}}, consulté le 30 juin 2015.</ref>''' est un passage progressif de l'[[état liquide]] à l'[[état gazeux]]. Ce phénomène est donc une [[vaporisation]] progressive qui a pour effet d'absorber de l'[[énergie thermique]] et donc de réduire la température de l’environnement. |
||
==Historique de la connaissance== |
== Historique de la connaissance == |
||
La connaissance de l'existence de l'évaporation est ancienne. Le mot est emprunté au [[latin impérial]] |
La connaissance de l'existence de l'évaporation est ancienne. Le mot est emprunté au [[latin impérial]] ''evaporatio, -ionis''<ref>{{CNRTL|évaporation}}.</ref>. |
||
{{...}} |
{{...}} |
||
Certains auteurs rapprochent l'évaporation du phénomène inverse appelé condensation, dont on sait depuis avant 1830 qu'il est impliqué dans la formation des nuages<ref>https://gallica.bnf.fr/ark:/12148/bpt6k559251/f117.image</ref>. |
Certains auteurs rapprochent l'évaporation du phénomène inverse appelé [[condensation]], dont on sait depuis avant 1830 qu'il est impliqué dans la formation des nuages<ref>https://gallica.bnf.fr/ark:/12148/bpt6k559251/f117.image</ref>. |
||
Au {{ |
Au {{s-|XIX}}, [[John Dalton]] étudie le volume de vapeur d'eau qui est nécessaire pour saturer l'air. Il remarque que ce volume dépend beaucoup de la température. |
||
{{...}} |
{{...}} |
||
== Description == |
== Description == |
||
[[File:Vapor pressure.svg|vignette|Processus microscopique d'évaporation et de condensation en surface de liquide]] |
[[File:Vapor pressure.svg|vignette|Processus microscopique d'évaporation et de condensation en surface de liquide.]] |
||
{{Section à sourcer|date=juin 2020}} |
|||
L'évaporation d'un liquide se produit principalement lorsqu'une |
L'évaporation d'un liquide se produit principalement lorsqu'une de ses surfaces est ''libre'', c'est-à-dire qu'elle n'est pas enfermée par un autre liquide ou par un solide. |
||
Sous l'action de la chaleur {{Incise|c'est-à-dire l'énergie thermique sous forme d'agitation moléculaire ou rayonnements}} contenue dans le liquide, quelques molécules de surfaces sont propulsées {{Incise|énergie cinétique}} dans l'air. L'interface entre le liquide et le gaz s'appelle la [[Couche de Knudsen]]. |
|||
Sous l'action de la chaleur {{Incise|c'est-à-dire l'[[énergie thermique]] sous forme d'agitation moléculaire ou rayonnements}} contenue dans le liquide, quelques molécules de surfaces sont propulsées dans l'air, gagnant ainsi en [[énergie cinétique]]. L'interface entre le liquide et le gaz est appelée [[couche de Knudsen]]. La quantité de liquide projetée dans l'air dépend de la température de liquide, de la quantité de liquide déjà présente dans l'air, ou saturation, et de la [[pression de vapeur saturante]]. |
|||
Les mêmes effets sur un solide conduisent à sa [[Sublimation (physique)|sublimation]]. |
Les mêmes effets sur un solide conduisent à sa [[Sublimation (physique)|sublimation]]. |
||
===Description physique=== |
=== Description physique === |
||
Dans un volume libre au-dessus d'un liquide formé de molécules d'une [[espèce chimique]] donnée, certaines molécules de cette espèce se trouvent sous forme gazeuse. À l'[[équilibre thermodynamique]], la pression gazeuse obtenue définit la [[pression de vapeur saturante]] qui dépend de la [[température]]. Si le liquide est constitué d'un mélange d'espèces, celles-ci se retrouvent dans le gaz avec des [[Pression partielle|pressions partielles]] égales à la pression de vapeur saturante de chacune d'entre elles. |
Dans un volume libre au-dessus d'un liquide formé de molécules d'une [[espèce chimique]] donnée, certaines molécules de cette espèce se trouvent sous forme gazeuse. À l'[[équilibre thermodynamique]], la pression gazeuse obtenue définit la [[pression de vapeur saturante]] qui dépend de la [[température]]. Si le liquide est constitué d'un mélange d'espèces, celles-ci se retrouvent dans le gaz avec des [[Pression partielle|pressions partielles]] égales à la pression de vapeur saturante de chacune d'entre elles. |
||
| Ligne 39 : | Ligne 39 : | ||
== Caractéristiques == |
== Caractéristiques == |
||
{{Section à sourcer|date=juin 2020}} |
|||
=== Différences entre évaporation et ébullition === |
=== Différences entre évaporation et ébullition === |
||
| Ligne 47 : | Ligne 49 : | ||
=== Facteurs favorisant l'évaporation === |
=== Facteurs favorisant l'évaporation === |
||
[[Fichier:Verdunstungshöhe.svg|vignette|Évaporation par mois et par matériau en Allemagne, années |
[[Fichier:Verdunstungshöhe.svg|vignette|Évaporation par mois et par matériau en Allemagne, années 1893-2014.]] |
||
[[Fichier:Gewässerverdunstung.svg|vignette|Évaporation mensuelle |
[[Fichier:Gewässerverdunstung.svg|vignette|Évaporation mensuelle selon la hauteur de la mer, en Allemagne, années 1893–2014.]] |
||
[[Fichier:Verdunstung freier Wasserflächen.svg|vignette|Évaporation annuelle en Allemagne, années 1893–2014.]] |
[[Fichier:Verdunstung freier Wasserflächen.svg|vignette|Évaporation annuelle en Allemagne, années 1893–2014.]] |
||
[[Fichier:Potentiellen Verdunstungshöhe.svg|vignette|Évaporation annuelle |
[[Fichier:Potentiellen Verdunstungshöhe.svg|vignette|Évaporation annuelle ''potentielles'' (vers Turc / Ivanov) en Allemagne, années 1893–2014. ]] |
||
Les facteurs favorisant l'évaporation sont : |
Les facteurs favorisant l'évaporation sont : |
||
| Ligne 56 : | Ligne 58 : | ||
* le type de matériau imprégné (le nylon sèche plus vite que la laine ou le coton), |
* le type de matériau imprégné (le nylon sèche plus vite que la laine ou le coton), |
||
* le vent, qui favorise l'évaporation, |
* le vent, qui favorise l'évaporation, |
||
*l'humidité de l'air : l'évaporation sera plus importante dans un air sec que dans un air humide, |
* l'humidité de l'air : l'évaporation sera plus importante dans un air sec que dans un air humide, |
||
* un apport de [[transfert thermique|chaleur]] tel que le soleil favorise le séchage par évaporation, car celle-ci, est [[endothermique]], c'est-à-dire qu'elle absorbe de la chaleur de l'environnement. |
* un apport de [[transfert thermique|chaleur]] tel que le soleil favorise le séchage par évaporation, car celle-ci, est [[endothermique]], c'est-à-dire qu'elle absorbe de la chaleur de l'environnement. |
||
== |
== Évaporation de l'eau == |
||
L'évaporation est un phénomène indispensable dans le cycle de la vie sur Terre. Le [[cycle de l'eau]] (eau liquide devient nuage, puis retombe en pluie ou neige) |
L'évaporation est un phénomène indispensable dans le cycle de la vie sur Terre. Le [[cycle de l'eau]] (l'eau liquide devient nuage, puis retombe en pluie ou neige) requiert cette étape. |
||
L'évaporation demande en général une importante quantité d'[[énergie]] (la [[chaleur latente]] de vaporisation), ce qui permet par exemple la [[thermorégulation|régulation de température]] chez les [[homéotherme]]s par [[transpiration animale|transpiration]] et évaporation de la [[sueur]], ou encore le rafraîchissement d'une cruche en terre, ou de l'air par nébulisation ([[aérosol]] d'[[eau]]). |
L'évaporation demande en général une importante quantité d'[[énergie]] (la [[chaleur latente]] de vaporisation), ce qui permet par exemple la [[thermorégulation|régulation de température]] chez les [[homéotherme]]s par [[transpiration animale|transpiration]] et évaporation de la [[sueur]], ou encore le rafraîchissement d'une cruche en terre, ou de l'air par nébulisation ([[aérosol]] d'[[eau]]). |
||
| Ligne 66 : | Ligne 68 : | ||
Par exemple l'évaporation de {{unité|1|[[gramme]]}} d'eau à {{tmp|25|°C}} nécessite environ {{unité|2400|[[joule]]s}} ({{unité|580|[[calorie]]s}}), soit la même énergie que pour élever la température de {{unité|580|[[gramme]]s}} d'eau de {{tmp|1|°C}}. |
Par exemple l'évaporation de {{unité|1|[[gramme]]}} d'eau à {{tmp|25|°C}} nécessite environ {{unité|2400|[[joule]]s}} ({{unité|580|[[calorie]]s}}), soit la même énergie que pour élever la température de {{unité|580|[[gramme]]s}} d'eau de {{tmp|1|°C}}. |
||
== |
== Évaporation par les plantes == |
||
{{Article détaillé|Transpiration végétale}} |
{{Article détaillé|Transpiration végétale}} |
||
Chez les plantes, l'évaporation est essentielle pour le transport des nutriments. En effet, grâce aux liaisons hydrogène, les molécules d'eau fonctionnent comme une |
Chez les plantes, l'évaporation est essentielle pour le transport des nutriments. En effet, grâce aux [[Liaison hydrogène|liaisons hydrogène]], les [[Molécule d'eau|molécules d'eau]] fonctionnent comme une chaîne, se « tirant » les unes les autres. Ainsi, l'eau qui est puisée dans les racines de la plante est transportée jusqu'aux feuilles grâce à la propriété de la [[Cohésion (physique)|cohésion]] de l'eau et des cellules conductrices végétales. |
||
== Notes et références == |
== Notes et références == |
||
Version du 4 juin 2020 à 20:46

L'évaporation[1] est un passage progressif de l'état liquide à l'état gazeux. Ce phénomène est donc une vaporisation progressive qui a pour effet d'absorber de l'énergie thermique et donc de réduire la température de l’environnement.
Historique de la connaissance
La connaissance de l'existence de l'évaporation est ancienne. Le mot est emprunté au latin impérial evaporatio, -ionis[2].
Certains auteurs rapprochent l'évaporation du phénomène inverse appelé condensation, dont on sait depuis avant 1830 qu'il est impliqué dans la formation des nuages[3].
Au XIXe siècle, John Dalton étudie le volume de vapeur d'eau qui est nécessaire pour saturer l'air. Il remarque que ce volume dépend beaucoup de la température.
Description

L'évaporation d'un liquide se produit principalement lorsqu'une de ses surfaces est libre, c'est-à-dire qu'elle n'est pas enfermée par un autre liquide ou par un solide.
Sous l'action de la chaleur — c'est-à-dire l'énergie thermique sous forme d'agitation moléculaire ou rayonnements — contenue dans le liquide, quelques molécules de surfaces sont propulsées dans l'air, gagnant ainsi en énergie cinétique. L'interface entre le liquide et le gaz est appelée couche de Knudsen. La quantité de liquide projetée dans l'air dépend de la température de liquide, de la quantité de liquide déjà présente dans l'air, ou saturation, et de la pression de vapeur saturante.
Les mêmes effets sur un solide conduisent à sa sublimation.
Description physique
Dans un volume libre au-dessus d'un liquide formé de molécules d'une espèce chimique donnée, certaines molécules de cette espèce se trouvent sous forme gazeuse. À l'équilibre thermodynamique, la pression gazeuse obtenue définit la pression de vapeur saturante qui dépend de la température. Si le liquide est constitué d'un mélange d'espèces, celles-ci se retrouvent dans le gaz avec des pressions partielles égales à la pression de vapeur saturante de chacune d'entre elles.
L'état d'équilibre d'un système à une seule espèce est décrit par la formule de Rankine :
où , sont les pressions aux températures et , l'énergie de vaporisation (ou enthalpie de vaporisation) et la constante universelle des gaz parfaits.
Lorsque la pression partielle de la vapeur dans le gaz est inférieure à la pression de vapeur saturante, une partie des molécules passe de la phase liquide à la phase gazeuse : c'est l'évaporation, qui demande de fournir la chaleur latente correspondante. Pour un système fermé, ceci a pour effet de refroidir le liquide. Ce phénomène est décrit par la relation de Hertz-Knudsen donnant le débit massique par unité d'aire :
où est la pression de vapeur saturante, la masse molaire et un coefficient d'efficacité du phénomène dépendant de l'espèce et de la température. L'équilibre, correspondant à un débit nul, est atteint lorsque .
Dans le cas d'un mélange formé de plusieurs espèces liées faiblement, par exemple une espèce dans un solvant, les liaisons diminuent la pression de vapeur d'équilibre. On parle alors d'une diminution d'activité liée au solvant.
Caractéristiques
Différences entre évaporation et ébullition
L'évaporation est un phénomène surfacique où les molécules à la surface passent progressivement d'un état à l'autre alors que l'ébullition est un phénomène volumique (les bulles naissent dans le liquide).
L'évaporation est un changement d'état lent alors que l'ébullition est un changement d'état rapide.
Facteurs favorisant l'évaporation
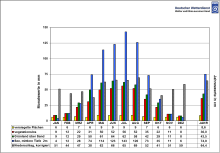


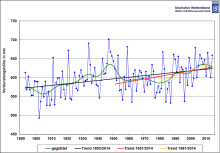
Les facteurs favorisant l'évaporation sont :
- la surface exposée (étendre le linge favorise l'évaporation),
- le type de matériau imprégné (le nylon sèche plus vite que la laine ou le coton),
- le vent, qui favorise l'évaporation,
- l'humidité de l'air : l'évaporation sera plus importante dans un air sec que dans un air humide,
- un apport de chaleur tel que le soleil favorise le séchage par évaporation, car celle-ci, est endothermique, c'est-à-dire qu'elle absorbe de la chaleur de l'environnement.
Évaporation de l'eau
L'évaporation est un phénomène indispensable dans le cycle de la vie sur Terre. Le cycle de l'eau (l'eau liquide devient nuage, puis retombe en pluie ou neige) requiert cette étape.
L'évaporation demande en général une importante quantité d'énergie (la chaleur latente de vaporisation), ce qui permet par exemple la régulation de température chez les homéothermes par transpiration et évaporation de la sueur, ou encore le rafraîchissement d'une cruche en terre, ou de l'air par nébulisation (aérosol d'eau).
Par exemple l'évaporation de 1 gramme d'eau à 25 °C nécessite environ 2 400 joules (580 calories), soit la même énergie que pour élever la température de 580 grammes d'eau de 1 °C.
Évaporation par les plantes
Chez les plantes, l'évaporation est essentielle pour le transport des nutriments. En effet, grâce aux liaisons hydrogène, les molécules d'eau fonctionnent comme une chaîne, se « tirant » les unes les autres. Ainsi, l'eau qui est puisée dans les racines de la plante est transportée jusqu'aux feuilles grâce à la propriété de la cohésion de l'eau et des cellules conductrices végétales.
Notes et références
- Informations lexicographiques et étymologiques de « Évaporation » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales, consulté le 30 juin 2015.
- Informations lexicographiques et étymologiques de « évaporation » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales.
- https://gallica.bnf.fr/ark:/12148/bpt6k559251/f117.image














