Chlorate de potassium
| Chlorate de potassium | ||
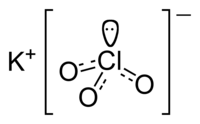
| ||
 | ||
| Bécher rempli de cristaux de chlorate de potassium. | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Chlorate de potassium | |
| No CAS | ||
| No ECHA | 100.021.173 | |
| No CE | 223-289-7 | |
| SMILES | ||
| InChI | ||
| Apparence | cristaux incolores ou poudre blanche[1]. | |
| Propriétés chimiques | ||
| Formule | KClO3 | |
| Masse molaire[2] | 122,55 ± 0,003 g/mol Cl 28,93 %, K 31,9 %, O 39,17 %, |
|
| Propriétés physiques | ||
| T° fusion | 368 °C[1] | |
| T° ébullition | Se décompose au-dessous du point d'ébullition à 400 °C[1] | |
| Solubilité | dans l'eau : 73 g·l-1[1] | |
| Masse volumique | 2,3 g·cm-3[1] | |
| Cristallographie | ||
| Symbole de Pearson | [3] | |
| Classe cristalline ou groupe d’espace | P21/m (n°11) [3] | |
| Strukturbericht | G06 [3] | |
| Précautions | ||
| SGH[5] | ||
| H271, H302, H332 et H411 |
||
| SIMDUT[6] | ||
 C, |
||
| Transport | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Le chlorate de potassium est un composé chimique de formule KClO3. Lorsqu'il est pur, c'est une substance blanche cristalline. C'est le chlorate le plus commun dans l'industrie. Il est notamment utilisé :
- Comme agent oxydant
- Comme désinfectant
- Dans les explosifs et les feux d'artifice
Synthèse
La synthèse du chlorate de potassium peut être réalisée par électrolyse d'une solution de chlorure de sodium et précipitation du chlorate de sodium produit, avec du chlorure de potassium. Pour mener cette électrolyse particulière, au lieu de séparer la cathode (en acier) et l'anode (en titane activé) par une membrane comme cela a lieu dans le procédé chlore-alcali, on doit les juxtaposer : ainsi le chlore intermédiaire dissocié par électrolyse réagit avec de la soude caustique et forme de l'hypochlorite de sodium:
À haute température, l'hypochlorite de sodium se dissocie en chlorures et chlorates :
Mais on peut obtenir du chlorate de potassium par voie directe, par électrolyse d'une solution de chlorure de potassium ; le mécanisme réactionnel est le suivant :
À la cathode:
À l'anode:
Autrefois, on produisait le chlorate de potassium par barbotage de chlore dans une solution de soude caustique. Il se formait d'abord du chlorure de potassium et de l'hypochlorite de potassium à proportions égales. La chaleur produite par le caractère exothermique de cette réaction suffisait à dissocier l'hypochlorite en deux parties de chlorures et une partie de chlorate. On retrouve donc au fond les mêmes réactions que précédemment, avec des réactifs plus coûteux (chlore gazeux et soude caustique), mais en se passant d'électricité. Le bilan chimique s'écrit :
On voit cependant que le chlorate n'a fixé qu'un sixième du chlore investi.
Propriétés

Le chlorate de potassium est soluble dans l'eau chaude uniquement : contrairement au chlorate de sodium, il est peu hygroscopique. Par évaporation ménagée d'une solution de chlorate de potassium, on obtient un agrégat de cristaux blancs étincelants ; en revanche, si l'on fait précipiter avec un sel de potassium cette même solution, on obtient une poudre fine, d'un blanc brillant : c'est un oxydant, qui par chauffage au -delà du point de fusion se dissocie en perchlorate de potassium et chlorure de potassium[7]:
Utilisations
En laboratoire, on se sert de chlorate de potassium pour la synthèse de l'oxygène. Il est également utilisé dans les feux d'artifices et les pétards, mais surtout pour la fabrication des allumettes.
Pour les feux d'artifice, on le remplace autant que possible par du perchlorate de potassium, moins dangereux à manipuler. Toutefois le chlorate de potassium est parfois recherché pour obtenir des colorations spectaculaires dans les manifestations pyrotechniques[8]. On s'en est aussi naturellement servi pour la production d'explosifs. La chloratite contient par ex. à peu près 90 % de chlorate de potassium, 10 % d'hydrocarbures et un additif à base de sciure de bois ; mais cet explosif sensible au frottement a été largement remplacé par des oxydants moins dangereux à manier et au moins aussi efficaces que le perchlorate de potassium, en particulier pour préparer des explosifs nettement plus stables. Si l'on recherche un oxydant moins dangereux, par ex. pour l'amorce à poudre noire d'un feu d'artifice, ou les bombes pyrotechniques, on se rabat aujourd'hui plutôt sur le traditionnel nitrate de potassium.
L'utilisation des bombes algériennes, ces pétards constitués d'un mélange de chlorate de potassium, de phosphore rouge et de gomme arabique séchés, roulés en boule et serrés dans un papier à bonbons, n'est pas sans danger. Ce mélange de chlorate de potassium est appelé couramment mélange d'Armstrong et sa manipulation directe entraîne presque toujours des blessures, à cause de sa vulnérabilité au moindre choc, frottement ou décharge électrostatique.
Cette substance hautement explosive est aussi utilisée pour l'amorçage des allumettes de sûreté.
D'une manière générale, on ne doit manipuler le chlorate de potassium pur qu'avec de grandes précautions, car la moindre impureté, on seulement de phosphore, mais même de soufre ou de limaille métallique, est susceptible de le rendre explosif.
Le chlorate de potassium entrait dans la composition de l'eau forte, une préparation des plaques à graver composée à 88 % d'eau, 10 % d'acide chlorhydrique fumant et 2 % de chlorate.
On attribuait naguère une vertu antiseptique au chlorate de potassium, qui entrait dans la composition des bains de bouche, mais cette thèse est désormais controversée, voire révoquée en doute. La dose thérapeutique maximale, c'est-à-dire non-toxique, est de 1 g pour un sujet adulte[9] : au-delà, il altère le sang et détruit les tissus nerveux. La dose létale est de 5 à 15 g[10]. On doute aujourd’hui de sa possible action antiseptique : compte tenu de sa toxicité, il vaut mieux éviter de s'en servir en pharmacopée.
En revanche, la désignation Kalium chloratum, que l'on retrouve entre autres dans certaines préparations homéopathiques, en crème ou granules, est la forme latine du chlorure de potassium, et n'a aucun rapport avec le chlorate toxique.
Histoire
Le chlorate de potassium a servi à des expériences de chimie élémentaire.

Références
- CHLORATE DE POTASSIUM, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « The KClO3 (G06) Structure », sur http://cst-www.nrl.navy.mil/ (consulté le )
- Entrée du numéro CAS « 3811-04-9 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 27 novembre 2008 (JavaScript nécessaire)
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Chlorate de potassium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Modèle:Holleman-Wiberg
- Takeo Shimizu: Fireworks — The Art, Science and Technique, Pyrotechnica Publications, Midland Texas USA, 4th Edition, S. 53 ff., S. 92 ff. ISBN 0-929388-05-4
- Alexander P. Hardt, Pyrotechnics, Post Falls Idaho USA, Pyrotechnica Publications, (ISBN 0-929388-06-2), p. 74 et suiv.
- (de) oui, Hunnius pharmazeutisches Wörterbuch, Berlin, de Gruyter, (réimpr. 11) (ISBN 978-3-11-030990-4), « Kaliumchlorat »













