Cryolite
| Cryolite[1] Catégorie III : halogénures[2] | |||
 Cryolite d’Ivigtut (Groenland) | |||
| Général | |||
|---|---|---|---|
| Nom IUPAC | hexafluoroaluminate de trisodium | ||
| Numéro CAS | |||
| Classe de Strunz | 3.CB.15
|
||
| Classe de Dana | 11.06.01.01
|
||
| Formule chimique | Na3AlF6 | ||
| Identification | |||
| Masse formulaire[3] | 209,9412656 ± 0 uma Al 12,85 %, F 54,3 %, Na 32,85 %, |
||
| Couleur | incolore, blanche, grise, brun rougeâtre à brun-noir |
||
| Système cristallin | monoclinique | ||
| Réseau de Bravais | primitif P | ||
| Classe cristalline et groupe d'espace | prismatique ; P21/n |
||
| Clivage | pas de clivage, séparations selon {110} et {001} | ||
| Cassure | irrégulière | ||
| Habitus | massifs, grenus, grossiers, groupes des cristaux à orientations parallèles | ||
| Faciès | prismatique, pseudocubique, pseudoquadratique, cuboïde ; faces striées | ||
| Échelle de Mohs | 2,5 - 3 | ||
| Trait | blanc | ||
| Éclat | vitreux | ||
| Propriétés optiques | |||
| Indice de réfraction | α=1,3385-1,339 β=1,3389-1,339 γ=1,3396-1,34 |
||
| Biréfringence | Δ=0,0010-0,0011 ; biaxe positif | ||
| Fluorescence ultraviolet | oui avec thermoluminescence | ||
| Transparence | transparent à translucide | ||
| Propriétés chimiques | |||
| Densité | 2,95 | ||
| Température de fusion | 1011 °C | ||
| Solubilité | soluble dans H2SO4 concentré chaud (dégage du HF, fluorure d'hydrogène) ; 0,4 g à 20 °C |
||
| Propriétés physiques | |||
| Magnétisme | aucun | ||
| Radioactivité | aucune | ||
| Précautions | |||
| Directive 67/548/EEC | |||
| Transport | |||
| SIMDUT[4] | |||
 D2B, |
|||
| SGH[5] | |||
| H302, H332, H372 et H411 |
|||
| Unités du SI & CNTP, sauf indication contraire. | |||
| modifier |
|||
La cryolite est une espèce minérale composée de fluorure double de sodium et d'aluminium, de formule Na3AlF6, également noté 3NaF,AlF3. Les rares cristaux peuvent atteindre 3 cm[6].
La cryolite est principalement utilisée pour la production d'aluminium et dans l'industrie des céramiques. Elle a été découverte sur la côte ouest du Groenland. C'est un minéral rare ; aussi, pour faire face aux besoins de l'industrie, la cryolite est produite artificiellement.
Historique de la description et appellations
[modifier | modifier le code]Inventeur et étymologie
[modifier | modifier le code]À la fin du XVIIIe siècle, un cargo de la Compagnie royale du commerce groenlandais ramène du Groenland des échantillons de divers minerais à Copenhague. Les premiers échantillons de cryolite ont été étudiés par Heinrich Christian Friedrich Schumacher en 1795 (professeur de médecine, botaniste et minéralogiste à l'Académie royale de chirurgie) puis par le brésilien José Bonifácio de Andrada e Silva[7], mais c'est la description du danois Peter Christian Abildgaard qui fait référence en 1799[8]. De Andrada rapporta que la cryolite avait un aspect transparent et brillant et qu'elle avait la propriété de fondre sous l'action d'une flamme, comme de la glace. Le terme « cryolite » signifie « pierre gelée » en grec (κρύος « froid », λίθος « pierre »). Les habitants du Groenland l'appelaient orsukksiksæt.
L'analyse chimique de la cryolite a été faite de manière indépendante par Martin Heinrich Klaproth à Berlin et Louis-Nicolas Vauquelin à Paris[9].
Topotype
[modifier | modifier le code]- Gîte de cryolite d'Ivigtut, Ivittuut, dans le sud-est du Groenland Ouest, Groenland.
- Les échantillons types sont conservés à l'Université de Copenhague, au Danemark.
Synonymie
[modifier | modifier le code]- alumine fluatée alkaline (René-Just Haüy, 1801)[10]
- cryolithe
Caractéristiques physico-chimiques
[modifier | modifier le code]Critères de détermination
[modifier | modifier le code]La cryolite est un minéral transparent à translucide, d'éclat vitreux et de couleur incolore, blanche, grise, parfois d'un brun rougeâtre à brun-noir. Soumise à un rayonnement ultraviolet, elle est fluorescente et thermoluminescente. Son trait est blanc et sa fracture irrégulière. Son habitus est massif, elle forme des groupes de cristaux à orientations parallèles. Son faciès est prismatique, pseudocubique, pseudoquadratique ou cuboïde ; il présente des faces striées.
Il s'agit d'un minéral peu dur : sa dureté, de 2,5 à 3 sur l'échelle de Mohs[11], situe la cryolite entre le gypse et la calcite. Sa densité est faible et a une valeur de 2,95[11].
Dans les applications industrielles, elle se présente le plus souvent sous forme de poudre blanche.
La cryolite est soluble dans l'acide sulfurique concentré chaud, dégageant du HF, (fluorure d'hydrogène) sous forme de gaz[12] et des sulfates de sodium et d'aluminium. Elle fond à 1 011 °C[13].
Cristallochimie
[modifier | modifier le code]Selon la classification de Strunz, la cryolite fait partie de la classe 3.CB.15 : classe des halogénures (III), plus précisément des halogénures complexes (3.C) contenant des néso-aluminofluorures (3.CB).
| Minéral | Formule | Groupe ponctuel | Groupe d'espace |
|---|---|---|---|
| Cryolite | Na3AlF6 | 2/m | P21/n |
| Elpasolite | K2NaAlF6 | m3m | Fm3m |
| Simmonsite | Na2LiAlF6 | 2/m | P21/n |
Selon la classification de Dana, la cryolite se trouve dans la classe des halogénures complexes et aluminofluorides (classe 11) de formules chimiques diverses (11.06) et plus précisément dans le groupe de la cryolite (11.06.01), qui ne contient que la cryolite et la simmonsite.
Cristallographie
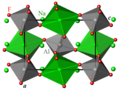
[modifier | modifier le code]À température ambiante, la cryolite cristallise dans le système cristallin monoclinique, de groupe d'espace P21/n (Z = 2 unités formulaires par maille conventionnelle)[1].
- Paramètres de maille : = 5,402 Å, = 5,596 Å, = 7,756 Å, β = 90,28° ; V = 234,5 Å3
- Masse volumique calculée = 2,97 g/cm3
Les cations Al3+ sont en coordination octaédrique légèrement déformée d'anions F−.
Les cations Na+ occupent deux sites non-équivalents, Na1 et Na2 :
- Na1 est en coordination octaédrique légèrement déformée de F− ;
- Na2 a pour voisins 8 anions F−.
Les octaèdres AlF6 et Na1F6 sont reliés dans les trois directions de l'espace par leurs sommets. La structure de la cryolite est dérivée de la structure pérovskite ABX3, avec un site A occupé par Na2 et un site B partagé de façon alternée entre Na1 et Al. La différence de taille entre les octaèdres AlF6 et Na1F6 (longueurs de liaison moyennes Al-F = 1,808 Å et Na-F = 2,257 Å) conduit à une rotation des octaèdres par rapport à la structure pérovskite idéale.
À 565 °C, la cryolite subit une transition de phase structurelle et devient cubique[14], de groupe d'espace Fm3m (Z = 4) avec = 8,023 Å (V = 516,5 Å3, masse volumique calculée : 2,7 g/cm3 à 800 °C)[15]. Les sites de fluor deviennent désordonnés et sont occupés à 25 % autour des axes quaternaires de rotation, indiquant des fluctuations spatiales et temporelles des atomes. Ces fluctuations d'origine thermique permettent de compenser localement les problèmes créés par la différence de taille entre les octaèdres AlF6 et Na1F6. Les longueurs de liaison moyennes sont Na1-F = 2,343 Å, Na2-F = 2,323 Å et Al-F = 1,808 Å à 800 °C.
-
Structure de la cryolite à température ambiante, projetée sur le plan (a, c). Gris : Al, vert : Na, rouge : F.
-
Structure de la cryolite à température ambiante, projetée sur le plan (a, b). Gris : Al, vert : Na, rouge : F.
-
Structure de la cryolite à 800 °C, projetée sur le plan (a, b). Gris : Al, vert : Na, rouge : F.
Gîtes et gisements
[modifier | modifier le code]Gîtologie et minéraux associés
[modifier | modifier le code]La cryolite est un minéral qui apparaît dans un stade avancé de la décomposition de certaines pegmatites granitiques, car du gisement topotype. Après avoir exploré le Groenland, l'allemand Karl Ludwig Giesecke, employé par la Compagnie royale du commerce groenlandais, montra en 1820 que la cryolite n'était que peu présente. Le gisement se situait dans la baie de Arsuk, près de la ville appelée Ivittuut. La mine qui exploitait ce gisement a fermé en 1987.
Elle se trouve dans les granites alcalins stannifères, mais aussi dans les rhyolites à topaze, riches en fluor, et en amas dans les veines de carbonatites dans les gneiss à biotite fénitisé.

La cryolite peut être trouvée associée à plusieurs minéraux :
- sidérite, topaze pyrrhotite, fluorite et autres fluorures : pachnolite, thomsénolite, cryolithionite, chiolite ; ces quatre fluorures provenant généralement de l'altération de la cryolite (pour Ivittuut) ;
- sodalite, villiaumite, eudialyte, lovozerite, natrolite, chabazite, aegirine (Mont Saint-Hilaire, Québec).
Gisements producteurs de spécimens remarquables
[modifier | modifier le code]- Canada
- Carrière Poudrette, mont Saint-Hilaire, Rouville Co., Montérégie, Québec[1]
- Groenland
- Gîte de cryolite d'Ivigtut, Ivittuut, dans le sud-est du Groenland Ouest : topotype
- Namibie
- Kalkfeld, District de Damaraland, région de Kunene[16]
- Tchéquie
- Huber stock, Jáchymov (St Joachimsthal), région de Karlovy Vary, Bohème[17]
- Brésil
- Gisement de Pitinga, Madeira granite, Amazonia[18]
Utilisations
[modifier | modifier le code]Aluminium
[modifier | modifier le code]La cryolite est principalement utilisée comme fondant dans la production d'aluminium. Elle est mélangée à l'alumine extraite de la bauxite. Le mélange est fondu aux environs de 950 °C et ensuite électrolysé.
Elle a été choisie parce qu'elle dissout les fluorures et les oxydes (dont l'alumine) mais pas l'aluminium pur (métallique), elle conduit le courant électrique et elle fond à 1 011 °C.
Verre et céramique
[modifier | modifier le code]Pour la fabrication des verres, la cryolite est utilisée comme fondant et opacifiant. De même, elle abaisse la viscosité du verre en fusion, facilitant ainsi la suppression des bulles.
Comme dans le cas de l'alumine, c'est grâce à son pouvoir de dissolution des oxydes (SiO2, CaO par exemple) qu'elle abaisse la température de fusion de ces oxydes en formant des eutectiques. Son pouvoir opacifiant est utilisé pour augmenter l'opalescence (couleur de l'opale, pierre semi-précieuse de couleur blanche nacrée à reflet de nacre) de certains verres.
Elle entre dans la composition de certains émaux blancs dans des proportions allant de 5 à 15 % en masse. Elle aide à donner un aspect glacé par l'apport de fluorure.
Croissance des minéraux
[modifier | modifier le code]L'unique gisement de cryolite ne peut fournir les besoins industriels.
Elle est fabriquée par diverses techniques reposant sur le mélange de : acide fluorhydrique (HF), fluorure de sodium (NaF), fluorure d'ammonium, acide fluosilicique, acide fluoborique, hydroxyde d'aluminium, sulfate d'aluminium, aluminate de sodium, soude (NaOH), carbonate de sodium, chlorure de sodium (NaCl), sulfate de sodium.
La production mondiale (avec le fluorure d'aluminium AlF3) est de plus de 400 000 tonnes par an.
Production industrielle
[modifier | modifier le code]La cryolithe est préparée à partir de tétrafluorure de silicium, résidu de la fabrication d'acide fluorhydrique.
3 SiF4 + 2 H2O → 2 H2SiF6 + SiO2
H2SiF6 + 6 NH3 + 2 H2O → 6 NH4F + SiO2
La seconde étape consiste à l'attaque de l'alumine par : Al2O3 + 2 NaOH + 3 H2O → 2 Na[Al(OH4)-]
Finalement, Na[Al(OH4)-] + 6 NH4F + 2 NaOH → Na3AlF6 + 6 NH3 + 6 H2O
Notes et références
[modifier | modifier le code]- ICSD No. 4 029 ; (en) F.C. Hawthorne et R.B. Ferguson, « Refinement of the crystal structure of cryolite », The Canadian Mineralogist, vol. 13, no 4, , p. 377-382
- La classification des minéraux choisie est celle de Strunz, à l'exception des polymorphes de la silice, qui sont classés parmi les silicates.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fluorure double d'aluminium et de sodium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- (en) John W. Anthony, Richard A. Bideaux, Kenneth W. Bladh et Monte C. Nichols, The Handbook of Mineralogy : Arsenates, Phosphates, Vanadates, vol. IV, Mineral Data Publishing,
- d'Andrada, dans Allgemeines Journal der Chemie, Berlin 1798-1803, 1800
- Abildgaard, dans Allgemeines Journal der Chemie, Berlin 1798-1803 (Scherer’s Journal), vol. 2, 1799, p. 502
- (en) Helge Kragh (Institut des sciences exactes, Université Aarhus), « From curiosity to industry, the early history of cryolite soda manufacture », dans Cahier d'histoire de l'aluminium, no 18, été 199.
- René-Just Haüy, Traité de minéralogie, 1801, 1er éd., en 4 volumes avec atlas in fol., vol. 2, p. 157
- « Aluminium sodium fluoride » dans la base de données Hazardous Substances Data Bank, consulté le 14 août 2010
- (en) Thomas R. Dulski, A manual for the chemical analysis of metals, vol. 25, ASTM International, , 251 p. (ISBN 0-8031-2066-4, lire en ligne), p. 71
- (en) David Dolejš et Don R. Baker, « Phase transitions and volumetric properties of cryolite, Na3AlF6: Differential thermal analysis to 100 MPa », American Mineralogist, vol. 91, no 1, , p. 97-103 (DOI 10.2138/am.2006.1772)
- (en) Qingdi Zhou et Brendan J. Kennedy, « High-temperature powder synchrotron diffraction studies of synthetic cryolite Na3AlF6 », Journal of Solid State Chemistry, vol. 177, no 3, , p. 654-659 (DOI 10.1016/j.jssc.2003.08.012)
- ICSD No. 164 688 ; (en) Ľ. Smrčok, M. Kucharík, M. Tovar et I. Žižak, « High temperature powder diffraction and solid state DFT study of β-cryolite (Na3AlF6) », Crystal Research and Technology, vol. 44, no 8, , p. 834-840 (DOI 10.1002/crat.200900141)
- (en) Bernhard Bühn, Andrew H. Rankin, Martin Radtke, Martin Haller et Arndt Knöchel, « Burbankite, a (Sr,REE,Na,Ca)-carbonate in fluid inclusions from carbonatite-derived fluids: Identification and characterization using Laser Raman spectroscopy, SEM-EDX, and synchrotron micro-XRF analysis », American Mineralogist, vol. 84, , p. 1117-1125 (lire en ligne)
- dans Bulletin de Minéralogie, vol. 111, 1988, p. 477-492
- (en) H. T. Costi, R. Dall'Agnol, M. Pichavant et O. T. Ramo, « THE PERALKALINE TIN-MINERALIZED MADEIRA CRYOLITE ALBITE-RICH GRANITE OF PITINGA, AMAZONIAN CRATON, BRAZIL: PETROGRAPHY, MINERALOGY AND CRYSTALLIZATION PROCESSES », The Canadian Mineralogist, vol. 47, no 6, , p. 1301–1327 (ISSN 0008-4476 et 1499-1276, DOI 10.3749/canmin.47.6.1301, lire en ligne, consulté le )