תעשיית התרופות

תעשיית התרופות מגלה, מפתחת, מייצרת, ומשווקת תרופות כאמצעים לטיפול.[1] חברות התרופות עוסקות בתרופות גנריות או מותגיות ובמכשור רפואי. הן כפופות למגוון של חוקים ותקנות המסדירים פטנטים, בדיקות, בטיחות, בחינת יעילות ושיווק של תרופות.
היסטוריה
[עריכת קוד מקור | עריכה]לתעשיית התרופות המודרנית שני מקורות: האחד הוא בתי מרקחת מקומיים שהרחיבו את עיסוקם המסורתי בהפצת מוצרים מצמחי מרפא כגון מורפיום וכינין לכדי ייצור סיטוני באמצע המאה ה-19. גילוי תרופות שיטתי מצמחים התפתח במיוחד בעקבות בידוד מורפיום, כתרופה להרגעה ולשינה שהופקה מאופיום, על ידי שוליית-הרוקח הגרמני פרידריך שרטינר (Sertürner), שכינה אותו כך על שם האל היווני של החלומות, מורפיוס. תאגידים רב לאומיים, כולל מרק, הופמן-לה רוש, בורוז-Wellcome (כיום חלק מגלקסו סמית' קליין), מעבדות אבוט, אלי לילי ואפג'ון (כיום חלק מפייזר) החלו כבתי מרקחת מקומיים באמצע המאה ה-19. לקראת סוף שנות ה-80 של אותה מאה, שיפרו יצרני צבע גרמנים את תהליך הזיקוק של תרכובות אורגניות מזפת פחמית ומעוד מחצבים וכן ביססו שיטות ראשוניות של סינתזה כימית אורגנית.[2] התפתחות שיטות סינתזה כימיות איפשרה למדענים לגוון באופן שיטתי את המבנים של החומרים הכימיים, והתפתחות תורת הפרמקולוגיה הרחיבה את יכולתם להעריך את ההשפעות הביולוגיות של המבנים האלו.[דרושה הבהרה]
מאמצע המאה ה-19 ועד 1945: מצמחי מרפא לתרופות הסינתטיות הראשונות
[עריכת קוד מקור | עריכה]אפינפרין, נוראדרנלין, אמפטמין
[עריכת קוד מקור | עריכה]בשנות ה-90 של המאה ה-19, התגלתה ההשפעה העצומה של תמציות בלוטת יותרת הכליה על רקמות שונות, והוחל בחיפוש אחר המנגנון הכימי של העברת האות ובחיפוש דרכים לנצל תצפיות אלה לפיתוח תרופות חדשות. ההשפעות של תמציות בלוטת יותרת הכליה - כיווץ (הצרת) כלי-הדם והעלאת לחץ הדם - עניינו במיוחד מנתחים, אשר השתמשו בהן לצורך עצירת דימום וכטיפול בהלם. מספר חברות פיתחו מוצרים המבוססים על תמציות בלוטת יותרת הכליה שהכילו חומר פעיל במידות שונות של זיקוק. בשנת 1897, ג'ון אבל (John Abel) מאוניברסיטת ג'ון הופקינס זיהה את החומר הפעיל, אפינפרין, אותו בודד מהתערובת כמלח גופרתי. מאוחר יותר, הכימאי התעשייתי יוקישי טקמינה (Jokichi Takamine) פיתח שיטה להשגת אפינפרין טהור, ורשם את הזכויות על השיטה על שם פארקה דייוויס. פארקה דייוויס שיווק אפינפרין בשם המסחרי אדרנלין. הזרקת אפינפרין הוכחה כיעילה במיוחד כטיפול מיידי בהתקפי אסתמה, וגרסה למשאף נמכרה בארצות הברית עד 2011 (ערפל Primatene).[3][4] ב-1929 נארז אפינפרין במשאף לשימוש כטיפול נגד גודש באף.
למרות יעילותו, הצורך בהזרקה הגביל את השימוש באדרנלין ולכן חיפשו החוקרים נגזרים שניתן לתת פומית (כלומר, בבליעה). אפדרין, תרכובת הדומה למבנה של אדרנלין (ועוד יותר, לנוראדרנלין), זוהה על ידי כימאים יפנים בצמח מא-הואנג (אפדרה) ושווק על ידי חברת אלי לילי כתרופה פומית לטיפול באסתמה. בעקבות עבודתם של הנרי דייל וג'ורג' ברגר בחברת בורוז-וולקום, סינתז הכימאי האקדמאי גורדון אלס את האמפטמין ובחן אותו בחולי אסתמה בשנת 1929. נמצא שלתרופה השפעה מעטה נגד-אסתמה אבל היא מביאה לתחושות של התרוממות הרוח ודפיקות לב. חברת סמית', קליין ופרנץ' פיתחה משאף אמפטמין נגד גודש באף בשם המסחרי בנזדרין. בסופו של דבר, אמפטמין פותח לטיפול בנרקולפסיה ובפרקינסוניזם פוסט-אנצפליטי, להעלאת מצב רוח בדיכאון ולהתוויות פסיכיאטריות נוספות. ב-1937, איגוד הרפואה האמריקני אישר את האמפטמין כ"תרופה חדשה ולא רשמית" לשימושים אלו. אמפטמין נותר בשימוש נרחב כטיפול בדיכאון עד לפיתוח נוגדני הדיכאון הטריציקליים בשנות ה-60 של המאה-20.

גילוי ופיתוח של ברביטורטים
[עריכת קוד מקור | עריכה]ב-1903, פרסמו הרמן אמיל פישר וג'וזף פון מרינג את תגליתם כי חומצה דיאתיל-ברביטורית, הנוצרת מתגובה של חומצה דיאתיל-מאלונית, אוקסי-כלוריד זרחני ואוריאה, משרה שינה בכלבים. הפטנט על התגלית נרשם על שם חברת התרופות באייר, אשר שיווקה את התרכובת בשם המסחרי ורונאל, לשיפור השינה, החל מ-1904. מחקרים שיטתיים לגבי ההשפעה של שינויי מבנה על הפוטנטיות ועל משך הפעולה, הביאו לגילוי הפנוברביטל בבאייר ב-1911 ולגילוי השפעתו כנגד פרכוס אפילפטי ב-2012. פנוברביטל היה בין התרופות הנפוצות לשימוש כטיפול באפילפסיה בשנות ה-70 של המאה ה-20, ונכון ל-2014, נשאר ברשימת התרופות החיוניות של ארגון הבריאות העולמי.[5][6] בין השנים 1950–1970 הופיעה מודעות גוברת ליכולת הממכרת של ברביטורטים ושל אמפטמינים, שהביאה להגבלות על השימוש ולפיקוח ממשלתי גובר על נותני המרשמים. כיום, השימוש באמפטמין מוגבל בעיקר לטיפול בהפרעת קשב, והשימוש בפנוברביטל מוגבל בעיקר לטיפול באפילפסיה.[7][8]
אינסולין
[עריכת קוד מקור | עריכה]בסדרת ניסויים שבוצעו סביב תחילת המאה ה-20 נמצא כי סוכרת נגרמת עקב חסרונו של חומר המיוצר בלבלב. ב-1869, אוסקר מינקובסקי וג'וזף פון מרינג מצאו כי סוכרת יכולה להיגרם בכלבים על ידי כריתה של הלבלב. בשנת 1921, פרופסור פרדריק בנטינג הקנדי ותלמידו צ'ארלס בסט חזרו על המחקר ומצאו כי הזרקות של תמצית לבלב תיקנו את התסמינים שיצרה כריתת הלבלב. תוך זמן קצר הודגמה פעולת התמצית אצל בני אדם, אבל פיתוח של טיפול באינסולין כטיפול שגרתי נתקל בקשיים בייצור חומר בכמות מספקת ובמידת ניקיון אמינה. החוקרים ביקשו סיוע ושיתוף פעולה של אנשי חברת אלי לילי ושות' לאור ניסיונה בזיקוק בקנה מידה גדול של חומרים ביולוגיים. הכימאי ג'ורג ' וולדן מאלי לילי מצא כי התאמה זהירה של חומציות התמצית איפשרה זיקוק אינסולין ברמה יחסית טובה. תחת לחץ של אוניברסיטת טורונטו, ופוטנציאל למלחמת פטנטים מול מדעני אקדמיה שפיתחו שיטת זיקוק דומה באופן עצמאי, הושג הסכם לבלעדיות-ייצור של אינסולין על ידי מספר חברות. לפני הגילוי והזמינות הנרחבת של אינסולין, תוחלת החיים של חולי סוכרת הייתה רק חודשים ספורים.[9]
מחקר אנטיביוטי מוקדם: סאלברסאן, פרונטוסיל, פניצילין
[עריכת קוד מקור | עריכה]הפיתוח של תרופות לטיפול במחלות זיהומיות היה מוקד מרכזי של המחקר ומאמצי הפיתוח המוקדמים; ב-1900, דלקת ריאות, שחפת ושלשולים היו שלושת הגורמים המובילים למוות בארצות הברית, התמותה בשנה הראשונה לחיים עלתה על 10%.[10][11]
ב-1911 פיתחו פול ארליך והכימאי אלפרד ברטהיים מהמכון לטיפול ניסיוני בברלין את הארספנמין (arsphenamine), התרופה הסינתטית הראשונה נגד זיהום. התרופה כונתה בשם המסחרי סאלברסאן.[12] ארליך, ששם לב הן לרעילות הכללית של ארסן והן לספיגה הברירנית של צבעים מסוימים על ידי חיידקים, שיער כי צבעים כאלו המכילים ארסן יוכלו לשמש לטיפול נגד זיהומים חיידקיים. ארספנמין יוצר כחלק מיוזמה להפקת סדרה של תרכובות כאלה, ונמצא כי יש לו רעילות בררנית ( Selective Toxicity ) באופן חלקי. ארספנמין הוא הראשון שהוכח כטיפול יעיל נגד עגבת, מחלה אשר לפני כן הייתה חשוכת מרפא, והובילה באופן בלתי נמנע לכיבי עור חמורים, לנזק מוחי ולמוות.[דרוש מקור]
גישתו של ארליך, שינוי שיטתי של המבנה הכימי של חומרים סינתטיים ומדידת ההשפעות של שינויים אלה על הפעילות הביולוגית, הומשכה באופן נרחב על ידי מדעני התעשייה, כולל מדעני באייר ג'וזף קלרר, פריץ מיצש וגרהרד דומק. עבודה זו, שהתבססה גם על בדיקות של תרכובות זמינות מתעשיית הצבע הגרמנית, הובילה לפיתוח של פרונטוזיל (Prontosil), הנציג הראשון של האנטיביוטיקות מקבוצת הסולפונאמידים (sulfonamide). לעומת הארספנמין, לסולפונאמידים תחום רחב של פעילות והם הרבה פחות רעילים, מה שעושה אותם שימושיים גם כנגד זיהומים הנגרמים על ידי סטרפטוקוקים.[13] ב-1939 קיבל דומק פרס נובל לרפואה על גילוי זה.[14][15] עם זאת, הירידה הדרמטית במספר מקרי המוות ממחלות זיהומיות שהתרחשו לפני מלחמת העולם השנייה הייתה בעיקר תוצאה של שיפור אמצעים בריאותיים ציבוריים, כגון מים נקיים ודיור פחות צפוף, בעוד ההשפעה של תרופות אנטיביוטיות ושל חיסונים הייתה משמעותית בעיקר לאחר מלחמת העולם השנייה.[16][17]
בשנת 1928, גילה אלכסנדר פלמינג את ההשפעות האנטיבקטריאליות של פניצילין, אבל ניצולן לטיפול במחלות אנושיות המתין עד לפיתוח שיטות זיקוק וייצור בקנה מידה גדול. אלו פותחו על ידי התאגדות של חברות התרופות שהובילו ממשלות ארצות הברית ובריטניה במהלך מלחמת העולם השנייה.[18]
החיסונים המוקדמים
[עריכת קוד מקור | עריכה]במהלך תקופה זו, חלה התקדמות התחלתית לקראת פיתוח חיסונים, בעיקר בדרך של מחקר בסיסי אקדמי או במימון ממשלתי, שהופנה לזיהוי של מחוללי-מחלה האחראים למחלות מידבקות נפוצות. בשנת 1885 יצרו לואי פסטר ופייר פול אמיל רו את חיסון הכלבת הראשון. חיסוני הדיפתריה הראשונים יוצרו בשנת 1914 מתערובת של רעלן דיפטריה ואנטי-טוקסין (מופק מנסיוב של בעלי חיים שהודבקו), אבל בטיחות החיסון הייתה גבולית ולא נעשה בו שימוש נרחב. בשנת 1921 נרשמו בארצות הברית 206,000 מקרים של דיפתריה וכתוצאה מהם 15,520 נפטרים. בשנת 1923, במקביל למאמצי גסטון רמון ב"מכון פסטר" ואלכסנדר גלני ב"מעבדות מחקר וולקום" (מאוחר יותר חלק מ-GlaxoSmithKline), הובילו לגילוי כי חיסון יכול להיות בטוח יותר על ידי טיפול ברעלן-הדיפטריה עם פורמלין.[19] ב-1944, מוריס הילמן מחברת התרופות סקוויב פיתח לראשונה חיסון נגד דלקת מוח יפנית.[20] מאוחר יותר, עבר הילמן לחברת מרק, שם שיחק תפקיד מפתח בפיתוח חיסונים נגד חצבת, חזרת, אבעבועות רוח, אדמת, צהבת A, צהבת B ודלקת קרום המוח.

תרופות מסוכנות ותחילת אסדרת התעשייה
[עריכת קוד מקור | עריכה]לפני המאה ה-20, תרופות יוצרו בדרך כלל על ידי יצרנים בקנה מידה קטן ועם מעט חקיקה אסדרתית על הייצור או על טענות בטיחות ויעילות. כאשר חוקים כאלה היו קיימים, אכיפתם היה רפה. בארצות הברית, הדרבון לרגולציה מוגברת של חיסונים ושל עוד תרופות ביולוגיות, נוצר בארצות הברית מהתפרצויות טטנוס וממקרי מוות שנגרמו על ידי הפצה של חיסוני-אבעבועות-שחורות ונוגדני-דיפטריה שהיו מזוהמים.[21] חוק הפיקוח הביולוגי מ-1902 קבע כי יידרש אישור ממשלה פדרלי טרם שיווקה של כל תרופה ביולוגית וכן יידרש אישור עבור התהליך ומתקן הייצור של תרופות כאלו.
בשנת 1906 התווסף בארצות הברית גם חוק התרופות והמזונות הנקיים, אשר אסר על הפצה בין-מדינתית של מזון ותרופות קלוקלים או מזויפים. תרופות הוגדרו כמזויפות אם הכילו אלכוהול, מורפיום, אופיום, קוקאין, או כל חומר אחר העלול להיות מסוכן או ממכר, ואם התווית שלו איננה מציינת את כמותם או שיעורם של חומרים כאלו. עם זאת, בפסיקת בית המשפט העליון נידחו ניסיונות ממשלתיים להשתמש בחוק גם כדי לתבוע יצרנים על טענות-יעילות שאינן מבוססות.[22]
בשנת 1937, מעל 100 אנשים מתו לאחר בליעת "אליקסיר סולפנילאמיד" שיוצר על ידי חברת S.E. Massengill של טנסי. המוצר הוכן עם דיאתילן גליקול, שהוא ממס רעיל מאוד הנמצא כיום בשימוש נרחב כחומר נגד קיפאון.[23] על פי החוקים שהיו בתוקף באותו זמן, התביעה של היצרן התאפשרה רק בסעיף טכני, כי המוצר נקרא "אליקסיר", אשר משמעותו מומס באתנול. בעקבות אירוע זה, אישר הקונגרס האמריקאי את חוק המזון, התרופות והקוסמטיקה של 1938, אשר בפעם הראשונה דרש הוכחת בטיחות לפני מכירת התרופה וכן אסר במפורש על טענות-יעילות כוזבות.[24]
השנים שאחרי המלחמה, 1945-1970
[עריכת קוד מקור | עריכה]התקדמות במחקר נגד זיהומים
[עריכת קוד מקור | עריכה]בסיומה של מלחמת העולם השנייה חלה עליה דרמטית בגילויין של קבוצות חדשות של תרופות אנטי-בקטריאליות,[25] שכללה צפלוספורינים (שפותח על ידי אלי לילי על בסיס עבודתם הראשונית של ג'וזפה ברוצו ואדוארד אברהם),[26][27] סטרפטומיצין (שהתגלה במהלך מחקר במעבדת סלמן ווקסמן באוניברסיטת ראטגרס ב-1943, במימון חברת מרק[28]), טטרציקלינים[29] (שנתגלו במעבדות לדרלה, שהן כיום חלק מפייזר), אריתרומיצין (שהתגלתה במעבדות אלי לילי ושות')[30] ושל פיתוחיהן, עם פעילות מתרחבת כנגד מגוון של חיידקים מחוללי-מחלות. סטרפטומיצין היה הטיפול היעיל הראשון נגד שחפת. בזמן התגלית, 'בתי הבראה' לבידוד אנשים נגועי שחפת נמצאו בכל עיר במדינות המפותחות, בהם נפטרו 50% מהחולים בתוך 5 שנים מכניסתם.[31]
דו"ח נציבות הסחר הפדרלית מ-1958 ניסה לכמת את ההשפעה של אנטיביוטיקה על בריאות הציבור האמריקאי. דווח כי בשנים 1946–1955, חלה ירידה של 42% בשכיחות מחלות אשר אנטיביוטיקה יעילה כנגדן, לעומת רק 20% ירידה בשכיחות מחלות אשר אנטיביוטיקה לא יעילה נגדן. מסקנת הדו"ח הייתה כי "נראה שהשימוש באנטיביוטיקה, באבחון מוקדם, וכן גורמים אחרים הגבילו את התפשטות המגפות וכך את מספר המחלות האלו אשר התרחשו". מחקר נוסף בדק את שיעורי התמותה עבור שמונה מחלות נפוצות אשר אנטיביוטיקה הציעה טיפול יעיל נגדן (עגבת, שחפת, דיזנטריה, שנית, שעלת, זיהומים מנינגוקוקליים, דלקת ריאות), ונמצאה ירידה של 56% לעומת התקופה המקבילה.[32] בולטת בין אלה הייתה הירידה של 75% בשיעור מקרי מוות עקב שחפת.[33]

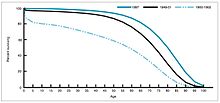
במהלך השנים 1940–1955, הואץ קצב הירידה בשיעור התמותה בארצות הברית מ-2% בשנה ל-8% בשנה, ואז חזר לקצב הקודם של 2% לכל שנה. הירידה הדרמטית בשנים שלאחר המלחמה יוחסה להתפתחות המהירה של טיפולים חדשים ושל חיסונים נגד מחלות זיהומיות. פיתוח החיסונים המשיך להאיץ, ובלט במיוחד בתקופה זו פיתוח חיסון פוליו (1954) על ידי ג'ונאס סאלק במימון הקרן הלאומית של שיתוק הילדים (מוסד ללא כוונת רווח). תהליך החיסון לא נרשם כפטנט, ונמסר לחברות התרופות כך שהתאפשר ייצור בעלות נמוכה כתרופה גנרית. ב-1960, זיהה מוריס הילמן מחברת מרק-שארפ-ודוהם את וירוס ה-SV40, שבהמשך נמצא כגורם גידולים במיני יונקים רבים. מאוחר יותר נקבע, כי SV40 זיהם אצוות חיסוני פוליו שניתנו ל-90% מילדי ארצות הברית.[35][36] מקור הזיהום הוא כנראה בתאים המקוריים וברקמות הקוף ששימשו לייצור. ב-2004 הודיע מכון הסרטן של ארצות הברית כי הגיע למסקנה ש-SV40 לא קשור בסרטן אצל בני אדם.[37]
חיסונים חדשים בולטים אחרים של התקופה כוללים את חיסוני החצבת (1962, ג'ון פרנקלין אנדרס המרכז הרפואי לילדים של בוסטון, עם שיפור בהמשך על ידי מוריס הילמן מ"מרק"), האדמת (1969, הילמן, "מרק"), חזרת (1967, הילמן, "מרק"). חלה נפילה של מעל 95% בהארעות של אדמת, תסמונת אדמת מולדת, חצבת וחזרת בעקבות החיסון הנרחב.[38] הוערך כי ב-20 השנים שלאחר רישוי החיסון נגד חצבת בארצות הברית נמנעו כ-52-מיליון מקרים של המחלה, 17,400 מקרים של פיגור שכלי, ו-5,200 מקרי מוות.[39]
פיתוח ושיווק של תרופות נוגדות יתר לחץ דם
[עריכת קוד מקור | עריכה]יתר לחץ דם הוא גורם סיכון לטרשת עורקים,[40] אי ספיקת לב,[41] מחלת עורקים כלילית,[42][43] שבץ,[44] מחלת כליות,[45][46] ומחלת עורקים היקפית,,[47][48] והוא גורם הסיכון המוכר ביותר לתחלואת הלב וכלי הדם ולתמותה, במדינות המתועשות.[49] לפני 1940, כ-23% מכלל מקרי המוות בקרב אנשים מעל גיל 50 יוחסו ליתר לחץ דם. מקרים חמורים של יתר לחץ דם טופלו על ידי ניתוח.[50]
פיתוחים מוקדמים בתחום של טיפול ביתר לחץ דם כללו חוסמי מערכת עצבים סימפתטית מסוג יוני אמוניום רבעוני, אך תרכובות אלו מעולם לא היו בשימוש נרחב, בשל תופעות הלוואי החמורות שלהם וכיוון שניתנו באמצעות הזרקה.
ב-1952 גילו חוקרי Ciba את מרחיב כלי הדם הראשון הזמין בבליעה: הידרלזין.[51] אך נמצא כי הטיפול בהידרלזין בלבד מאבד את ההשפעה לאורך זמן (טכיפילקסיס). בסביבות 1955 נמצא ופותח כלורותיאזיד (chlorothiazide) על ידי קרל ה. באייר, ג'יימס מ. ספראג, ג'ון א. בר ופרדריק ס. נובלו ממרק ושות'. כלורותיאזיד הוא עדיין התרופה הנפוצה ביותר נגד יתר לחץ דם.[52] נטען כי התפתחות זו הייתה קשורה עם ירידה משמעותית בשיעור התמותה בקרב אנשים עם יתר לחץ דם (אם כי שיעור התמותה ממחלות אחרות ירד עוד יותר באותה תקופה). הממציאים זכו בפרס לסקר לבריאות הציבור בשנת 1975 על "הצלת חייהם של אלפים רבים מספור והקלת סבלם של מיליוני קורבנות של יתר לחץ דם".[53]
בסקירת קוקרן מ-2009 הוסק כי תרופות נוגדות יתר לחץ דם מסוג תיאזידים מפחיתות אצל אנשים עם לחץ דם גבוה את הסיכון למוות (ביחס סיכון של 0.89), לשבץ (0.63), למחלת לב כלילית (0.84), ולאירועי לב וכלי דם (0.70).[54] במשך השנים פותחו סוגים אחרים של תרופות נוגדות יתר לחץ דם ונכנסו לשימוש נרחב גם כטיפול משולב, כולל 'משתני לולאה' (לסיקס/פוזיד, Hoechst 1963),[55] חוסמי בטא (ICI 1964)[56] מעכבי ACE, וחוסמי קולטן אנגיוטנסין. לגבי מעכבי ACE הוסק, בסקירת קוקרן מ-2012, כי הם מפחיתים את הסיכון למחלת כליות חדשה (ביחס סיכון של 0.71) ולמוות (0.84) בחולי סוכרת, אם כי הוערכה מידה גבוהה של פרסום-חלקי או סלקטיבי ב-31% מכלל המחקרים.[57]
גלולות למניעת הריון
[עריכת קוד מקור | עריכה]לפני מלחמת העולם השנייה, נאסרו אמצעי מניעה במדינות רבות, ובארצות הברית, אפילו עצם הדיון בשיטות מניעה הוביל לעיתים לתביעה לפי חוקי קומסטוק. ההיסטוריה של פיתוח הגלולות למניעת הריון קשורה לכן באופן הדוק לתנועה לאמצעי מניעה ולמאמציהן של הפעילות מרגרט סאנגר, מרי דנט, ואמה גולדמן. בהתבסס על מחקר בסיסי שבוצע על ידי גרגורי פינקוס, ועל שיטות סינתטיות לייצור פרוגסטרון שפותחו על ידי קרל דג'רסי ב-Syntex ועל ידי פרנק קולטון מג.ד. סירל ושות', פותחה הגלולה הראשונה למניעת היריון, אנבוייד, על ידי ג.ד. סריל ושות'. ואושרה על ידי ה-FDA ב-1960. בנוסחה המקורי שולבו מינוני יתר גדולים של הורמונים, וגרמה לתופעות לוואי חמורות. עם זאת, עד 1962, 1.2 מיליון נשים אמריקאיות נטלו את הגלולה, ועד 1965 עלה מספרן ל-6.5 מיליון.[58][59][60][61] הזמינות של אמצעי זמני ונוחה למניעת הריון הובילה לשינויים דרמטיים בנורמות החברתיות, כולל הרחבת מרחב סגנונות- החיים העומדים בפני נשים, הפחתת ההסתמכות של נשים על גברים במניעת הריון, עידוד עיכוב הנישואין ועליה בשכיחות מגורים-משותפים טרם הנישואין.[62]
תלידומיד ותיקוני קפאובר-האריס
[עריכת קוד מקור | עריכה]
בעקבות שימוע בקונגרס שערך ב-1959 הסנטור אסטס קיפאובר מטנסי, נוצרה דחיפה לתיקונים של חוק המזון-התרופות-והקוסמטיקה של ארצות הברית. השימוע כיסה מגוון רחב של בעיות, ביניהן פרסומים מטעים, ספקות לגבי תועלת של תרופות והצורך בהגברת הפיקוח על התעשייה. בזמן שבו תנופת החקיקה החדשה נחלשה זמנית עקב ויכוח נרחב, התבררו פרטי האסון שהדגישו את הצורך ברגולציה מקיפה יותר וסיפקו את הכוח המניע להעברתם של חוקים חדשים.
ב-12 בספטמבר 1960, הגישה חברת ויליאם ס. מרל מסינסינטי בקשה לאישור תרופה חדשה לתלידומיד (Kevadon), חומר הרגעה ששווק באירופה מאז 1956. פרנסס קלסי, קצין הרפואה של מנהל המזון והתרופות (FDA) שמונה לבדוק את החומר, האמין כי הנתונים התומכים בבטיחות התלידומיד היו חלקיים. החברה המשיכה ללחוץ על קלסי ועל מנהל-התרופות לאשר את הבקשה עד נובמבר 1961, אז הוצאה התרופה מהשוק הגרמני בשל הקשר שלה עם מומים מולדים חמורים. אלפי תינוקות באירופה ובמקומות אחרים סבלו מתופעות לואי טרטוגניות של תלידומיד. החברה הפיצה את התלידומיד בלי אישור ה-FDA, במסווה של מחקר, ליותר מ-1,000 רופאים ומעל 20,000 אמריקאים קיבלו תלידומיד במסגרת ה"מחקר", ביניהם 624 מטופלות בהריון. 17 ילודים בארצות הברית סבלו מהשפעות התרופה.[63]
אסון התלידומיד "הקים לתחייה" את הצעת החוק של קיפאובר שהייתה תקועה בקונגרס, תיקון קיפאובר-האריס הפך לחוק ב-10 באוקטובר 1962. מאז, על היצרנים להוכיח ל-FDA כי התרופות שלהם יעילות וגם בטוחות לפני שהם יכולים לשווק אותן בארצות הברית. ה-FDA קיבל גם את הסמכות להסדיר את הפרסום של תרופות המרשם ולבסס את שיטות הייצור טוב. החוק דרש, כי על כל התרופות שהוספו בין 1938 וב-1962 יש להוכיח יעילות. מחקר משותף ל-FDA ולאקדמיה הלאומית למדעים הראה כי כ-40% ממוצרים אלה לא היו יעילים. מחקר דומה בהיקפו לגבי תרופות-ללא-מרשם החל עשר שנים מאוחר יותר.[64]
1970–1980
[עריכת קוד מקור | עריכה]סטטינים
[עריכת קוד מקור | עריכה]ב-1971, זיהה אקירה אנדו, ביוכימאי יפני מחברת התרופות סנקיו (Sankyo), את מבנה המולקולה של רעלן בשם מבסטאטין (mevastatin, ML-236B). זהו סטאטין, המיוצר על ידי פטריית העובש Penicillium citrinum, ומעכב את האנזים HMG-CoA רדוקטאז, שהוא אנזים חיוני המשמש את הגוף לייצר כולסטרול. ניסויים בבעלי חיים הראו הפחתה משמעותית ברמת הכולסטרול יחד עם השפעות רעילות, כולל גידולים, פגיעה בשריר ולפעמים מוות של כלבי המעבדה. כתוצאה מכך מבסטאטין לא שווק לשימוש בבני אדם. בהמשך זוהו ופותחו סטטינים נוספים, שחלקם אושרו כתרופות נגד מחלות לב וכלי דם ומשווקים בהצלחה: ב-1987 הם הפכו לתרופות הנמכרות בעולם.[65] בשנת 2003 הוחל בהפצת רוזובסטטין ובשנת 2013, היא הייתה התרופה הרביעית הנמכרת ביותר בארצות הברית, עם כ-5.2 מיליארד דולר במכירות.[66]
 ערך מורחב – סטטין#היסטוריה
ערך מורחב – סטטין#היסטוריה
מחקר ופיתוח
[עריכת קוד מקור | עריכה]גילוי תרופות הוא התהליך שבו תרופות פוטנציאליות מזוהות או מתוכננות. בעוד שבעבר, רוב התרופות התגלו על ידי בידוד המרכיב הפעיל שבתרופות מסורתיות או על ידי גילוי מקרי. הביוטכנולוגיה מודרנית מתמקדת לעיתים קרובות בהבנת תהליכים מטבוליים הקשורים למצבי מחלה או לגורמי-מחלה, ובשינוי התהליכים שלהם על ידי שימוש בביולוגיה מולקולרית או בביוכימיה. חלק גדול מהשלבים המוקדמים של גילוי-תרופות בוצע על ידי אוניברסיטאות ומוסדות מחקר.
פיתוח תרופות מתייחס לפעילויות שבוצעו לאחר שזוהה חומר עם פוטנציאל תרופתי, כדי לבסס את התאמתו כתרופה. מטרות פיתוח התרופות הן לקבוע פורמולציה ומינון, כמו גם כדי לבסס את הבטיחות. המחקר בתחומים אלה כולל בדרך כלל שילוב של מחקרי מבחנה, מחקרים בתאים-חיים וניסויים קליניים. העלות הגבוהה של שלבי הפיתוח המאוחרים, ממומנת בדרך כלל על ידי חברות התרופות הגדולות.[67]
עלות מחקר ופיתוח
[עריכת קוד מקור | עריכה]גילוי ופיתוח תרופות הם יקרים מאוד. מבין כל התרכובות הנחקרות לשימוש בבני אדם, יאושרו בסופו של דבר (על ידי המוסדות רפואיים או הוועדות הממשלתיות ברוב מדינות) רק חלק קטן. בשנת 2010 אושרו 18 מולקולות חדשות (NMEs) ו-3 תרופות ביולוגיות על ידי ה-FDA, או 21 בסך הכל, ובשנים 2006 עד 2009 אושרו 22, 18, 24 ו-26, עם ממוצע שנתי של 22.9 לשנה מאז 2001, לפי המרכז להערכה וחקר תרופות.[68] החוקרים לייט ולקסצ'ין דיווחו ב-2012, כי שיעור האישור של תרופות חדשות היה יציב יחסית בשיעור ממוצע של 15 עד 25 במשך עשרות שנים.[69] אישורים אלו מגיעים רק לאחר השקעה כבדה בפיתוח טרום-קליני וקליני, כמו גם מחויבות מתמשכת לניטור בטיחות. בגילוי ובפיתוח תרופות אשר לא השלימו את התהליך הזה כרוכות עלויות גדולות לעיתים קרובות, ללא הכנסות בתמורה. כאשר נלקחה בחשבון עלות התרופות שנכשלו, עלות פיתוח מוצלח של התרופה החדשה (ישות כימית חדשה, NCE), הוערכה ב כ-1.3 מיליארד דולר[70](לא כולל הוצאות השיווק).
בעוד עלות המחקר בארצות הברית הייתה 34.2 מיליארד דולר בין 1995 ל-2010, ההכנסות עלו מהר אף יותר - ב-200.4 מיליארד דולר בתקופה זו.[71] הוצאות תעשיית התרופות הכוללות על מחקר ועל השקעות (כמו שיווק) הגיעו לשיא של $65.3 מיליארד דולר ב-2009. במחקר של חברת הייעוץ ביין ושות' דווח כי עלויות הגילוי, הפיתוח והשיווק של תרופה חדשה (יחד עם התרופות שנכשלו בתהליך) טיפסו בתקופה של 5 שנים לקרוב ל-1.7 מיליארד ב-2003.[72] לפי פורבס, עלויות הפיתוח הכוללות ב-2010 נעו בין 4–11 מיליארד דולר לתרופה. לגבי משמעות חלקן של הוצאות השיווק בעליה זו, ראו דיון בהמשך. חלק מהתרופות המאושרות, כגון אלו המבוססות על פורמולציה מחדש של מרכיב פעיל קיים (ומכונות גם 'הארכות-קו') הן זולות בהרבה לפיתוח.
תרופות ומגדר
[עריכת קוד מקור | עריכה]ברוב המחקרים הקליניים בתעשיית התרופות משתתפים גברים בלבד.
דוח מקנזי (McKinsey Health Institute) [73]אשר פורסם בינואר 2024 הציע להתאים תרופות ומחקרים שנוסו על נשים ובכך לצמצם את כמות הנשים הלוקות בבריאותן. דו"ח זה טען כי במאה שנים האחרונות מנהל המזון האמריקאי (FDA) אישר מעל 1,500 רכיבי תרופות חדשים אשר לא נוסו על נשים. כלומר התרופות אינן מתחשבות בהבדלים הביולוגים בין הגברים לנשים.
כך יוצא אפוא כי טיפול באותה מחלה הניתן לאישה ולגבר יביא לתוצאות שונות ביעילות ובתופעות הלוואי.
חילוקי דעות
[עריכת קוד מקור | עריכה]מחקר
קיימת נטייה מוכחת להימנע מפרסום תוצאות מחקרים שאינן רצויות על ידי חברות התרופות שמימנו את המחקרים.[74] הבנה זו הביאה להידוק הפיקוח בנושא על ידי קבוצות עצמאיות וממשלתיות כאחד. בעקבות מספר מקרים בהם לא פורסמו נתונים 'לא רצויים' ממחקרים שנתמכו על ידי חברות תרופות, פרסם גם איגוד הסחר של החוקרים ויצרני התרופות של אמריקה הנחיות חדשות המדרבנות את החברות לדווח על כל הממצאים ולהגביל את המעורבות הכספית של חברות התרופות עם החוקרים.[75] בקונגרס האמריקאי נחקק חוק הדורש רישום ניסויים קליניים (שלב II ושלב III) על ידי היוזם באתר ייעודי,[76] המנוהל על ידי המכון הלאומי האמריקאי לבריאות (NIH). חוק זה תקף מ-26 בדצמבר 2007.[77]
בישראל, חובת רישום מחקרים רפואיים באתר ה-NIH חלה משנת 2014, והחל מה-15 במאי 2017, מותנה אישור לביצוע מחקר רפואי חדש ברישום שלו במאגר משרד הבריאות.[78] עם זאת, חובת פרסום תוצאות המחקרים אינה נאכפת ביעילות.[79]
גם כאשר חוקרי התרופות אינם מועסקים ישירות על ידי חברות התרופות, רבים נעזרים בהן על ידי קבלת מענקים, וחברות מרבות להיעזר בחוקרים כאלו כדי להציג את מוצריהן כעדיפים. חוקרים מתוגמלים בעקיפין על ידי חברות התרופות גם בתמיכה בעלויות כנסים וכדומה. תוכני הרצאות ואפילו מאמרים שמוצגים על ידי חוקרים אקדמיים עשוי למעשה להיכתב על ידי "סופרי צללים" מטעם חברות התרופות.[80]
מספר מטא-אנליזות הראו שמחקרים פסיכיאטריים שמומנו על ידי חברות תרופות מדווחים על תוצאות חיוביות בשכיחות כפולה, ושאם עובד החברה מעורב במחקר, ההשפעה על הדיווח גדלה עוד יותר.[81][82][83]
שיווק
המחלוקת הגוברת סביב שיווק תרופות והשפעה חברות התרופות קשורה בממצאים של השפעה על רופאים ואנשי מקצועות בריאות אחרים באמצעות נציגי החברות באמצעים שכוללים 'מתנות שיווק' קבועות ומסירת מידע מוטה לאנשי מקצועות הבריאות;[84] פרסום נרחב בכתבי עת ובכנסים; מימון 'ארגוני בריאות עצמאיים' ו'מסעות קידום בריאות'; שתדלנות מול רופאים ופוליטיקאים (יותר מאשר בכל תעשייה אחרת בארצות הברית[85]); מימון של בתי ספר לרפואה או הכשרת אחיות; מתן חסות נמשכת לאירועים חינוכיים, עם השפעה על תוכנית הלימודים;[86] וגיוס רופאים לוועדות-מייעצות בתשלום.
קבוצות עניין כמו 'אין ארוחות חינם' (No Free Lunch) ו-AllTrials, מתחו ביקורת על השפעה זו בטענה שהן מטות את הרופאים לרשום את תרופות המשווקות גם כאשר אחרות עשויות להיות זולות או טובות יותר למטופלים.[87]
בהקשר לכך, מואשמת תעשיית התרופות בניפוח או המצאת מחלות (Disease mongering)[88] שמטרתה הרחבת השוק לתרופות. כנס יסוד בנושא התקיים באוסטרליה ב-2006.[89] ב-2009 הושקה תוכנית "מחפשים ראיות - מזהים הגזמות" ("Finding Evidence – Recognising Hype") על ידי שירות המרשמים הממשלתי באוסטרליה.[90]
סקירת ועדה מיוחדת של ממשלת בריטניה הגיעה לאותן מסקנות שלמעלה בהקשר לאיחוד האירופי[91] ובו בזמן הדגישה גם את תרומותיה וצרכיה של התעשייה.
בתחקיר של פרופבליקה נמצאו לפחות 21 רופאים שקיבלו מיצרני תרופות יותר מ-500,000 דולר עבור הרצאות וייעוץ מאז 2009. מחצית בעלי השכר הגבוה היו פסיכיאטרים, וסך התשלומים לרופאים עבור שירותים כאלה היה כ-2 מיליארד דולר. החברות אסטרא-זנקה, ג'ונסון & ג'ונסון ו- איליי לילי שילמו מיליארדי דולרים בעסקות טיעון בעקבות האשמות על תשלום לרופאים לצורך קידום תרופות לשימושים לא מאושרים. במספר בתי ספר בולטים לרפואה התהדקו מאז הכללים לגבי קבלה של תשלומים מחברות התרופות על ידי סגל.[92]
לעומת תפיסה זו, מאמרים שהופיעו ב-New England Journal of Medicine ממאי 2015, כולל מאמר מערכת, הדגישו את חשיבות יחסי הגומלין של תעשיית התרופות והרופאים לפיתוח של טיפולים חדשים. במאמרים נטען כי הזעם המוצדק על פשעי התעשייה הוביל רבים להפריז בחשיבותם של ניגודי עניינים. המאמר ציין כי ארגוני בריאות גדולים כמו המרכז הארצי לקידום תרגום-מדע (ליישום) של המכון הלאומי לבריאות, מועצת יועצי הנשיא למדע והטכנולוגיה, הפורום הכלכלי העולמי, קרן גייטס, קרן ולקם ומינהל המזון והתרופות האמריקאי עודדו יחסי-גומלין בין הרופאים לבין התעשייה לטובת חולים.[93][94]
מחירי התרופות
המחירים שגובות חברות התרופות המובילות בעולם שנויים במחלוקת, מאחר שמחירם היקר של תרופות מצילות חיים הם מעבר להישג ידם של רבים. בנוסף, באמצעות תרגילים משפטיים, מונעות החברות שיווק של גרסאות גנריות זולות של תרופות בהן הן מחזיקות בפטנט (גם לאחר שהפטנט פג).[95] בשנת 2013, הסרט הדוקומנטרי 'אש בתוך הדם' (Fire in the Blood), טען שחברות התרופות גרמו למיליוני מקרי מוות מיותרים באפריקה, מאחר שחסמו שיווק של תרופה גנריות זולות ביבשת.[96] בהודו התיר חוק הפטנטים ייצור העתקים לתרופות המוגנות בפטנט, במקרים שבהם הפקת ההעתק כרוכה בתהליך ייצור שונה מזה של התרופה המקורית, כדי לייצור ולשווק תרופות בעלות זולה יותר.[97] חברות התרופות הבנילאומיות לוחצות על הודו לא לאפשר לייצר גרסאות גנריות פחות יקרות של תרופות מוגנות בפטנט.[98]
ראו גם
[עריכת קוד מקור | עריכה]קישורים חיצוניים
[עריכת קוד מקור | עריכה]- תעשיית התרופות, באתר אנציקלופדיה בריטניקה (באנגלית)
 תעשיית תרופות, דף שער בספרייה הלאומית
תעשיית תרופות, דף שער בספרייה הלאומית
הערות שוליים
[עריכת קוד מקור | עריכה]- ^ McGuire, John L.; Hasskarl, Horst; Bode, Gerd; Klingmann, Ingrid; Zahn, Manuel (2007). Pharmaceuticals, General Survey. doi:10.1002/14356007.a19_273.pub2.
- ^ "Top Pharmaceuticals: Introduction: EMERGENCE OF PHARMACEUTICAL SCIENCE AND INDUSTRY: 1870-1930".
- ^ Walter Sneader (31 באוקטובר 2005). Drug Discovery: A History. John Wiley & Sons. pp. 155–156. ISBN 978-0-470-01552-0.
{{cite book}}: (עזרה) - ^ Rasmussen, Nicolas (2006). "Making the First Anti-Depressant: Amphetamine in American Medicine, 1929-1950". J Hist Med Allied Sci. 61 (3): 288–323. doi:10.1093/jhmas/jrj039. PMID 16492800.
- ^ Yasiry Z, Shorvon SD (בדצמבר 2012). "How phenobarbital revolutionized epilepsy therapy: the story of phenobarbital therapy in epilepsy in the last 100 years". Epilepsia. 53 Suppl 8: 26–39. doi:10.1111/epi.12026. PMID 23205960.
{{cite journal}}: (עזרה)תחזוקה - ציטוט: שימוש בפרמטר authors (link) - ^ López-Muñoz F, Ucha-Udabe R, Alamo C (בדצמבר 2005). "The history of barbiturates a century after their clinical introduction". Neuropsychiatr Dis Treat. 1 (4): 329–43. PMC 2424120. PMID 18568113.
{{cite journal}}: (עזרה)תחזוקה - ציטוט: שימוש בפרמטר authors (link) - ^ "Drug Abuse Control Amendments of 1965". NEJM. 273 (22): 1222–1223. 1965-11-25. doi:10.1056/NEJM196511252732213.
Officers of the Food and Drug Administration, aware of the seriousness of the problem, estimate that approximately half the 9,000,000,000 barbiturate and amphetamine capsules and tablets manufactured annually in this country are diverted to illegal use. The profits to be gained from the illegal sale of these drugs have proved an attraction to organized crime, for amphetamine can be purchased at wholesale for less than $1 per 1000 capsules, but when sold on the illegal market, it brings $30 to $50 per 1000 and when retailed to the individual buyer, a tablet may bring as much as 10 to 25 cents.
- ^ "Sedative-Hypnotic Drugs — The Barbiturates — I". NEJM. 255 (24): 1150–1151. 1956. doi:10.1056/NEJM195612132552409.
THE barbiturates, introduced into medicine by E. Fischer and J. von Mering1 in 1903, are certainly among the most widely used and abused drugs in medicine. Approximately 400 tons of these agents are manufactured each year; this is enough to put approximately 9,000,000 people to sleep each night for that period if each were given a 0.1-gm. dose
- ^ Louis Rosenfeld, Insulin: discovery and controversy, Clinical Chemistry 48, December 2002, עמ' 2270–2288
- ^ "www.cdc.gov" (PDF).
- ^ "www.cdc.gov" (PDF).
- ^ Sepkowitz KA (ביולי 2011). "One hundred years of Salvarsan". N. Engl. J. Med. 365 (4): 291–3. doi:10.1056/NEJMp1105345. PMID 21793743.
{{cite journal}}: (עזרה) - ^ Aminov RI (2010). "A brief history of the antibiotic era: lessons learned and challenges for the future". Front Microbiol. 1: 134. doi:10.3389/fmicb.2010.00134. PMC 3109405. PMID 21687759.
- ^ Hager, Thomas (2006). The demon under the microscope : from battlefield hospitals to Nazi labs, one doctor's heroic search for the world's first miracle drug (1st ed.). New York: Harmony Books. ISBN 1-4000-8213-7.
- ^ "Nobel Prize Facts". www.nobelprize.org. נבדק ב-19 במאי 2016.
{{cite web}}: (עזרה) - ^ "www.nber.org" (PDF).
- ^ Klein, Herbert (2012). A Population History of the United States. Cambridge University Press. p. 167.
- ^ John Parascandola (1980). The History of antibiotics: a symposium. American Institute of the History of Pharmacy No. 5. ISBN 0-931292-08-5.
- ^ "Diphtheria — Timelines — History of Vaccines".
- ^ "Maurice R. Hilleman, 85; Scientist Developed Many Vaccines That Saved Millions of Lives - Los Angeles Times".
- ^ "Significant Dates in U.S. Food and Drug Law History".
- ^ "FDAReview.org, a project of The Independent Institute".
- ^ "Sulfanilamide Disaster".
- ^ "FDA History - Part II".
- ^ Zaffiri L, Gardner J, Toledo-Pereyra LH (באפריל 2012). "History of antibiotics. From salvarsan to cephalosporins". J Invest Surg. 25 (2): 67–77. doi:10.3109/08941939.2012.664099. PMID 22439833.
{{cite journal}}: (עזרה)תחזוקה - ציטוט: שימוש בפרמטר authors (link) - ^ Hamilton-Miller JM (במרץ 2008). "Development of the semi-synthetic penicillins and cephalosporins". Int. J. Antimicrob. Agents. 31 (3): 189–92. doi:10.1016/j.ijantimicag.2007.11.010. PMID 18248798.
{{cite journal}}: (עזרה) - ^ Abraham EP (1987). "Cephalosporins 1945-1986". Drugs. 34 Suppl 2 (Supplement 2): 1–14. doi:10.2165/00003495-198700342-00003. PMID 3319494.
- ^ Kingston W (ביולי 2004). "Streptomycin, Schatz v. Waksman, and the balance of credit for discovery". J Hist Med Allied Sci. 59 (3): 441–62. doi:10.1093/jhmas/jrh091. PMID 15270337.
{{cite journal}}: (עזרה) - ^ Nelson ML, Levy SB (בדצמבר 2011). "The history of the tetracyclines". Ann. N. Y. Acad. Sci. 1241 (1): 17–32. doi:10.1111/j.1749-6632.2011.06354.x. PMID 22191524.
{{cite journal}}: (עזרה)תחזוקה - ציטוט: שימוש בפרמטר authors (link) - ^ "ERYTHROMYCIN". Br Med J. 2 (4793): 1085–6. בנובמבר 1952. doi:10.1136/bmj.2.4793.1085. PMC 2022076. PMID 12987755.
{{cite journal}}: (עזרה) - ^ Anderson, Rosaleen (2012). Antibacterial agents chemistry, mode of action, mechanisms of resistance, and clinical applications. Oxford: WiBlackwell. ISBN 9780470972458.
- ^ Federal Trade Commission Report of Antibiotics Manufacture, June 1958 (Washington D.C., Government Printing Office, 1958) pages 98-120
- ^ Federal Trade Commission Report of Antibiotics Manufacture, June 1958 (Washington D.C., Government Printing Office, 1958) page 277
- ^ "Prevention of Measles, Rubella, Congenital Rubella Syndrome, and Mumps, 2013".
- ^ SWEET BH, HILLEMAN MR (בנובמבר 1960). "The vacuolating virus, S.V. 40". Proc. Soc. Exp. Biol. Med. 105 (2): 420–7. doi:10.3181/00379727-105-26128. PMID 13774265.
{{cite journal}}: (עזרה)תחזוקה - ציטוט: שימוש בפרמטר authors (link) - ^ Shah K, Nathanson N (בינואר 1976). "Human exposure to SV40: review and comment". Am. J. Epidemiol. 103 (1): 1–12. PMID 174424.
{{cite journal}}: (עזרה)תחזוקה - ציטוט: שימוש בפרמטר authors (link) - ^ "Studies:No Evidence That SV40 is Related to Cancer - National Cancer Institute".
- ^ "Prevention of Measles, Rubella, Congenital Rubella Syndrome, and Mumps, 2013".
- ^ Bloch AB, Orenstein WA, Stetler HC (1985). "Health impact of measles vaccination in the United States". Pediatrics. 76 (4): 524–32. PMID 3931045.
{{cite journal}}: תחזוקה - ציטוט: שימוש בפרמטר authors (link) - ^ Insull W (בינואר 2009). "The pathology of atherosclerosis: plaque development and plaque responses to medical treatment". The American Journal of Medicine. pp. S3–S14. doi:10.1016/j.amjmed.2008.10.013. PMID 19110086. נבדק ב-2009-06-20.
{{cite web}}: (עזרה) - ^ Gaddam KK, Verma A, Thompson M, Amin R, Ventura H (במאי 2009). "Hypertension and cardiac failure in its various forms". The Medical Clinics of North America. pp. 665–80. doi:10.1016/j.mcna.2009.02.005. PMID 19427498. נבדק ב-2009-06-20.
{{cite web}}: (עזרה)תחזוקה - ציטוט: שימוש בפרמטר authors (link) - ^ Agabiti-Rosei E (בספטמבר 2008). "From macro- to microcirculation: benefits in hypertension and diabetes". Journal of Hypertension. pp. S15–21. doi:10.1097/01.hjh.0000334602.71005.52. PMID 19363848. אורכב מ-המקור ב-2012-02-02. נבדק ב-2009-06-20.
{{cite web}}: (עזרה) - ^ Murphy BP, Stanton T, Dunn FG (במאי 2009). "Hypertension and myocardial ischemia". The Medical Clinics of North America. pp. 681–95. doi:10.1016/j.mcna.2009.02.003. PMID 19427499. נבדק ב-2009-06-20.
{{cite web}}: (עזרה)תחזוקה - ציטוט: שימוש בפרמטר authors (link) - ^ White WB (במאי 2009). "Defining the problem of treating the patient with hypertension and arthritis pain". The American Journal of Medicine. pp. S3–9. doi:10.1016/j.amjmed.2009.03.002. PMID 19393824. נבדק ב-2009-06-20.
{{cite web}}: (עזרה) - ^ Truong LD, Shen SS, Park MH, Krishnan B (בפברואר 2009). "Diagnosing nonneoplastic lesions in nephrectomy specimens". Archives of Pathology & Laboratory Medicine. pp. 189–200. doi:10.1043/1543-2165-133.2.189. PMID 19195963. נבדק ב-2009-06-20.
{{cite web}}: (עזרה)תחזוקה - ציטוט: שימוש בפרמטר authors (link) - ^ Tracy RE, White S (בפברואר 2002). "A method for quantifying adrenocortical nodular hyperplasia at autopsy: some use of the method in illuminating hypertension and atherosclerosis". Annals of Diagnostic Pathology. pp. 20–9. doi:10.1053/adpa.2002.30606. PMID 11842376. נבדק ב-2009-06-20.
{{cite web}}: (עזרה)תחזוקה - ציטוט: שימוש בפרמטר authors (link) - ^ Aronow WS (באוגוסט 2008). "Hypertension and the older diabetic". Clinics in Geriatric Medicine. pp. 489–501, vi–vii. doi:10.1016/j.cger.2008.03.001. PMID 18672184. נבדק ב-2009-06-20.
{{cite web}}: (עזרה) - ^ Gardner AW, Afaq A (2008). "MANAGEMENT OF LOWER EXTREMITY PERIPHERAL ARTERIAL DISEASE". Journal of Cardiopulmonary Rehabilitation and Prevention. pp. 349–57. doi:10.1097/HCR.0b013e31818c3b96. PMC 2743684. PMID 19008688. נבדק ב-2009-06-20.
{{cite web}}: תחזוקה - ציטוט: שימוש בפרמטר authors (link) - ^ Novo S, Lunetta M, Evola S, Novo G (בינואר 2009). "Role of ARBs in the blood hypertension therapy and prevention of cardiovascular events". Current Drug Targets. pp. 20–5. doi:10.2174/138945009787122897. PMID 19149532. אורכב מ-המקור ב-2020-03-28. נבדק ב-2009-06-20.
{{cite web}}: (עזרה)תחזוקה - ציטוט: שימוש בפרמטר authors (link) - ^ Craig WM (1939). "Surgical Treatment of Hypertension". Br Med J. 2 (4120): 1215–9. doi:10.1136/bmj.2.4120.1215. PMC 2178707. PMID 20782854.
{{cite journal}}: תחזוקה - ציטוט: שימוש בפרמטר authors (link) - ^ Sneader, Walter., Drug Discovery. A History., New York: Wiley., 2005, עמ' 371
- ^ K. H. Beyer, Chlorothiazide. How the thiazides evolved as antihypertensive therapy, Hypertension (Dallas, Tex.: 1979) 22, September 1993, עמ' 388–391
- ^ Special Public Health Awards: 1975 - Research Team of Merck Sharp and Dohme Research Laboratories: Karl H. Beyer, Jr. James M. Sprague, John E. Baer, Frederick C. Novello
- ^ Wright JM, Musini VM (2009). "First-line drugs for hypertension". Cochrane Database Syst Rev (3): CD001841. doi:10.1002/14651858.CD001841.pub2. PMID 19588327.
{{cite journal}}: תחזוקה - ציטוט: שימוש בפרמטר authors (link) - ^ Stason WB, Cannon PJ, Heinemann HO, Laragh JH (בנובמבר 1966). "Furosemide. A clinical evaluation of its diuretic action". Circulation. 34 (5): 910–20. doi:10.1161/01.cir.34.5.910. PMID 5332332.
{{cite journal}}: (עזרה)תחזוקה - ציטוט: שימוש בפרמטר authors (link) - ^ Black JW, Crowther AF, Shanks RG, Smith LH, Dornhorst AC (1964). "A new adrenergic betareceptor antagonist". The Lancet. 283 (7342): 1080–1081. doi:10.1016/S0140-6736(64)91275-9. PMID 14132613.
{{cite journal}}: תחזוקה - ציטוט: שימוש בפרמטר authors (link) - ^ Lv J, Perkovic V, Foote CV, Craig ME, Craig JC, Strippoli GF (2012). "Antihypertensive agents for preventing diabetic kidney disease". Cochrane Database Syst Rev. 12: CD004136. doi:10.1002/14651858.CD004136.pub3. PMID 23235603.
{{cite journal}}: תחזוקה - ציטוט: שימוש בפרמטר authors (link) - ^ "A brief history of the birth control pill - The pill timeline | Need to Know | PBS".
- ^ "Why the Oral Contraceptive Is Just Known as "The Pill"". www.smithsonianmag.com.
- ^ "BBC News | HEALTH | A short history of the pill".
- ^ "FDA's Approval of the First Oral Contraceptive, Enovid".
- ^ "BBC News - How the contraceptive pill changed Britain".
- ^ [1] [דרושה הבהרה]
- ^ "Brochure: The History of Drug Regulation in the United States".
- ^ שיר-רז, יפה (2009-12-22). "סטטינים לאנשים בריאים: מזיק יותר ממועיל?". Ynet. נבדק ב-2024-01-13.
- ^ Top 100 Drugs for 2013 by Sales - U.S. Pharmaceutical Statistics, web.archive.org, 2019-02-19 (באנגלית)
- ^ "Annual Impact Report". Tufts Center for the Study of Drug Development. נבדק ב-11 במאי 2014.
{{cite web}}: (עזרה) - ^ "How Many New Drugs Did FDA Approve Last Year?". pharmalot.com. אורכב מ-המקור ב-2011-05-08. נבדק ב-2017-07-01.
- ^ Perry, Susan (8 באוגוסט 2012). "Donald Light and Joel Lexchin in BMJ 2012;345:e4348, quoted in: Big Pharma's claim of an 'innovation crisis' is a myth, BMJ authors say". MinnPost. נבדק ב-8 באוגוסט 2012.
{{cite news}}: (עזרה) - ^ "Research". pharmalot.com. אורכב מ-המקור ב-2011-07-20. נבדק ב-2017-07-01.
- ^ "About PhRMA - PhRMA". אורכב מ-המקור ב-2013-01-04. נבדק ב-2017-07-01.
- ^ "Has the Pharmaceutical Blockbuster Model Gone Bust?". www.bain.com. נבדק ב-19 במאי 2016.
{{cite web}}: (עזרה) - ^ Closing the women’s health gap: A $1 trillion opportunity to improve lives and economies | McKinsey, www.mckinsey.com
- ^ "Association between industry funding and statistically significant pro-industry findings in medical and surgical randomized trials". 2004-02-17. נבדק ב-2007-05-24.
- ^ Moynihan, R. (29 במאי 2003). "Who pays for the pizza? Redefining the relationships between doctors and drug companies. 2: Disentanglement". BMJ. 326 (7400): 1193–1196. doi:10.1136/bmj.326.7400.1193. PMC 1126054. PMID 12775622.
{{cite journal}}: (עזרה) - ^ clinicaltrials.gov
- ^ "Clinical Trials Registration and Results Information Submission". Federal Register. 21 בספטמבר 2016. נבדק ב-2017-07-04.
{{cite web}}: (עזרה) - ^ אתר המחקרים הקליניים, באתר משרד הבריאות
- ^ Monique L. Anderson, Karen Chiswell, Eric D. Peterson, Asba Tasneem, Compliance with Results Reporting at ClinicalTrials.gov, New England Journal of Medicine 372, 2015-03-11, עמ' 1031–1039 doi: 10.1056/nejmsa1409364
- ^ Barnett, Antony (7 בדצמבר 2003). "Revealed: how drug firms 'hoodwink' medical journals". the Guardian. נבדק ב-19 במאי 2016.
{{cite news}}: (עזרה) - ^ Buchkowsky, SS; Jewesson, PJ (אפר' 2004). "Industry sponsorship and authorship of clinical trials over 20 years". Ann Pharmacother. 38 (4): 579–85. doi:10.1345/aph.1D267. PMID 14982982.
{{cite journal}}: (עזרה) - ^ Perlis, Roy H.; Perlis, Clifford S.; Wu, Yelena; Hwang, Cindy; Joseph, Megan; Nierenberg, Andrew A. (באוקטובר 2005). "Industry sponsorship and financial conflict of interest in the reporting of clinical trials in psychiatry". Am J Psychiatry. 162 (10): 1957–60. doi:10.1176/appi.ajp.162.10.1957. PMID 16199844.
{{cite journal}}: (עזרה) - ^ Tungaraza, T; Poole, R (יולי 2007). "Influence of drug company authorship and sponsorship on drug trial outcomes". Br J Psychiatry. 191 (1): 82–3. doi:10.1192/bjp.bp.106.024547. PMID 17602130.
{{cite journal}}: (עזרה) - ^ Kaufman, Marc (2005-05-06). "Merck CEO Resigns as Drug Probe Continues". Drug Discovery & Development. וושינגטון פוסט. נבדק ב-2007-05-23.
- ^ "Drug Lobby Second to None: How the pharmaceutical industry gets its way in Washington". publicintegrity.org. 2005-07-07. אורכב מ-המקור ב-2007-06-09. נבדק ב-2007-05-23.
- ^ Moynihan, R. (29 במאי 2003). "Drug company sponsorship of education could be replaced at a fraction of its cost". BMJ. 326 (7400): 1163–1163. doi:10.1136/bmj.326.7400.1163. PMC 1126044. PMID 12775595.
{{cite journal}}: (עזרה) - ^ "Dr. No Free Lunch". Mother Jones. נבדק ב-19 במאי 2016.
{{cite web}}: (עזרה) - ^ Moynihan, Ray; Cassels, Alan (2005). Selling sickness : how the drug companies are turning us all into patients. Crows Nest, N.S.W.: Allen & Unwin. ISBN 1-74114-579-1.
- ^ "A Collection of Articles on Disease Mongering". Public Library of Science. אורכב מ-המקור ב-2007-06-07. נבדק ב-2007-05-23.
- ^ "Pharmaceutical Market Research, Trends And Analysis Reports". www.literated.com. אורכב מ-המקור ב-2016-01-19. נבדק ב-17 בינואר 2016.
{{cite web}}: (עזרה) - ^ "UK parliamentarians put the pharma industry under the spotlight". European Public Health Alliance. נבדק ב-2007-05-23.
- ^ Ornstein, Tracy Weber, Charles (11 במרץ 2013). "Dollars for Docs Mints a Millionaire". ProPublica. נבדק ב-19 במאי 2016.
{{cite news}}: (עזרה) - ^ "Revisiting the Commercial–Academic Interface — NEJM" (PDF). 2008-03-03. נבדק ב-2008-06-02.
- ^ "Reconnecting the Dots — Reinterpreting Industry–Physician Relations — NEJM".
- ^
 הדס זיו, תרופות על המשקל - המוסר הבעייתי של חברות התרופות, באתר הארץ, 10 ביוני 2013
הדס זיו, תרופות על המשקל - המוסר הבעייתי של חברות התרופות, באתר הארץ, 10 ביוני 2013
- ^ דני פילק, תופעות הלוואי של תעשיית התרופות, באתר "העוקץ", 30 במאי 2013
- ^ חשש: חקיקה בהודו תמנע תרופות ממדינות עניות, באתר הארץ, 23 במרץ 2005
- ^
 ניו יורק טיימס, הודו רוצה לתת תרופות מוזלות לעניים - בתעשיית התרופות העולמית מודאגים, באתר TheMarker, 30 בדצמבר 2013
ניו יורק טיימס, הודו רוצה לתת תרופות מוזלות לעניים - בתעשיית התרופות העולמית מודאגים, באתר TheMarker, 30 בדצמבר 2013
