Acido cloroso: differenze tra le versioni
m r2.6.4) (Bot: Aggiungo: cs:Kyselina chloritá |
NOME IUPAC |
||
| (22 versioni intermedie di 17 utenti non mostrate) | |||
| Riga 1: | Riga 1: | ||
{{F|acidi|agosto 2013}} |
|||
{{Composto chimico |
{{Composto chimico |
||
| |
|nome_IUPAC = acido diossoclorico (III) |
||
|nomi_alternativi = acido cloroso |
|nomi_alternativi = acido cloroso |
||
|immagine1_nome = Chlorous-acid-2D.png |
|immagine1_nome = Chlorous-acid-2D.png |
||
|immagine1_dimensioni = |
|immagine1_dimensioni = |
||
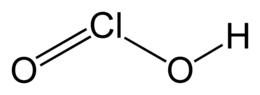
|immagine1_descrizione = struttura dell'acido cloroso |
|immagine1_descrizione = struttura dell'acido cloroso |
||
|immagine2_nome = Chlorous-acid-3D-vdW.png |
|immagine2_nome = Chlorous-acid-3D-vdW.png |
||
|immagine2_dimensioni = |
|immagine2_dimensioni = |
||
|immagine2_descrizione = modello tridimensionale dell'acido cloroso |
|immagine2_descrizione = modello tridimensionale dell'acido cloroso |
||
|titolo_caratteristiche_generali = --- |
|titolo_caratteristiche_generali = --- |
||
|formula = HClO<sub>2</sub> |
|formula = HClO<sub>2</sub> |
||
|peso_formula = 68.46 |
|peso_formula = 68.46 |
||
|aspetto = liquido incolore |
|aspetto = liquido incolore |
||
|Ka = {{ |
|Ka = {{M|1,1|e=-2}} |
||
|Ka_temperatura = |
|Ka_temperatura = 298 |
||
|titolo_indicazioni_sicurezza = --- |
|titolo_indicazioni_sicurezza = --- |
||
|simbolo1=comburente |
|simbolo1 = comburente |
||
|simbolo2= |
|simbolo2 = |
||
|simbolo3= |
|simbolo3 = |
||
|simbolo4= |
|simbolo4 = |
||
|simbolo5= |
|simbolo5 = |
||
|frasiR= |
|frasiR = |
||
|frasiS= |
|frasiS = |
||
}} |
}} |
||
L''''acido cloroso''' è un [[Ossiacidi|ossiacido]] del [[cloro]] trivalente, Cl(III), avente formula HClO<sub>2</sub>. Non è noto allo stato puro ma, come accade anche per HClO3 e HClO, solo nelle sue soluzioni acquose, dove si comporta da [[acido debole]]. Ha forti proprietà [[Ossidante|ossidanti]], che condivide con i suoi [[Sale|sali]], i [[Clorito|cloriti]]. Questi ultimi sono utilizzati nella produzione industriale del [[diossido di cloro]]. |
|||
L''''acido cloroso''' è un composto del cloro (III) di formula HClO<sub>2</sub>. |
|||
È un [[acido]] debole. La sostanza pura è instabile, come molti altri acidi del cloro, ma i [[sali]] da essa derivati, chiamati [[cloriti]], sono stabili. Questi ultimi sono utilizzati nella produzione industriale del [[diossido di cloro]]. |
|||
Tende a dismutare secondo la seguente reazione, e questo lo rende un prodotto non disponibile commercialmente: |
Tende a dismutare secondo la seguente reazione, e questo lo rende un prodotto non disponibile commercialmente: |
||
:<chem>2HClO2 -> ClO3- + HClO + H+</chem> |
|||
== Sintesi == |
== Sintesi == |
||
L'acido cloroso può essere sintetizzato dalla reazione tra il [[clorito di bario]] e [[acido solforico]] diluito: |
L'acido cloroso può essere sintetizzato dalla reazione tra il [[clorito di bario]] e [[acido solforico]] diluito: |
||
:<chem>Ba(ClO2)2 + H2SO4 -> BaSO4 + 2HClO2</chem> |
|||
: Ba(ClO<sub>2</sub>)<sub>2</sub> + H<sub>2</sub>SO<sub>4</sub> → BaSO<sub>4</sub> + 2HClO<sub>2</sub> |
|||
== Applicazioni == |
== Applicazioni == |
||
I sali di questo acido vengono sintetizzati dal [[diossido di cloro]], e non direttamente dall'acido. La sua pericolosità nello stoccaggio e la facilità di decomposizione fa sì che l'acido cloroso non abbia applicazioni al di fuori del laboratorio. |
I sali di questo acido vengono sintetizzati dal [[diossido di cloro]], e non direttamente dall'acido. La sua pericolosità nello stoccaggio e la facilità di decomposizione fa sì che l'acido cloroso non abbia applicazioni al di fuori del laboratorio. |
||
== Altri progetti == |
|||
{{interprogetto}} |
|||
{{Acidi inorganici}} |
{{Acidi inorganici}} |
||
| Riga 50: | Riga 46: | ||
[[Categoria:Ossiacidi|Cloroso, acido]] |
[[Categoria:Ossiacidi|Cloroso, acido]] |
||
[[cs:Kyselina chloritá]] |
|||
[[de:Chlorige Säure]] |
|||
[[en:Chlorous acid]] |
|||
[[es:Ácido cloroso]] |
|||
[[ja:亜塩素酸]] |
|||
[[ko:아염소산]] |
|||
[[nl:Waterstofchloriet]] |
|||
[[no:Klorsyrling]] |
|||
[[pl:Kwas chlorowy(III)]] |
|||
[[pt:Ácido cloroso]] |
|||
[[ru:Хлористая кислота]] |
|||
[[simple:Chlorous acid]] |
|||
[[sr:Хлораста киселина]] |
|||
[[sv:Klorsyrlighet]] |
|||
[[uk:Хлоритна кислота]] |
|||
[[vi:Axít clorơ]] |
|||
[[zh:亚氯酸]] |
|||
Versione attuale delle 07:13, 8 nov 2022
| Acido cloroso | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| acido diossoclorico (III) | |
| Nomi alternativi | |
| acido cloroso | |
| Caratteristiche generali | |
| Formula bruta o molecolare | HClO2 |
| Peso formula (u) | 68.46 |
| Aspetto | liquido incolore |
| Numero CAS | |
| PubChem | 24453 |
| SMILES | OCl=O |
| Proprietà chimico-fisiche | |
| Costante di dissociazione acida a 298 K | 1,1×10−2 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
L'acido cloroso è un ossiacido del cloro trivalente, Cl(III), avente formula HClO2. Non è noto allo stato puro ma, come accade anche per HClO3 e HClO, solo nelle sue soluzioni acquose, dove si comporta da acido debole. Ha forti proprietà ossidanti, che condivide con i suoi sali, i cloriti. Questi ultimi sono utilizzati nella produzione industriale del diossido di cloro.
Tende a dismutare secondo la seguente reazione, e questo lo rende un prodotto non disponibile commercialmente:
Sintesi
[modifica | modifica wikitesto]L'acido cloroso può essere sintetizzato dalla reazione tra il clorito di bario e acido solforico diluito:
Applicazioni
[modifica | modifica wikitesto]I sali di questo acido vengono sintetizzati dal diossido di cloro, e non direttamente dall'acido. La sua pericolosità nello stoccaggio e la facilità di decomposizione fa sì che l'acido cloroso non abbia applicazioni al di fuori del laboratorio.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su acido cloroso
Wikimedia Commons contiene immagini o altri file su acido cloroso

