Piridossalfosfato: differenze tra le versioni
Nessun oggetto della modifica |
Funzionalità collegamenti suggeriti: 3 collegamenti inseriti. |
||
| (35 versioni intermedie di 30 utenti non mostrate) | |||
| Riga 3: | Riga 3: | ||
|immagine1_dimensioni = 250px |
|immagine1_dimensioni = 250px |
||
|immagine1_descrizione = formula di struttura |
|immagine1_descrizione = formula di struttura |
||
|immagine2_nome = PLP |
|immagine2_nome = PLP 3d.gif |
||
|immagine2_dimensioni = 250px |
|immagine2_dimensioni = 250px |
||
|immagine2_descrizione = |
|immagine2_descrizione = modello molecolare |
||
|immagine3_nome = PLP 3d.gif |
|||
|immagine3_dimensioni = 250px |
|||
|immagine3_descrizione = modello molecolare |
|||
|nome_IUPAC = Piridossal-5'-Fosfato |
|nome_IUPAC = Piridossal-5'-Fosfato |
||
|nomi_alternativi = |
|nomi_alternativi = Vitamina B6<br/>PALP |
||
Vitamina B6; |
|||
<br/>PALP; |
|||
|titolo_caratteristiche_generali = --- |
|titolo_caratteristiche_generali = --- |
||
|formula = C<sub>8</sub>H<sub>10</sub>NO<sub>3</sub>PO<sub>3</sub> |
|formula = C<sub>8</sub>H<sub>10</sub>NO<sub>3</sub>PO<sub>3</sub> |
||
|massa_molecolare = 247,144 |
|massa_molecolare = 247,144 |
||
|aspetto = polvere giallo pallido |
|aspetto = polvere giallo pallido |
||
|numero_CAS = 54-47-7 |
|||
|titolo_proprietà_chimico-fisiche = --- |
|titolo_proprietà_chimico-fisiche = --- |
||
|densità_condensato = |
|densità_condensato = |
||
|solubilità_acqua = 5 g/l a 25 °C |
|solubilità_acqua = 5 g/l a 25 °C |
||
|temperatura_di_fusione = |
|temperatura_di_fusione = 140-143 °C (413-416 K) |
||
|entalpia_di_fusione = |
|entalpia_di_fusione = |
||
|entropia_di_fusione = |
|entropia_di_fusione = |
||
| Riga 39: | Riga 33: | ||
}} |
}} |
||
Il '''piridossalfosfato''' o secondo le direttive [[IUPAC]] '''piridossal-5'-fosfato''' (o '''piridossal fosfato''' o '''PL-5'P''' o '''PLP''' o '''PALP''') è la forma attiva della [[Vitamina B6]] un |
Il '''piridossalfosfato''' o secondo le direttive [[Unione internazionale di chimica pura e applicata|IUPAC]] '''piridossal-5'-fosfato''' (o '''piridossal fosfato''' o '''PL-5'P''' o '''PLP''' o '''PALP''') è la forma attiva della [[Vitamina B6]] ed un coenzima di [[enzimi]] [[transferasi]] come le [[transaminasi]]. |
||
== Struttura == |
== Struttura == |
||
La molecola è composta da un anello [[piridina|piridinico]] con 4 sostituenti: un gruppo [[gruppo funzionale|aldeidico]] (carbonio 4), un [[gruppo funzionale|metile]] (carbonio 2), un [[gruppo funzionale|idrossimetile]] fosfato (carbonio 5), un [[Gruppo funzionale|ossidrile]] (carbonio 3). |
La molecola è composta da un anello [[piridina|piridinico]] con 4 sostituenti: un gruppo [[gruppo funzionale|aldeidico]] (carbonio 4), un [[gruppo funzionale|metile]] (carbonio 2), un [[gruppo funzionale|idrossimetile]] fosfato (carbonio 5), un [[Gruppo funzionale|ossidrile]] (carbonio 3). |
||
Quest'ultimo ha delle particolarità ed insieme all'azoto e al gruppo aldeidico sono responsabili dell'attività [[catalisi|catalitica]] del cofattore. Il |
Quest'ultimo ha delle particolarità ed insieme all'azoto e al gruppo aldeidico sono responsabili dell'attività [[catalisi|catalitica]] del cofattore. Il [[Fosfato organico|gruppo fosfato]] invece, nella maggior parte dei casi, ha funzione di appiglio per mezzo di cui la proteina lega la molecola; un'eccezione è rappresentata dall'enzima [[Glicogeno fosforilasi]] in cui è il fosfato ad esplicare funzione catalitica. |
||
I 5 carboni dell'anello, l'azoto, il carbonio e l'ossigeno del gruppo aldeidico (-CHO) sono |
I 5 carboni dell'anello, l'azoto, il carbonio e l'ossigeno del gruppo aldeidico (-CHO) sono [[ibridizzazione|ibridati]] ''sp<sup>2</sup>''. La prima conseguenza di questo è che gli atomi succitati giacciono sullo stesso piano; la seconda conseguenza è che ogni atomo di questi ha un orbitale p con un [[elettrone spaiato]] perpendicolare al piano della molecola, che viene messo in comune con gli altri atomi, creando così un sistema risonante su 8 atomi (responsabile del colore giallo intenso delle soluzioni che contengono la vitamina). |
||
Essendo molecola planare è possibile individuare due facce (vedi figura 2 a metà pagina), mantenendo il |
Essendo molecola planare è possibile individuare due facce (vedi figura 2 a metà pagina), mantenendo il gruppo fosfato verso l'osservatore ed il C4' verso destra; la faccia superiore viene indicata come "si" e quella inferiore come "re". |
||
==Ruolo biologico== |
== Ruolo biologico == |
||
{{vedi anche|Catalisi enzimatica covalente}} |
{{vedi anche|Catalisi enzimatica covalente}} |
||
Il piridossalfosfato è un [[cofattore (biologia)|cofattore]] di [[enzimi]] [[transferasi]] come le [[transaminasi]]. |
Il piridossalfosfato è un [[cofattore (biologia)|cofattore]] di [[enzimi]] [[transferasi]] come le [[transaminasi]]. |
||
Funziona con catalisi covalente elettrofila per formazione di una base di |
Funziona con catalisi covalente elettrofila per formazione di una base di Schiff. Il [[gruppo carbonilico]] del piridossalfosfato si lega ad un gruppo ammino-terminale formando un'[[immina]] (base di Schiff). |
||
== Proprietà == |
== Proprietà == |
||
L'effetto della risonanza unita all'[[elettronegatività]] dell'[[azoto]] e dell'[[ossigeno]] al |
L'effetto della risonanza unita all'[[elettronegatività]] dell'[[azoto]] e dell'[[ossigeno]] al C3 fanno del piridossalfosfato una trappola per elettroni di media capacità; inoltre a [[pH]] vicino a 7 l'azoto piridinico viene protonato conferendo alla molecola una carica positiva delocalizzata, che accresce questa capacità. |
||
Pur essendo questa proprietà del PLP importante, la sua peculiare struttura elettronica gli conferisce un'incredibile capacità |
Pur essendo questa proprietà del PLP importante, la sua peculiare struttura elettronica gli conferisce un'incredibile capacità catalitica che si evidenzia nelle reazioni con gli [[amminoacidi]]: unendo ad una [[soluzione (chimica)|soluzione]] di un amminoacido una piccola quantità di una soluzione di questa vitamina e analizzando successivamente la composizione, si possono ritrovare il cofattore intatto, il cofattore modificato e una varietà di [[Molecola|molecole]] derivate dall'amminoacido di partenza; si conclude che questo cofattore possiede intrinsecamente attività catalitica per varie reazioni ([[decarbossilazione]], [[deaminazione]], [[racemizzazione]] etc.) e che la sua capacità ed aspecificità devono essere modulate per svolgere una funzione utile e non recare danni alla cellula. Si può trovare nelle transaminasi, enzimi che trasportano un gruppo NH<sub>2</sub> da un amminoacido su un α-chetoacido. Oppure si può trovare nelle amminoacididecarbossilasi, enzimi che tolgono il gruppo [[acidi carbossilici|-COOH]] degli amminoacidi, o ancora nelle deidratasi, enzimi che tolgono acqua da certi amminoacidi. |
||
Vediamo come siano spiegabili queste trasformazioni adottando una versione semplificata della [[Orbitale|teoria degli orbitali molecolari]]. |
Vediamo come siano spiegabili queste trasformazioni adottando una versione semplificata della [[Orbitale molecolare|teoria degli orbitali molecolari]]. |
||
All'atto del legame del piridossalfosfato con l'azoto [[gruppo funzionale|amminico]] di un amminoacido tramite il suo gruppo aldeidico, si forma una [[Base di Schiff]] o Aldimina. Essendo divenuto anche quest'azoto |
All'atto del legame del piridossalfosfato con l'azoto [[gruppo funzionale|amminico]] di un amminoacido tramite il suo gruppo aldeidico, si forma una [[Base di Schiff]] o Aldimina. Essendo divenuto anche quest'azoto ibridato sp<sup>2</sup> il carbonio α si trova a contatto con un esteso [[Risonanza (chimica)|sistema risonante]]. Gli elettroni che si trovano nell'orbitale di legame di tipo σ che si dispone su un piano perpendicolare al piano della molecola (fig. 3) vengono attirati nel sistema e delocalizzati, cosa che comporta la scissione eterolitica del legame con il [[sostituente]], formando un intermedio detto '''chinonoide''' instabile in cui anche il carbonio α è ibridato sp<sup>2</sup>. Viene quindi eliminato un sostituente con una carica negativa in meno, da -H si libera H<sup>+</sup> da -COO<sup>-</sup> si libera CO<sub>2</sub> o ancora R (vedi [[amminoacidi]]). Essendo instabile il composto tende a stabilizzarsi in vari possibili modi: addizionando al carbonio α un sostituente diverso (reazione per α-sintasi, decarbossilasi, racemasi, etc.), addizionando un H+ al C4' scindendo il legame N-C<sub>α</sub>(aminotrasferasi), sottraendo sostituenti al Cβ o al Cγ ai quali in seguito si possono addizionare gruppi diversi (β o γ sintasi e β eliminazione). La maggior parte delle reazioni elencate è indicativa di un gruppo di reazioni specifiche che dipendono dal substrato e dal gruppo addizionato. Enzimaticamente il contorno proteico modula molte proprietà del cofattore (pK, stabilità di un intermedio piuttosto che un altro) ed indirizza la reazione verso uno o (se non possibile) pochi prodotti specifici. |
||
<gallery> |
<gallery> |
||
| Riga 71: | Riga 65: | ||
== Sintesi == |
== Sintesi == |
||
=== Biologica === |
=== Biologica === |
||
| ⚫ | |||
=== Industriale === |
=== Industriale === |
||
{{...|chimica}} |
|||
==Bibliografia== |
== Bibliografia == |
||
*{{cita libro|David L.|Nelson|I Principi di Biochimica di Lehninger|febbraio 2002|[[Zanichelli]]|Bologna|coautori=Michael M. Cox|ed=3}} |
* {{cita libro|David L.|Nelson|I Principi di Biochimica di Lehninger|febbraio 2002|[[Nicola Zanichelli Editore|Zanichelli]]|Bologna|coautori=Michael M. Cox|ed=3|isbn=88-08-09035-3}} |
||
== |
== Altri progetti == |
||
{{interprogetto}} |
|||
{{Vitamine}} |
|||
| ⚫ | |||
{{portale|biologia|chimica}} |
|||
| ⚫ | |||
[[Categoria:Coenzimi]] |
[[Categoria:Coenzimi]] |
||
| ⚫ | |||
{{censbio}} <!--Template di servizio del Progetto Bio - Si prega di non cancellare!--> |
|||
[[de:Pyridoxalphosphat]] |
|||
[[en:Pyridoxal phosphate]] |
|||
[[fr:Phosphate de pyridoxal]] |
|||
[[ja:ピリドキサールリン酸]] |
|||
[[pl:Fosforan pirydoksalu]] |
|||
Versione attuale delle 13:57, 14 mar 2024
| Piridossalfosfato | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Piridossal-5'-Fosfato | |
| Nomi alternativi | |
| Vitamina B6 PALP | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C8H10NO3PO3 |
| Massa molecolare (u) | 247,144 |
| Aspetto | polvere giallo pallido |
| Numero CAS | |
| Numero EINECS | 200-208-3 |
| PubChem | 1051 |
| DrugBank | DBDB00114 |
| SMILES | CC1=NC=C(C(=C1O)C=O)COP(=O)(O)O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | |
| Solubilità in acqua | 5 g/l a 25 °C |
| Temperatura di fusione | 140-143 °C (413-416 K) |
| ΔfusH0 (kJ·mol−1) | |
| ΔfusS0 (J·K−1mol−1) | |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | |
| S0m(J·K−1mol−1) | |
| C0p,m(J·K−1mol−1) | |
| Indicazioni di sicurezza | |
| Frasi R | - |
| Frasi S | 24/25 |
Il piridossalfosfato o secondo le direttive IUPAC piridossal-5'-fosfato (o piridossal fosfato o PL-5'P o PLP o PALP) è la forma attiva della Vitamina B6 ed un coenzima di enzimi transferasi come le transaminasi.
Struttura
[modifica | modifica wikitesto]La molecola è composta da un anello piridinico con 4 sostituenti: un gruppo aldeidico (carbonio 4), un metile (carbonio 2), un idrossimetile fosfato (carbonio 5), un ossidrile (carbonio 3). Quest'ultimo ha delle particolarità ed insieme all'azoto e al gruppo aldeidico sono responsabili dell'attività catalitica del cofattore. Il gruppo fosfato invece, nella maggior parte dei casi, ha funzione di appiglio per mezzo di cui la proteina lega la molecola; un'eccezione è rappresentata dall'enzima Glicogeno fosforilasi in cui è il fosfato ad esplicare funzione catalitica.
I 5 carboni dell'anello, l'azoto, il carbonio e l'ossigeno del gruppo aldeidico (-CHO) sono ibridati sp2. La prima conseguenza di questo è che gli atomi succitati giacciono sullo stesso piano; la seconda conseguenza è che ogni atomo di questi ha un orbitale p con un elettrone spaiato perpendicolare al piano della molecola, che viene messo in comune con gli altri atomi, creando così un sistema risonante su 8 atomi (responsabile del colore giallo intenso delle soluzioni che contengono la vitamina).
Essendo molecola planare è possibile individuare due facce (vedi figura 2 a metà pagina), mantenendo il gruppo fosfato verso l'osservatore ed il C4' verso destra; la faccia superiore viene indicata come "si" e quella inferiore come "re".
Ruolo biologico
[modifica | modifica wikitesto]Il piridossalfosfato è un cofattore di enzimi transferasi come le transaminasi.
Funziona con catalisi covalente elettrofila per formazione di una base di Schiff. Il gruppo carbonilico del piridossalfosfato si lega ad un gruppo ammino-terminale formando un'immina (base di Schiff).
Proprietà
[modifica | modifica wikitesto]L'effetto della risonanza unita all'elettronegatività dell'azoto e dell'ossigeno al C3 fanno del piridossalfosfato una trappola per elettroni di media capacità; inoltre a pH vicino a 7 l'azoto piridinico viene protonato conferendo alla molecola una carica positiva delocalizzata, che accresce questa capacità.
Pur essendo questa proprietà del PLP importante, la sua peculiare struttura elettronica gli conferisce un'incredibile capacità catalitica che si evidenzia nelle reazioni con gli amminoacidi: unendo ad una soluzione di un amminoacido una piccola quantità di una soluzione di questa vitamina e analizzando successivamente la composizione, si possono ritrovare il cofattore intatto, il cofattore modificato e una varietà di molecole derivate dall'amminoacido di partenza; si conclude che questo cofattore possiede intrinsecamente attività catalitica per varie reazioni (decarbossilazione, deaminazione, racemizzazione etc.) e che la sua capacità ed aspecificità devono essere modulate per svolgere una funzione utile e non recare danni alla cellula. Si può trovare nelle transaminasi, enzimi che trasportano un gruppo NH2 da un amminoacido su un α-chetoacido. Oppure si può trovare nelle amminoacididecarbossilasi, enzimi che tolgono il gruppo -COOH degli amminoacidi, o ancora nelle deidratasi, enzimi che tolgono acqua da certi amminoacidi.
Vediamo come siano spiegabili queste trasformazioni adottando una versione semplificata della teoria degli orbitali molecolari.
All'atto del legame del piridossalfosfato con l'azoto amminico di un amminoacido tramite il suo gruppo aldeidico, si forma una Base di Schiff o Aldimina. Essendo divenuto anche quest'azoto ibridato sp2 il carbonio α si trova a contatto con un esteso sistema risonante. Gli elettroni che si trovano nell'orbitale di legame di tipo σ che si dispone su un piano perpendicolare al piano della molecola (fig. 3) vengono attirati nel sistema e delocalizzati, cosa che comporta la scissione eterolitica del legame con il sostituente, formando un intermedio detto chinonoide instabile in cui anche il carbonio α è ibridato sp2. Viene quindi eliminato un sostituente con una carica negativa in meno, da -H si libera H+ da -COO- si libera CO2 o ancora R (vedi amminoacidi). Essendo instabile il composto tende a stabilizzarsi in vari possibili modi: addizionando al carbonio α un sostituente diverso (reazione per α-sintasi, decarbossilasi, racemasi, etc.), addizionando un H+ al C4' scindendo il legame N-Cα(aminotrasferasi), sottraendo sostituenti al Cβ o al Cγ ai quali in seguito si possono addizionare gruppi diversi (β o γ sintasi e β eliminazione). La maggior parte delle reazioni elencate è indicativa di un gruppo di reazioni specifiche che dipendono dal substrato e dal gruppo addizionato. Enzimaticamente il contorno proteico modula molte proprietà del cofattore (pK, stabilità di un intermedio piuttosto che un altro) ed indirizza la reazione verso uno o (se non possibile) pochi prodotti specifici.
-
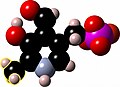
(fig 1) Vista frontale della molecola rappresentata in un modello spaziale
-
(fig 2) Vista laterale della molecola rappresentata in un modello a sfere e bastoncini (doppi legami non rappresentati)
Sintesi
[modifica | modifica wikitesto]Biologica
[modifica | modifica wikitesto]Industriale
[modifica | modifica wikitesto]Bibliografia
[modifica | modifica wikitesto]- David L. Nelson, Michael M. Cox, I Principi di Biochimica di Lehninger, 3ª ed., Bologna, Zanichelli, febbraio 2002, ISBN 88-08-09035-3.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Piridossalfosfato
Wikimedia Commons contiene immagini o altri file su Piridossalfosfato