「食作用」の版間の差分
編集の要約なし |
出典の著者が表示されない不具合を修正。原因は cite journal でパラメータ名が異なるのを直し忘れ:vauthors → authors |
||
| (10人の利用者による、間の13版が非表示) | |||
| 1行目: | 1行目: | ||
[[File:0309 Phagocytosis.png|alt=|thumb|323x323px|食作用の概要を示す。食作用は、細胞が細胞膜を使って細胞外物質を包み込む能動的な輸送(エンドサイトーシス)の一形態である。食作用では、比較的選択性が低く、大きな粒子を取り込む。]] |
|||
{{出典の明記|date=2013年2月}} |
|||
[[File:Phagocytosis and Exocytosis.svg|thumb|300px|(左) 食作用(ファゴサイトーシス)と (右) 開口分泌(エキソサイトーシス)]] |
|||
'''食作用'''(しょくさよう、{{lang-en-short|phagocytosis}})とは、[[単球]]や[[マクロファージ]]、[[好中球]]等の細胞が体内(組織内、血液内など)にある程度大きなサイズの異物([[細菌]]、[[ウイルス]]、[[寄生虫]])や異常代謝物([[ヘモジデリン]]など)を[[エンドサイトーシス]]によって細胞内へと取り込み、分解する機構のこと。 |
|||
'''食作用'''(しょくさよう、{{Lang-en-short|phagocytosis}}{{efn| |
|||
食作用は異物に対する免疫機構の最前線であり、[[自然免疫]]に分類される。 |
|||
{{etymology|grc|{{lang|grc|φαγεῖν}} ''({{lang|grc-Latn|phagein}})'' |摂食する||{{lang|grc|κύτος}}, ''({{lang|grc-Latn|kytos}})'' |細胞|}} |
|||
}}、'''ファゴサイトーシス''')または'''貪食'''(どんしょく)は、[[細胞]]がその[[細胞膜]]を使って大きな粒子(0.5 μm以上)を取り込み、[[ファゴソーム]](食胞)と呼ばれる内部区画を形成するプロセスである。これは[[エンドサイトーシス]]の一種である。食作用を行う細胞を[[食細胞]](ファゴサイト)と呼ぶ。 [[File:Process of Phagocytosis.svg|thumb|食細胞による病原体の飲み込み]] |
|||
[[多細胞生物]]の[[免疫系]]では、食作用は[[病原体]]や細胞の残骸を異物として除去するための主要な機構である。摂取された物質は、ファゴソーム内で消化される。[[細菌]]、[[ウイルス]]、死んだ組織細胞、[[寄生虫]]、異常な[[代謝]]産物、小さな鉱物粒子などが、貪食される可能性のある物質の例である。[[原生動物]]の中には、食作用を利用して栄養素を摂取するものがある。 |
|||
== 歴史 == |
|||
| ⚫ | |||
食作用は、カナダの医師[[ウイリアム・オスラー|ウィリアム・オスラー]]が最初に指摘し(1876年)<ref>{{cite journal|title=The Osler slide, a demonstration of phagocytosis from 1876: Reports of phagocytosis before Metchnikoff's 1880 paper | doi=10.1016/j.cellimm.2006.05.008|pmid=16876776 |volume=240|issue=1 |pages=1–4|journal=Cellular Immunology|year=2006 | last1 = Ambrose | first1 = Charles T.}}</ref>、その後、[[イリヤ・メチニコフ]]が研究し命名した(1880年と1883年)<ref name=":0">{{Cite journal|last=Gordon|first=Siamon|date=March 2016|title=Phagocytosis: An Immunobiologic Process|journal=Immunity|volume=44|issue=3|pages=463–475|doi=10.1016/j.immuni.2016.02.026|pmid=26982354|doi-access=free}}</ref>。 |
|||
| ⚫ | |||
== 免疫系での食作用 == |
|||
| ⚫ | |||
[[Image:Neutrophil with anthrax copy.jpg|right|thumb|[[炭疽菌]] (オレンジ色、左) を貪食する食細胞 (黄色、右) の[[走査型電子顕微鏡]]写真]] |
|||
{{main|食細胞}} |
|||
食作用は、[[自然免疫]]防御の主要な機構の一つである。これは、[[感染]]に応答する最初のプロセスの1つであり、[[適応免疫]]応答の開始ブランチの1つでもある。ほとんどの細胞は食作用を行うことができ、一部の細胞は主な機能の一部として食作用を実行する。これらは「プロフェッショナルの食細胞」(''professional phagocytes'')と呼ばれている。食作用は進化という観点から見ると古く、[[無脊椎動物]]にも存在している<ref name=":1">{{Cite book|title=Janeway's immunobiology|last=M.)|first=Murphy, Kenneth (Kenneth|date=2012|publisher=Garland Science|others=Travers, Paul, 1956-, Walport, Mark., Janeway, Charles.|isbn=9780815342434|edition= 8th|location=New York|oclc=733935898}}</ref>。 |
|||
=== プロフェッショナルの食細胞 === |
|||
[[File:Нейтрофил крови человека фагоцитирует бактерию.webm|thumb|細菌を貪食するヒト血液中の好中球の光学顕微鏡ビデオシーケンス]] |
|||
[[好中球]]、[[マクロファージ]]、[[単球]]、[[樹状細胞]]、[[破骨細胞]]、および[[好酸球]]は、プロフェッショナルの食細胞として分類される<ref name=":0" />。最初の3つは、ほとんどの感染症に対する[[免疫応答]]に最も大きな役割を果たす<ref name=":1" />。 |
|||
好中球の役割は、血流をパトロールし、感染の場合にのみ大変な数で組織に急速に移動することである<ref name=":1" />。そこでは食作用による直接的な殺傷効果がある。摂取後の好中球は、病原体を細胞内で効率的に殺滅する。好中球は、主にFcγ受容体と補体受容体1および3を介して貪食する。好中球の殺滅効果は、あらかじめ形成された顆粒に存在する分子のたくさんのレパートリーによるものである。この顆粒に用意されている酵素や他の分子は、{{仮リンク|コラゲナーゼ|en|Collagenase}}、[[ゼラチナーゼ]]、または[[セリンプロテアーゼ]]などのプロテアーゼ、[[ミエロペルオキシダーゼ]]、[[ラクトフェリン]]、および抗生物質タンパク質である。これらのファゴソームへの脱顆粒は、高い[[活性酸素種]]の産生({{仮リンク|呼吸性バースト|en|Respiratory burst}})を伴い、非常に高い殺菌力がある<ref name=":2">{{Cite journal|last1=Witko-Sarsat|first1=Véronique|last2=Rieu|first2=Philippe|last3=Descamps-Latscha|first3=Béatrice|last4=Lesavre|first4=Philippe|last5=Halbwachs-Mecarelli|first5=Lise|date=May 2000|title=Neutrophils: Molecules, Functions and Pathophysiological Aspects|journal=Laboratory Investigation|volume=80|issue=5|pages=617–653|doi=10.1038/labinvest.3780067|pmid=10830774|issn=0023-6837|doi-access=free}}</ref>。 |
|||
単球やそれが成熟したマクロファージは、血液循環から離れて組織内を移動する。そこでは、これらは常在細胞となり、静止した防壁を形成する<ref name=":1" />。マクロファージは、{{仮リンク|マンノース受容体|en|Mannose receptor}}、{{仮リンク|スカベンジャー受容体|en|Scavenger receptor (immunology)}}、[[Fc受容体|Fcγ受容体]]、{{仮リンク|補体受容体|en|Complement receptor}}1、3、4によって食作用を開始する。マクロファージは長寿命で、新たなリソソームを形成することで食作用を継続することができる<ref name=":1" /><ref name=":3">{{Cite journal|last1=Aderem|first1=Alan|last2=Underhill|first2=David M.|date=April 1999|journal=Annual Review of Immunology|volume=17|issue=1|pages=593–623|doi=10.1146/annurev.immunol.17.1.593|pmid=10358769|issn=0732-0582|title=Mechanisms of Phagocytosis in Macrophages}}</ref>。 |
|||
また、樹状細胞も組織内に存在し、食作用によって病原体を摂取する。それらの役割は、微生物を殺したり除去することではなく、適応免疫系の細胞に[[抗原提示]]するために微生物を分解することである<ref name=":1" />。 |
|||
=== 食作用を誘発する受容体 === |
|||
食作用のための受容体は、認識される分子によって2つのカテゴリーに分類される。1つ目のオプソニン受容体は[[オプソニン化|オプソニン]]に依存している<ref>The Immune System, Peter Parham, Garland Science, 2nd edition</ref>。これらの中には、結合した[[免疫グロブリンG|IgG]]抗体のFc部分を認識する受容体や、細胞や血漿由来の他のオプソニンを認識する沈着した[[補体系|補体]]や受容体がある。2つ目の非オプソニン受容体には、レクチン様受容体、{{仮リンク|デクチン1|en|Dectin 1|label=デクチン}}受容体、スカベンジャー受容体がある。一部の食細胞経路は、[[病原体関連分子パターン]](PAMPS)への付着によって活性化された[[パターン認識受容体]](PRR)からの第2のシグナルを必要とし、これによって[[NF-κB]]が活性化される<ref name=":0" />。 |
|||
==== Fcγ受容体 ==== |
|||
Fcγ受容体は、[[免疫グロブリンG|IgG]]でコーティングされた標的を認識する。主に認識される部分は[[フラグメント結晶化可能領域|Fcフラグメント]]である。受容体の分子は、細胞内{{仮リンク|免疫受容活性化チロシンモチーフ|en|Immunoreceptor tyrosine-based activation motif|label=ITAMドメイン}}を持っているか、ITAM含有アダプター分子と結合している。ITAMドメインは、食細胞の表面から核にシグナルを伝達する。たとえば、ヒトマクロファージの活性化受容体には、{{仮リンク|FcγRI|en|FcγRI}}、{{仮リンク|FcγRIIA|en|FcγRIIA}}、{{仮リンク|FcγRIII|en|FcγRIIIA}}がある<ref name=":3" />。Fcγ受容体を介した食作用では、「食作用カップ」と呼ばれる細胞の突起が形成され、好中球の酸化的バーストを活性化する<ref name=":2" />。 |
|||
==== 補体受容体 ==== |
|||
これらの受容体は、血漿補体から{{仮リンク|C3b|en|C3b}}、{{仮リンク|補体成分4|en|Complement component 4|label=C4b}}、およびC3biでコーティングされた標的を認識する。受容体の細胞外ドメインには、レクチン様補体結合ドメインが含まれる。補体受容体による認識だけでは、付加的なシグナルなしで内在化を起こせない。マクロファージでは、{{仮リンク|補体レセプター1|en|Complement receptor 1|label=CR1}}、{{仮リンク|補体レセプター3|en|Complement Receptor 3|label=CR3}}、CR4が標的の認識を担っている。補体でコーティングされた標的は、突起なしで、食細胞膜に「沈み込む」ことで内在化される<ref name=":3" />。 |
|||
==== マンノース受容体 ==== |
|||
[[マンノース]]および[[フコース]]などの病原体に関連する糖類は、マンノース受容体によって認識される。8つのレクチン様ドメインが受容体の細胞外部分を形成する。マンノース受容体を介した摂取は、Fcγ受容体または補体受容体を介した食作用とは分子メカニズムが異なる<ref name=":3" />。 |
|||
=== ファゴソームの分解 === |
|||
物質の飲み込みはアクチン-ミオシン収縮系によって促進される。物質の食作用によってファゴソーム(phagosome、食胞)と呼ばれる[[細胞小器官]]が形成される。その後、これは食細胞の[[中心体]]に向かって移動し、[[リソソーム]](lysosome、水解小体)と融合して[[ファゴリソソーム]]を形成し分解に至る。ファゴリソソームは次第に酸性化され、分解酵素が活性化する<ref name=":0" /><ref>{{Cite journal|last1=Flannagan|first1=Ronald S.|last2=Jaumouillé|first2=Valentin|last3=Grinstein|first3=Sergio|date=2012-02-28|title=The Cell Biology of Phagocytosis|journal=Annual Review of Pathology: Mechanisms of Disease|language=en|volume=7|issue=1|pages=61–98|doi=10.1146/annurev-pathol-011811-132445|pmid=21910624|issn=1553-4006}}</ref>。 |
|||
分解は、酸素依存性または酸素非依存性の2種類がある。 |
|||
* 酸素依存性分解は、[[ニコチンアミドアデニンジヌクレオチドリン酸|NADPH]]と[[活性酸素種]]の生成に依存する。[[過酸化水素]]と[[ミエロペルオキシダーゼ]]がハロゲン化反応を活性化させ、[[次亜塩素酸塩]]の生成および細菌の破壊をもたらす<ref>{{Cite journal |url=http://www.colorado.edu/intphys/iphy3700/vitCHemila92.pdf |title= Vitamin C and the common cold |access-date=2011-10-28 |archiveurl=https://web.archive.org/web/20160303170706/http://www.colorado.edu/intphys/iphy3700/vitCHemila92.pdf |archivedate=2016-03-03 |url-status=dead | journal = British Journal of Nutrition | date = 1992 | volume = 67 | pages = 3-16 | last = Hemilä | first = Harri | doi = 10.1079/bjn19920004 | pmid = 1547201| doi-access = free }}</ref>。 |
|||
* 酸素非依存性分解は、[[リゾチーム]]などの酵素や[[ディフェンシン]]などのカチオン性タンパク質を含む顆粒の放出に依存する。これらの顆粒には他の抗菌ペプチドも存在しており、[[ラクトフェリン]]は[[鉄]]を補足して細菌にとって好ましくない増殖条件を作り出す。また、ヒアルロニダーゼ、リパーゼ、コラゲナーゼ、エラスターゼ、リボヌクレアーゼ、デオキシリボヌクレアーゼなどの他の酵素も、感染の拡大を妨げ、[[細胞死]]につながる必須の微生物生体分子の分解に重要な役割を果たす<ref name=":2" /><ref name=":3" />。 |
|||
[[白血球]]は、食作用の際に[[シアン化水素]]を生成し、いくつかの他の毒性化学物質を生成することで[[細菌]]、[[真菌]]、他の病原体を殺滅することができる<ref name="pmid9369328">{{cite journal|authors=Borowitz JL, Gunasekar PG, Isom GE|date=12 Sep 1997|title=Hydrogen cyanide generation by mu-opiate receptor activation: possible neuromodulatory role of endogenous cyanide|journal=[[:en:Brain Research|Brain Research]]|volume=768|issue=1–2|pages=294–300|doi=10.1016/S0006-8993(97)00659-8|pmid=9369328|s2cid=12277593}}</ref><ref>{{cite journal|last1=Stelmaszyńska|first1=T|year=1985|title=Formation of HCN by human phagocytosing neutrophils--1. Chlorination of Staphylococcus epidermidis as a source of HCN|journal=Int J Biochem|volume=17|issue=3|pages=373–9|doi=10.1016/0020-711x(85)90213-7|pmid=2989021}}</ref><ref name="ZgliczyńskiStelmaszyńska1988">{{cite book|title=The Respiratory Burst and its Physiological Significance|last1=Zgliczyński|first1=Jan Maciej|last2=Stelmaszyńska|first2=Teresa|year=1988|isbn=978-1-4684-5498-7|pages=315–347|doi=10.1007/978-1-4684-5496-3_15}}</ref>。 |
|||
[[梅毒トレポネーマ]](''Treponema pallidum'')、[[大腸菌]](''Escherichia coli'')、[[黄色ブドウ球菌]](''Staphylococcus aureus'')などの一部の細菌は、いくつかの機構によって食作用を回避することができる{{citation needed|date=2021年7月}}。 |
|||
| ⚫ | |||
| ⚫ | |||
== アポトーシスでの食作用 == |
|||
{{Main|アポトーシス|エフェロサイトーシス}} |
|||
死につつある細胞は、[[アポトーシス]]に続いて、[[エフェロサイトーシス]]と呼ばれるプロセスで、マクロファージによって周囲の組織に取り込まれる必要がある。アポトーシス細胞の特徴の一つは、[[カルレティキュリン]]、[[ホスファチジルセリン]](細胞膜内層から)、{{仮リンク|アネキシンA1|en|Annexin A1}}、酸化{{仮リンク|低密度リポタンパク質|en|Low-density lipoprotein|label=LDL}}、変化した[[糖鎖]]など、さまざまな細胞内分子が[[細胞膜|細胞表面]]に提示されることである<ref name="pmid22074924">{{cite journal | authors = Bilyy RO, Shkandina T, Tomin A, Muñoz LE, Franz S, Antonyuk V, Kit YY, Zirngibl M, Fürnrohr BG, Janko C, Lauber K, Schiller M, Schett G, Stoika RS, Herrmann M | title = Macrophages discriminate glycosylation patterns of apoptotic cell-derived microparticles | journal = The Journal of Biological Chemistry | volume = 287 | issue = 1 | pages = 496–503 | date = January 2012 | pmid = 22074924 | pmc = 3249103 | doi = 10.1074/jbc.M111.273144 }}</ref>。これらの分子は、ホスファチジルセリン受容体のようなマクロファージの細胞表面にある受容体、または{{仮リンク|トロンボスポンジン1|en|Thrombospondin 1}}、{{仮リンク|GAS6|en|GAS6}}、{{仮リンク|MFGE8|en|MFGE8}}のような可溶性(浮遊)受容体によって認識され、{{仮リンク|CD36|en|CD36}}や{{仮リンク|アルファVベータ3|en|Alpha-v beta-3|label=αVβ3}}[[インテグリン]]のようなマクロファージ上の他の受容体と結合する。アポトーシス細胞のクリアランスの障害は、通常、マクロファージの障害食作用と関連している。アポトーシス細胞の残骸が蓄積すると、しばしば[[自己免疫疾患]]を引き起こす。したがって、食作用を薬理学的に増強することは、ある種の自己免疫疾患の治療において医学的な可能性を秘めている<ref name="pmid19838202">{{cite journal | authors = Mukundan L, Odegaard JI, Morel CR, Heredia JE, Mwangi JW, Ricardo-Gonzalez RR, Goh YP, Eagle AR, Dunn SE, Awakuni JU, Nguyen KD, Steinman L, Michie SA, Chawla A | title = PPAR-delta senses and orchestrates clearance of apoptotic cells to promote tolerance | journal = Nature Medicine | volume = 15 | issue = 11 | pages = 1266–72 | date = November 2009 | pmid = 19838202 | pmc = 2783696 | doi = 10.1038/nm.2048 }}</ref><ref>{{cite journal|last=Roszer|first=T|author2=Menéndez-Gutiérrez, MP |author3=Lefterova, MI |author4=Alameda, D |author5=Núñez, V |author6=Lazar, MA |author7=Fischer, T |author8= Ricote, M |title=Autoimmune kidney disease and impaired engulfment of apoptotic cells in mice with macrophage peroxisome proliferator-activated receptor gamma or retinoid X receptor alpha deficiency|journal=Journal of Immunology|date=Jan 1, 2011|volume=186|issue=1|pages=621–31|pmid=21135166|doi=10.4049/jimmunol.1002230|pmc=4038038}}</ref><ref>{{cite journal|last=Kruse|first=K|author2=Janko, C |author3=Urbonaviciute, V |author4=Mierke, CT |author5=Winkler, TH |author6=Voll, RE |author7=Schett, G |author8=Muñoz, LE |author9= Herrmann, M |title=Inefficient clearance of dying cells in patients with SLE: anti-dsDNA autoantibodies, MFG-E8, HMGB-1 and other players|journal=Apoptosis|date=September 2010|volume=15|issue=9|pages=1098–113|pmid=20198437|doi=10.1007/s10495-010-0478-8|s2cid=12729066}}</ref><ref>{{cite journal|last=Han|first=CZ|author2=Ravichandran, KS|title=Metabolic connections during apoptotic cell engulfment|journal=Cell|date=Dec 23, 2011|volume=147|issue=7|pages=1442–5|pmid=22196723|doi=10.1016/j.cell.2011.12.006|pmc=3254670}}</ref>。[[Image:Trophozoites of Entamoeba histolytica with ingested erythrocytes.JPG|thumb|赤血球を摂取した赤痢アメーバの栄養体]] |
|||
== 原生生物での食作用 == |
|||
多くの[[原生生物|原生生物では]]、食作用は栄養の一部または全部を提供する摂食手段として使用される。これは貪食栄養と呼ばれ、吸収によって起こる浸透圧栄養とは区別される{{citation needed|date=September 2018}}。 |
|||
* [[アメーバ]]などでは、食細胞と同様に、標的物体を[[仮足]]で囲むことによって食作用が起こる。[[アメーボゾア]]の一種であるヒトの''[[赤痢アメーバ]]は''[[赤血球]]を貪食することがある。 |
|||
* [[繊毛虫]]では細胞内の[[細胞口]]と呼ばれる溝または窪みで食作用が起こる <ref name="pmid120892122">{{Cite journal|date=July 2002|title=In the polymorphic ciliate Tetrahymena vorax, the non-selective phagocytosis seen in microstomes changes to a highly selective process in macrostomes|journal=The Journal of Experimental Biology|volume=205|issue=Pt 14|pages=2089–97|PMID=12089212}}</ref>。 |
|||
免疫細胞の場合と同様に、得られたファゴソームは消化[[酵素]]を含むリソソームと融合して、ファゴリソソームを形成する可能性がある。次に、食物粒子が消化され、放出された栄養素は、他の代謝プロセスで使用するために[[細胞質基質|細胞質ゾル]]に拡散または輸送される <ref>{{Cite journal|last=Montagnes|first=Djs|last2=Barbosa|first2=Ab|last3=Boenigk|first3=J|last4=Davidson|first4=K|last5=Jürgens|first5=K|last6=Macek|first6=M|last7=Parry|first7=Jd|last8=Roberts|first8=Ec|last9=imek|first9=K|date=2008-09-18|title=Selective feeding behaviour of key free-living protists: avenues for continued study|journal=Aquatic Microbial Ecology|volume=53|pages=83–98|language=en|DOI=10.3354/ame01229|ISSN=0948-3055}}</ref>。 |
|||
[[混合栄養生物]]では、貪食栄養と[[光栄養生物|光合成]]栄養を伴う可能性がある <ref name="pmid128123722">{{Cite journal|date=April 2003|title=Mixotrophy of a photosynthetic flagellate viewed from an optimal foraging perspective|journal=Protist|volume=154|issue=1|pages=91–8|DOI=10.1078/143446103764928512|PMID=12812372}}</ref>。 |
|||
| ⚫ | |||
*[[能動輸送]] |
|||
*[[抗原提示]] |
|||
*[[抗原提示細胞]] |
|||
*{{仮リンク|細胞内細胞貫入現象|en|Emperipolesis}} - 他の細胞の細胞質内に無傷の細胞が存在すること |
|||
*[[内部共生体#原生生物の内生生物]] |
|||
*{{仮リンク|傍細胞貪食|en|Paracytophagy}} - ある細胞が隣の細胞から伸びてきた突起物を飲み込む細胞プロセス |
|||
*{{仮リンク|ファゴトーシス|en|Phagoptosis}} - 細胞が他の細胞に貪食されることで起こる細胞死の一種 |
|||
*[[飲作用]] |
*[[飲作用]] |
||
*[[齧作用]] |
|||
*{{仮リンク|残余小体|en|Residual body}} - [[リソソーム]]で消化できない物質を含む小胞 |
|||
*[[細胞壁]] |
|||
== 脚注 == |
|||
=== 注釈 === |
|||
{{Medical-stub}} |
|||
{{Notelist}} |
|||
=== 出典 === |
|||
{{脚注ヘルプ}} |
|||
{{Reflist|32em}} |
|||
== 外部リンク == |
|||
{{EB1911 Poster|Phagocytosis}} |
|||
*{{Commonscatinline|Phagocytosis}} |
|||
*{{MeshName|Phagocytosis}} |
|||
{{Normdaten}} |
|||
{{DEFAULTSORT:しよくさよう}} |
{{DEFAULTSORT:しよくさよう}} |
||
[[ |
[[Category:免疫学]] |
||
[[Category:細胞プロセス]] |
[[Category:細胞プロセス]] |
||
[[Category:食作用]] |
|||
2024年4月7日 (日) 20:18時点における最新版


食作用(しょくさよう、英: phagocytosis[注釈 1]、ファゴサイトーシス)または貪食(どんしょく)は、細胞がその細胞膜を使って大きな粒子(0.5 μm以上)を取り込み、ファゴソーム(食胞)と呼ばれる内部区画を形成するプロセスである。これはエンドサイトーシスの一種である。食作用を行う細胞を食細胞(ファゴサイト)と呼ぶ。

多細胞生物の免疫系では、食作用は病原体や細胞の残骸を異物として除去するための主要な機構である。摂取された物質は、ファゴソーム内で消化される。細菌、ウイルス、死んだ組織細胞、寄生虫、異常な代謝産物、小さな鉱物粒子などが、貪食される可能性のある物質の例である。原生動物の中には、食作用を利用して栄養素を摂取するものがある。
歴史[編集]
食作用は、カナダの医師ウィリアム・オスラーが最初に指摘し(1876年)[1]、その後、イリヤ・メチニコフが研究し命名した(1880年と1883年)[2]。
免疫系での食作用[編集]

食作用は、自然免疫防御の主要な機構の一つである。これは、感染に応答する最初のプロセスの1つであり、適応免疫応答の開始ブランチの1つでもある。ほとんどの細胞は食作用を行うことができ、一部の細胞は主な機能の一部として食作用を実行する。これらは「プロフェッショナルの食細胞」(professional phagocytes)と呼ばれている。食作用は進化という観点から見ると古く、無脊椎動物にも存在している[3]。
プロフェッショナルの食細胞[編集]
好中球、マクロファージ、単球、樹状細胞、破骨細胞、および好酸球は、プロフェッショナルの食細胞として分類される[2]。最初の3つは、ほとんどの感染症に対する免疫応答に最も大きな役割を果たす[3]。
好中球の役割は、血流をパトロールし、感染の場合にのみ大変な数で組織に急速に移動することである[3]。そこでは食作用による直接的な殺傷効果がある。摂取後の好中球は、病原体を細胞内で効率的に殺滅する。好中球は、主にFcγ受容体と補体受容体1および3を介して貪食する。好中球の殺滅効果は、あらかじめ形成された顆粒に存在する分子のたくさんのレパートリーによるものである。この顆粒に用意されている酵素や他の分子は、コラゲナーゼ、ゼラチナーゼ、またはセリンプロテアーゼなどのプロテアーゼ、ミエロペルオキシダーゼ、ラクトフェリン、および抗生物質タンパク質である。これらのファゴソームへの脱顆粒は、高い活性酸素種の産生(呼吸性バースト)を伴い、非常に高い殺菌力がある[4]。
単球やそれが成熟したマクロファージは、血液循環から離れて組織内を移動する。そこでは、これらは常在細胞となり、静止した防壁を形成する[3]。マクロファージは、マンノース受容体、スカベンジャー受容体、Fcγ受容体、補体受容体1、3、4によって食作用を開始する。マクロファージは長寿命で、新たなリソソームを形成することで食作用を継続することができる[3][5]。
また、樹状細胞も組織内に存在し、食作用によって病原体を摂取する。それらの役割は、微生物を殺したり除去することではなく、適応免疫系の細胞に抗原提示するために微生物を分解することである[3]。
食作用を誘発する受容体[編集]
食作用のための受容体は、認識される分子によって2つのカテゴリーに分類される。1つ目のオプソニン受容体はオプソニンに依存している[6]。これらの中には、結合したIgG抗体のFc部分を認識する受容体や、細胞や血漿由来の他のオプソニンを認識する沈着した補体や受容体がある。2つ目の非オプソニン受容体には、レクチン様受容体、デクチン受容体、スカベンジャー受容体がある。一部の食細胞経路は、病原体関連分子パターン(PAMPS)への付着によって活性化されたパターン認識受容体(PRR)からの第2のシグナルを必要とし、これによってNF-κBが活性化される[2]。
Fcγ受容体[編集]
Fcγ受容体は、IgGでコーティングされた標的を認識する。主に認識される部分はFcフラグメントである。受容体の分子は、細胞内ITAMドメインを持っているか、ITAM含有アダプター分子と結合している。ITAMドメインは、食細胞の表面から核にシグナルを伝達する。たとえば、ヒトマクロファージの活性化受容体には、FcγRI、FcγRIIA、FcγRIIIがある[5]。Fcγ受容体を介した食作用では、「食作用カップ」と呼ばれる細胞の突起が形成され、好中球の酸化的バーストを活性化する[4]。
補体受容体[編集]
これらの受容体は、血漿補体からC3b、C4b、およびC3biでコーティングされた標的を認識する。受容体の細胞外ドメインには、レクチン様補体結合ドメインが含まれる。補体受容体による認識だけでは、付加的なシグナルなしで内在化を起こせない。マクロファージでは、CR1、CR3、CR4が標的の認識を担っている。補体でコーティングされた標的は、突起なしで、食細胞膜に「沈み込む」ことで内在化される[5]。
マンノース受容体[編集]
マンノースおよびフコースなどの病原体に関連する糖類は、マンノース受容体によって認識される。8つのレクチン様ドメインが受容体の細胞外部分を形成する。マンノース受容体を介した摂取は、Fcγ受容体または補体受容体を介した食作用とは分子メカニズムが異なる[5]。
ファゴソームの分解[編集]
物質の飲み込みはアクチン-ミオシン収縮系によって促進される。物質の食作用によってファゴソーム(phagosome、食胞)と呼ばれる細胞小器官が形成される。その後、これは食細胞の中心体に向かって移動し、リソソーム(lysosome、水解小体)と融合してファゴリソソームを形成し分解に至る。ファゴリソソームは次第に酸性化され、分解酵素が活性化する[2][7]。
分解は、酸素依存性または酸素非依存性の2種類がある。
- 酸素依存性分解は、NADPHと活性酸素種の生成に依存する。過酸化水素とミエロペルオキシダーゼがハロゲン化反応を活性化させ、次亜塩素酸塩の生成および細菌の破壊をもたらす[8]。
- 酸素非依存性分解は、リゾチームなどの酵素やディフェンシンなどのカチオン性タンパク質を含む顆粒の放出に依存する。これらの顆粒には他の抗菌ペプチドも存在しており、ラクトフェリンは鉄を補足して細菌にとって好ましくない増殖条件を作り出す。また、ヒアルロニダーゼ、リパーゼ、コラゲナーゼ、エラスターゼ、リボヌクレアーゼ、デオキシリボヌクレアーゼなどの他の酵素も、感染の拡大を妨げ、細胞死につながる必須の微生物生体分子の分解に重要な役割を果たす[4][5]。
白血球は、食作用の際にシアン化水素を生成し、いくつかの他の毒性化学物質を生成することで細菌、真菌、他の病原体を殺滅することができる[9][10][11]。
梅毒トレポネーマ(Treponema pallidum)、大腸菌(Escherichia coli)、黄色ブドウ球菌(Staphylococcus aureus)などの一部の細菌は、いくつかの機構によって食作用を回避することができる[要出典]。
獲得免疫の誘導[編集]
また、異物の分解産物の一部は細胞膜表面に提示され、これをリンパ球(T細胞)が認識する。このことによりT細胞の分化が生じ、抗原に特異的な免疫である獲得免疫(細胞性免疫あるいは液性免疫)が誘導される[要出典]。
アポトーシスでの食作用[編集]
死につつある細胞は、アポトーシスに続いて、エフェロサイトーシスと呼ばれるプロセスで、マクロファージによって周囲の組織に取り込まれる必要がある。アポトーシス細胞の特徴の一つは、カルレティキュリン、ホスファチジルセリン(細胞膜内層から)、アネキシンA1、酸化LDL、変化した糖鎖など、さまざまな細胞内分子が細胞表面に提示されることである[12]。これらの分子は、ホスファチジルセリン受容体のようなマクロファージの細胞表面にある受容体、またはトロンボスポンジン1、GAS6、MFGE8のような可溶性(浮遊)受容体によって認識され、CD36やαVβ3インテグリンのようなマクロファージ上の他の受容体と結合する。アポトーシス細胞のクリアランスの障害は、通常、マクロファージの障害食作用と関連している。アポトーシス細胞の残骸が蓄積すると、しばしば自己免疫疾患を引き起こす。したがって、食作用を薬理学的に増強することは、ある種の自己免疫疾患の治療において医学的な可能性を秘めている[13][14][15][16]。
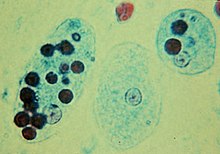
原生生物での食作用[編集]
多くの原生生物では、食作用は栄養の一部または全部を提供する摂食手段として使用される。これは貪食栄養と呼ばれ、吸収によって起こる浸透圧栄養とは区別される[要出典]。
- アメーバなどでは、食細胞と同様に、標的物体を仮足で囲むことによって食作用が起こる。アメーボゾアの一種であるヒトの赤痢アメーバは赤血球を貪食することがある。
- 繊毛虫では細胞内の細胞口と呼ばれる溝または窪みで食作用が起こる [17]。
免疫細胞の場合と同様に、得られたファゴソームは消化酵素を含むリソソームと融合して、ファゴリソソームを形成する可能性がある。次に、食物粒子が消化され、放出された栄養素は、他の代謝プロセスで使用するために細胞質ゾルに拡散または輸送される [18]。
混合栄養生物では、貪食栄養と光合成栄養を伴う可能性がある [19]。
参照項目[編集]
- 能動輸送
- 抗原提示
- 抗原提示細胞
- 細胞内細胞貫入現象 - 他の細胞の細胞質内に無傷の細胞が存在すること
- 内部共生体#原生生物の内生生物
- 傍細胞貪食 - ある細胞が隣の細胞から伸びてきた突起物を飲み込む細胞プロセス
- ファゴトーシス - 細胞が他の細胞に貪食されることで起こる細胞死の一種
- 飲作用
- 齧作用
- 残余小体 - リソソームで消化できない物質を含む小胞
- 細胞壁
脚注[編集]
注釈[編集]
出典[編集]
- ^ Ambrose, Charles T. (2006). “The Osler slide, a demonstration of phagocytosis from 1876: Reports of phagocytosis before Metchnikoff's 1880 paper”. Cellular Immunology 240 (1): 1–4. doi:10.1016/j.cellimm.2006.05.008. PMID 16876776.
- ^ a b c d Gordon, Siamon (March 2016). “Phagocytosis: An Immunobiologic Process”. Immunity 44 (3): 463–475. doi:10.1016/j.immuni.2016.02.026. PMID 26982354.
- ^ a b c d e f M.), Murphy, Kenneth (Kenneth (2012). Janeway's immunobiology. Travers, Paul, 1956-, Walport, Mark., Janeway, Charles. (8th ed.). New York: Garland Science. ISBN 9780815342434. OCLC 733935898
- ^ a b c Witko-Sarsat, Véronique; Rieu, Philippe; Descamps-Latscha, Béatrice; Lesavre, Philippe; Halbwachs-Mecarelli, Lise (May 2000). “Neutrophils: Molecules, Functions and Pathophysiological Aspects”. Laboratory Investigation 80 (5): 617–653. doi:10.1038/labinvest.3780067. ISSN 0023-6837. PMID 10830774.
- ^ a b c d e Aderem, Alan; Underhill, David M. (April 1999). “Mechanisms of Phagocytosis in Macrophages”. Annual Review of Immunology 17 (1): 593–623. doi:10.1146/annurev.immunol.17.1.593. ISSN 0732-0582. PMID 10358769.
- ^ The Immune System, Peter Parham, Garland Science, 2nd edition
- ^ Flannagan, Ronald S.; Jaumouillé, Valentin; Grinstein, Sergio (2012-02-28). “The Cell Biology of Phagocytosis” (英語). Annual Review of Pathology: Mechanisms of Disease 7 (1): 61–98. doi:10.1146/annurev-pathol-011811-132445. ISSN 1553-4006. PMID 21910624.
- ^ Hemilä, Harri (1992). “Vitamin C and the common cold”. British Journal of Nutrition 67: 3-16. doi:10.1079/bjn19920004. PMID 1547201. オリジナルの2016-03-03時点におけるアーカイブ。 2011年10月28日閲覧。.
- ^ Borowitz JL, Gunasekar PG, Isom GE (12 Sep 1997). “Hydrogen cyanide generation by mu-opiate receptor activation: possible neuromodulatory role of endogenous cyanide”. Brain Research 768 (1–2): 294–300. doi:10.1016/S0006-8993(97)00659-8. PMID 9369328.
- ^ Stelmaszyńska, T (1985). “Formation of HCN by human phagocytosing neutrophils--1. Chlorination of Staphylococcus epidermidis as a source of HCN”. Int J Biochem 17 (3): 373–9. doi:10.1016/0020-711x(85)90213-7. PMID 2989021.
- ^ Zgliczyński, Jan Maciej; Stelmaszyńska, Teresa (1988). The Respiratory Burst and its Physiological Significance. pp. 315–347. doi:10.1007/978-1-4684-5496-3_15. ISBN 978-1-4684-5498-7
- ^ Bilyy RO, Shkandina T, Tomin A, Muñoz LE, Franz S, Antonyuk V, Kit YY, Zirngibl M, Fürnrohr BG, Janko C, Lauber K, Schiller M, Schett G, Stoika RS, Herrmann M (January 2012). “Macrophages discriminate glycosylation patterns of apoptotic cell-derived microparticles”. The Journal of Biological Chemistry 287 (1): 496–503. doi:10.1074/jbc.M111.273144. PMC 3249103. PMID 22074924.
- ^ Mukundan L, Odegaard JI, Morel CR, Heredia JE, Mwangi JW, Ricardo-Gonzalez RR, Goh YP, Eagle AR, Dunn SE, Awakuni JU, Nguyen KD, Steinman L, Michie SA, Chawla A (November 2009). “PPAR-delta senses and orchestrates clearance of apoptotic cells to promote tolerance”. Nature Medicine 15 (11): 1266–72. doi:10.1038/nm.2048. PMC 2783696. PMID 19838202.
- ^ Roszer, T; Menéndez-Gutiérrez, MP; Lefterova, MI; Alameda, D; Núñez, V; Lazar, MA; Fischer, T; Ricote, M (Jan 1, 2011). “Autoimmune kidney disease and impaired engulfment of apoptotic cells in mice with macrophage peroxisome proliferator-activated receptor gamma or retinoid X receptor alpha deficiency”. Journal of Immunology 186 (1): 621–31. doi:10.4049/jimmunol.1002230. PMC 4038038. PMID 21135166.
- ^ Kruse, K; Janko, C; Urbonaviciute, V; Mierke, CT; Winkler, TH; Voll, RE; Schett, G; Muñoz, LE et al. (September 2010). “Inefficient clearance of dying cells in patients with SLE: anti-dsDNA autoantibodies, MFG-E8, HMGB-1 and other players”. Apoptosis 15 (9): 1098–113. doi:10.1007/s10495-010-0478-8. PMID 20198437.
- ^ Han, CZ; Ravichandran, KS (Dec 23, 2011). “Metabolic connections during apoptotic cell engulfment”. Cell 147 (7): 1442–5. doi:10.1016/j.cell.2011.12.006. PMC 3254670. PMID 22196723.
- ^ “In the polymorphic ciliate Tetrahymena vorax, the non-selective phagocytosis seen in microstomes changes to a highly selective process in macrostomes”. The Journal of Experimental Biology 205 (Pt 14): 2089–97. (July 2002). PMID 12089212.
- ^ Montagnes, Djs; Barbosa, Ab; Boenigk, J; Davidson, K; Jürgens, K; Macek, M; Parry, Jd; Roberts, Ec et al. (2008-09-18). “Selective feeding behaviour of key free-living protists: avenues for continued study” (英語). Aquatic Microbial Ecology 53: 83–98. doi:10.3354/ame01229. ISSN 0948-3055.
- ^ “Mixotrophy of a photosynthetic flagellate viewed from an optimal foraging perspective”. Protist 154 (1): 91–8. (April 2003). doi:10.1078/143446103764928512. PMID 12812372.
外部リンク[編集]
 ウィキメディア・コモンズには、食作用に関するカテゴリがあります。
ウィキメディア・コモンズには、食作用に関するカテゴリがあります。- Phagocytosis - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス
