「ポナチニブ」の版間の差分
en:Ponatinib 2021年8月11日 (水) 15:47 を翻訳。 タグ: サイズの大幅な増減 ビジュアルエディター |
|||
| 1行目: | 1行目: | ||
{{Drugbox |
|||
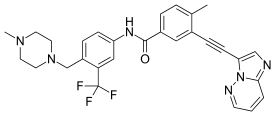
{{Drugbox|image=Ponatinib2DACS.svg|width=275|image2=Ponatinib molecule ball.png|width2=<!--Clinical data -->|IUPAC_name=3-(2-Imidazo[1,2-b]pyridazin-3-ylethynyl)-4-methyl-''N''-[4-[(4-methylpiperazin-1-yl)methyl]-3-(trifluoromethyl)phenyl]benzamide|legal_AU=<!-- S2, S3, S4, S5, S6, S7, S8, S9 or Unscheduled-->|legal_CA=<!-- OTC, Rx-only, Schedule I, II, III, IV, V, VI, VII, VIII -->|legal_UK=<!-- GSL, P, POM, CD, CD Lic, CD POM, CD No Reg POM, CD (Benz) POM, CD (Anab) POM or CD Inv POM -->|legal_US=Rx-only|licence_US=Ponatinib|pregnancy_AU=<!-- A / B1 / B2 / B3 / C / D / X -->|pregnancy_US=D|routes_of_administration=[[Oral administration|By mouth]] ([[Tablet (pharmacy)|tablets]]) <!--Pharmacokinetic data -->|tradename=Iclusig|pronounce={{respell|poe|NA|ti-nib}}|bioavailability=Unknown|protein_bound=>99% (''in vitro'')|metabolism=[[Liver]] ([[CYP3A4]], [[CYP2C8|2C8]], [[CYP2D6|2D6]], [[CYP3A5|3A5]])|elimination_half-life=12–66 hours|excretion=Feces (87%), urine (5%)<ref name="PI">{{cite web|title=Iclusig (ponatinib) Tablets, for Oral Use. Full Prescribing Information|url=http://www.iclusig.com/pi|publisher=ARIAD Pharmaceuticals, Inc. 26 Landsdowne Street, Cambridge, MA 02139-4234|accessdate=2 October 2016}}</ref> <!--Identifiers -->|synonyms=AP24534 <!--Chemical data -->|ATC_prefix=L01|CAS_number=943319-70-8|ChEBI=78543|ChEMBL=1171837|ChemSpiderID=24747381|KEGG=D09950|PubChem=24826799|UNII=4340891KFS|ATC_suffix=XE24|C=29|H=27|F=3|N=6|O=1|molecular_weight=532.56 g/mol|SMILES=Cc1ccc(cc1C#Cc2cnc3n2nccc3)C(=O)Nc4ccc(c(c4)C(F)(F)F)CN5CCN(CC5)C|smiles=Cc1ccc(cc1C#Cc2cnc3n2nccc3)C(=O)Nc4ccc(c(c4)C(F)(F)F)CN5CCN(CC5)C|StdInChI=1S/C29H27F3N6O/c1-20-5-6-22(16-21(20)8-10-25-18-33-27-4-3-11-34-38(25)27)28(39)35-24-9-7-23(26(17-24)29(30,31)32)19-37-14-12-36(2)13-15-37/h3-7,9,11,16-18H,12-15,19H2,1-2H3,(H,35,39)|StdInChIKey=PHXJVRSECIGDHY-UHFFFAOYSA-N}}'''ポナチニブ''' (商品名 '''アイクルシグ '''''Iclusig'' 以前の名称は '''AP24534''')は、 [[ARIAD製薬]]([[:en:ARIAD Pharmaceuticals]])が開発した[[慢性骨髄性白血病|慢性期慢性骨髄性白血病]] (CML)および[[フィラデルフィア染色体]]陽性(Ph+) [[急性リンパ性白血病]] (ALL) 治療のための経口薬で、多標的の[[チロシンキナーゼ]]阻害剤。2017年現在、日本では[[大塚製薬]]が国内製造販売承認申請を行い、販売を行っている<ref>{{cite web|title=大塚製薬 白血病治療薬「アイクルシグ®錠15mg」国内で新発売|url=https://www.otsuka.co.jp/company/release/detail.php?id=3179|accessdate=9 September 2017}}</ref>。 |
|||
| drug_name = |
|||
| image = Ponatinib2DACS.svg |
|||
| width = 275 |
|||
| alt = |
|||
| image2 = Ponatinib molecule ball.png |
|||
| width2 = |
|||
| alt2 = |
|||
<!--Clinical data --> |
|||
| pronounce = {{IPAc-en|p|oʊ|ˈ|n|æ|t|ɪ|n|ɪ|b}} {{respell|poh|NAT|i-nib}} |
|||
| tradename = Iclusig |
|||
| Drugs.com = {{drugs.com|monograph|ponatinib}} |
|||
| MedlinePlus = a613029 |
|||
| licence_EU = yes |
|||
| DailyMedID = Ponatinib |
|||
| pregnancy_AU = D |
|||
| pregnancy_category = |
|||
| routes_of_administration = [[Oral administration|By mouth]] ([[Tablet (pharmacy)|tablets]]) |
|||
| ATC_prefix = L01 |
|||
| ATC_suffix = EA05 |
|||
| legal_AU = <!-- S2, S3, S4, S5, S6, S7, S8, S9 or Unscheduled--> |
|||
| legal_CA = <!-- OTC, Rx-only, Schedule I, II, III, IV, V, VI, VII, VIII --> |
|||
| legal_UK = <!-- GSL, P, POM, CD, CD Lic, CD POM, CD No Reg POM, CD (Benz) POM, CD (Anab) POM or CD Inv POM --> |
|||
| legal_US = Rx-only |
|||
| legal_status = |
|||
<!--Pharmacokinetic data --> |
|||
| bioavailability = Unknown |
|||
| protein_bound = >99% (''in vitro'') |
|||
| metabolism = [[Liver]] ([[CYP3A4]], [[CYP2C8|2C8]], [[CYP2D6|2D6]], [[CYP3A5|3A5]]) |
|||
| elimination_half-life = 12–66 hours |
|||
| excretion = Feces (87%), urine (5%)<ref name="PI">{{cite web|title=Iclusig (ponatinib) Tablets, for Oral Use. Full Prescribing Information|url=http://www.iclusig.com/pi|publisher=ARIAD Pharmaceuticals, Inc. 26 Landsdowne Street, Cambridge, MA 02139-4234|access-date=2 October 2016}}</ref> |
|||
<!--Identifiers --> |
|||
| CAS_number = 943319-70-8 |
|||
| PubChem = 24826799 |
|||
| DrugBank = DB08901 |
|||
| ChemSpiderID = 24747381 |
|||
| UNII = 4340891KFS |
|||
| ChEMBL = 1171837 |
|||
| ChEBI = 78543 |
|||
| KEGG = D09950 |
|||
| synonyms = AP24534 |
|||
<!--Chemical data --> |
|||
| IUPAC_name = 3-(2-Imidazo[1,2-b]pyridazin-3-ylethynyl)-4-methyl-''N''-[4-[(4-methylpiperazin-1-yl)methyl]-3-(trifluoromethyl)phenyl]benzamide |
|||
| C=29 | H=27 | F=3 | N=6 | O=1 |
|||
| smiles = Cc1ccc(cc1C#Cc2cnc3n2nccc3)C(=O)Nc4ccc(c(c4)C(F)(F)F)CN5CCN(CC5)C |
|||
| StdInChI=1S/C29H27F3N6O/c1-20-5-6-22(16-21(20)8-10-25-18-33-27-4-3-11-34-38(25)27)28(39)35-24-9-7-23(26(17-24)29(30,31)32)19-37-14-12-36(2)13-15-37/h3-7,9,11,16-18H,12-15,19H2,1-2H3,(H,35,39) |
|||
| StdInChIKey = PHXJVRSECIGDHY-UHFFFAOYSA-N |
|||
}} |
|||
'''ポナチニブ'''(Ponatinib、開発コード:'''AP24534''')は、[[慢性骨髄性白血病|慢性期慢性骨髄性白血病]] (CML)および[[フィラデルフィア染色体]]陽性(Ph+)[[急性リンパ性白血病]](ALL)治療のための経口薬で、多標的の[[チロシンキナーゼ]]阻害剤である<ref name="pmid20513156">{{cite journal|date=June 2010|title=Discovery of 3-[2-(imidazo[1,2-b]pyridazin-3-yl)ethynyl]-4-methyl-N-<nowiki/>{4-[(4-methylpiperazin-1-yl)methyl]-3-(trifluoromethyl)phenyl}benzamide (AP24534), a potent, orally active pan-inhibitor of breakpoint cluster region-abelson (BCR-ABL) kinase including the T315I gatekeeper mutant|journal=J. Med. Chem.|volume=53|issue=12|pages=4701–19|doi=10.1021/jm100395q|pmid=20513156|vauthors=Huang WS, Metcalf CA, Sundaramoorthi R, Wang Y, Zou D, Thomas RM, Zhu X, Cai L, Wen D, Liu S, Romero J, Qi J, Chen I, Banda G, Lentini SP, Das S, Xu Q, Keats J, Wang F, Wardwell S, Ning Y, Snodgrass JT, Broudy MI, Russian K, Zhou T, Commodore L, Narasimhan NI, Mohemmad QK, Iuliucci J, Rivera VM, Dalgarno DC, Sawyer TK, Clackson T, Shakespeare WC}}</ref>。CMLの中にはT315I変異を有するものがあり、[[イマチニブ]]等の治療に抵抗性を示すが、ポナチニブは、このようなタイプの腫瘍に効果を示す様に設計されている<ref name="pmid19878872">{{cite journal|date=November 2009|title=AP24534, a pan-BCR-ABL inhibitor for chronic myeloid leukemia, potently inhibits the T315I mutant and overcomes mutation-based resistance|journal=Cancer Cell|volume=16|issue=5|pages=401–12|doi=10.1016/j.ccr.2009.09.028|pmid=19878872|pmc=2804470|vauthors=O'Hare T, Shakespeare WC, Zhu X, Eide CA, Rivera VM, Wang F, Adrian LT, Zhou T, Huang WS, Xu Q, Metcalf CA, Tyner JW, Loriaux MM, Corbin AS, Wardwell S, Ning Y, Keats JA, Wang Y, Sundaramoorthi R, Thomas M, Zhou D, Snodgrass J, Commodore L, Sawyer TK, Dalgarno DC, Deininger MW, Druker BJ, Clackson T}}</ref>。 |
|||
米国食品医薬品局は、2012年12月に本剤を承認候補薬として認定したが、「生命を脅かす血栓や重度の血管狭窄のリスクがある」として、2013年10月31日に販売を一時停止させた<ref name="urlFDA Drug Safety Communication: FDA asks manufacturer of the leukemia drug Iclusig (ponatinib) to suspend marketing and sales">{{cite web|url=https://www.fda.gov/Drugs/DrugSafety/ucm373040.htm|title=FDA asks manufacturer of the leukemia drug Iclusig (ponatinib) to suspend marketing and sales|date=2013-10-31|work=FDA Drug Safety Communication|publisher=U.S. Food and Drug Administration|accessdate=}}</ref><ref name="urlSerious Danger of Blood Clots Halts Sale of Leukemia Drug - NYTimes.com">{{cite web|url=https://www.nytimes.com/2013/11/01/business/serious-danger-of-blood-clots-halts-sale-of-leukemia-drug.html|title=Serious Danger of Blood Clots Halts Sale of Leukemia Drug|author=Grady D|date=2013-10-31|work=Business|publisher=New York Times|accessdate=2021-09-18}}</ref>。その後、添付文書に新たな「黒枠警告」が設置され、本剤を使用する事によるリスクとベネフィットをより適切に評価するための「リスク評価および軽減戦略」が策定され、2013年12月20日に停止が一部解除された。 |
|||
日本では、2016年1月に[[大塚製薬]]が製造販売承認申請を行い<ref>{{Cite web|title=大塚製薬 白血病治療薬として「ポナチニブ」を国内製造販売承認申請|ニュースリリース|大塚製薬|url=https://www.otsuka.co.jp/company/newsreleases/2016/20160108_1.html|website=大塚製薬株式会社 Otsuka Pharmaceutical|accessdate=2021-09-18|language=ja}}</ref>、同年9月に承認された<ref>{{Cite web|title=白血病治療薬「アイクルシグ®錠15㎎」 国内製造販売承認を取得|ニュースリリース|大塚製薬|url=https://www.otsuka.co.jp/company/newsreleases/2016/20160928_1.html|website=大塚製薬株式会社 Otsuka Pharmaceutical|accessdate=2021-09-18|language=ja}}</ref>。 |
|||
== 効能・効果 == |
|||
日本で取得されている承認は、下記の2つである<ref name=":1">{{Cite web|title=アイクルシグ錠15mg|url=https://www.info.pmda.go.jp/go/pack/4291048F1020_1_06/?view=frame&style=XML&lang=ja|website=www.info.pmda.go.jp|accessdate=2021-09-18}}</ref>。 |
|||
* 前治療薬に抵抗性または不耐容の慢性骨髄性白血病 |
|||
* 再発または難治性のフィラデルフィア染色体陽性急性リンパ性白血病 |
|||
ポナチニブは、米国では2012年12月14日に、抵抗性または不耐症のCMLおよびPh+ ALLの患者を対象に、PACE第2相試験の結果が{{仮リンク|アメリカ血液学会議|en|American Society of Hematology|label=ASH}}年次総会で報告され、[[アメリカ食品医薬品局|米国FDA]]から仮承認された<ref name="ASH2012">{{cite web|title=Ponatinib Wins Early FDA Nod|url=http://www.medpagetoday.com/HematologyOncology/Leukemia/36462|author=Gever J|publisher=MedPageToday.com|date=Dec 14, 2012|work=Oncology/Hematology|accessdate=2021-09-18}}</ref>。その承認は、FDAの早期承認プログラムの下で行われた為、申請者は追加試験を実施する必要があった。これらの追加試験に基づき、添付文書を更新して、他のチロシンキナーゼ阻害剤による治療が適応とならない慢性期、移行期、急性転化期の慢性骨髄性白血病およびフィラデルフィア染色体陽性の急性リンパ性白血病の患者を対象として本承認された。また、T315I陽性のフィラデルフィア染色体陽性の急性リンパ芽球性白血病についても承認を取得した<ref name=":0">{{Cite web|url=http://www.onclive.com/web-exclusives/fda-grants-ponatinib-full-approval-for-rare-leukemias|title=FDA Grants Ponatinib Full Approval for Rare Leukemias|accessdate=2021-09-18}}</ref>。 |
|||
== 副作用 == |
|||
重大な副作用は<ref name=":1" />、 |
|||
* 冠動脈疾患(3.8%) |
|||
: 心筋梗塞(2.1%)、狭心症(0.8%)、急性冠症候群(0.4%)、心筋虚血(0.4%)、不安定狭心症(0.2%)等 |
|||
* 脳血管障害(2.9%) |
|||
: 脳梗塞(1.1%)、脳血管発作(0.8%)、脳動脈狭窄(0.4%)、一過性脳虚血発作(0.2%)、大脳動脈狭窄(0.2%)、脳虚血(0.2%)、脳幹梗塞(0.2%)等 |
|||
* 末梢動脈閉塞性疾患(2.7%) |
|||
: 間欠性跛行(1.3%)、末梢動脈狭窄(0.4%)、四肢壊死(0.2%)、網膜動脈閉塞症(0.2%)、腎動脈狭窄(頻度不明)等 |
|||
* 静脈血栓塞栓症(1.7%) |
|||
: 網膜静脈血栓症(0.6%)、深部静脈血栓症(0.4%)、肺塞栓症(0.4%)、静脈塞栓症(0.2%)等 |
|||
* 骨髄抑制(48.8%) |
|||
: 血小板数減少(38.3%)、好中球数減少(20.6%)、貧血(13.9%)、白血球数減少(5.1%)、発熱性好中球減少症(2.1%)、汎血球減少症(1.9%)、リンパ球数減少(1.9%)、骨髄機能不全(0.2%)等 |
|||
* 高血圧(14.1%) |
|||
: 高血圧クリーゼを含む |
|||
* 肝機能障害(17.5%) |
|||
: ALT、AST、ビリルビン、γ-GTP等の上昇を伴う肝機能障害(17.5%)、黄疸(0.4%)、肝不全 |
|||
* 膵炎(6.1%) |
|||
* 体液貯留(11.6%) |
|||
: 末梢性浮腫(6.3%)、胸水(4.0%)、心嚢液貯留(2.3%)、肺うっ血(0.2%)、肺水腫(0.2%)等 |
|||
* 感染症(12.4%) |
|||
: 肺炎(1.7%)、敗血症(1.1%)等 |
|||
* 重度の皮膚障害(1.7%) |
|||
: 剥脱性皮膚炎(1.1%)、多形紅斑(0.8%)等 |
|||
* 出血(2.3%) |
|||
: 鼻出血(2.1%)、胃腸出血(0.2%)、咽頭出血(0.2%)、出血性胃炎(0.2%)、性器出血(0.2%)、硬膜下血腫(頻度不明)等 |
|||
* 心不全(1.9%)、うっ血性心不全(0.8%) |
|||
* 不整脈(4.6%) |
|||
: 心房細動(2.3%)、徐脈(1.1%)、QT間隔延長(0.8%)、頻脈(0.4%)、心室性不整脈(0.2%)、心停止(0.2%)、房室ブロック(0.2%)等 |
|||
* 腫瘍崩壊症候群(0.2%) |
|||
* ニューロパチー(3.2%) |
|||
: 末梢性ニューロパチー(1.9%)、末梢性感覚ニューロパチー(0.8%)、多発ニューロパチー(0.2%)、末梢性運動ニューロパチー(0.2%)、末梢性感覚運動ニューロパチー(0.2%)等 |
|||
* 肺高血圧症(1.3%) |
|||
である。 |
|||
2013年10月9日、米国食品医薬品局(FDA)は、ポナチニブを服用している患者に血栓の増加が認められた為、新規試験の登録を一部保留した<ref name="Carroll_2013">{{cite web|title=UPDATED: Ariad hammered on toxicity concerns for leukemia drug Iclusig|publisher=FierceBiotech|url=http://www.fiercebiotech.com/story/tox-issues-force-ariad-slam-brakes-enrollment-slash-dosing-iclusig/2013-10-09|author=Carroll J|accessdate=2021-09-18}}</ref>。その後、10月18日にEPIC試験が中止された<ref name="newsrelease_101813">{{cite web|title=ARIAD Announces Discontinuation of the Phase 3 Epic Trial of Iclusig in Patients with Newly Diagnosed Chronic Myeloid Leukemia|url=http://investor.ariad.com/phoenix.zhtml?c=118422&p=irol-newsArticle&ID=1865879&highlight=}}</ref>。その後、慢性期の慢性骨髄性白血病を対象に、4年間に亘ってポナチニブを投与した449名の患者を対象とした試験で、以下の副作用が認められた。150 名の患者が、心血管系(21%)、末梢血管系(12%)、脳血管系(9%)の動脈閉塞性イベントを経験した。静脈血栓塞栓症は患者の6%に発生した。最も多かった全グレードの有害事象は、高血圧(69%)、発疹(63%)、腹痛(48%)、疲労(47%)、頭痛(43%)、動脈性虚血(42%)、皮膚の乾燥(42%)、便秘(41%)、関節痛(32%)、吐き気(28%)、発熱(26%)、末梢神経障害(24%)、筋肉痛(24%)、四肢の痛み(23%)、腰痛(21%)、下痢(20%)などであった。また、[[可逆性後頭葉白質脳症]]の報告例もある<ref name=":0" />。 |
|||
== 作用機序 == |
== 作用機序 == |
||
ポナチニブの主な標的は、CMLおよびPh+ ALLの特徴である異常なチロシンキナーゼである[[フィラデルフィア染色体|BCR-ABL]]である。CMLは、BCR-ABLタンパク質を産生する遺伝子異常により、骨髄で白血球が過剰かつ無秩序に産生されることが特徴である。白血球が過剰に産生される慢性期を経て、CMLは通常、移行期、急性転化期などのより積極的な病相へと移行する。Ph+ ALLは、BCR-ABLを産生するPh+染色体を有する急性リンパ性白血病のサブタイプである。CMLよりも侵攻性が高く、化学療法とチロシンキナーゼ阻害剤を併用して治療することが多い。これらの疾患はいずれもBCR-ABLタンパク質を発現しているため、ポナチニブによる治療を受けられる可能性がある。CML患者の95%にBCR-ABLが検出される{{citation needed|date=December 2012}}。 |
|||
[[イマチニブ#作用機序|イマチニブ]]、[[ダサチニブ#作用機序|ダサチニブ]]と同様であるが、これらの前治療薬に対して抵抗性を示すT315i変異などを含む変異型BCL-ABLに対しても、効果を示すように設計されている。 |
|||
[[ニロチニブ]]や[[ダサチニブ]]の一次治療を受けているCML患者は、22~33%の患者が有害事象や治療失敗などの理由で2年までに治療を中止している{{citation needed|date=December 2012}}。 |
|||
== 臨床試験 == |
|||
2010年、ARIAD社は、抵抗性・難治性の慢性骨髄性白血病(CML)およびフィラデルフィア陽性の急性リンパ性白血病(Ph+ ALL)の患者を対象としたponatinibの第1相試験の結果を発表した。この試験では、ポナチニブを投与した慢性期のCML患者において、T315I変異も有する患者の100%を含む66%の患者が細胞遺伝学的に大きな奏効を得たことが実証された{{citation needed|date=December 2012}}。 |
|||
PACE試験(Ponatinib Ph+ ALL and CML Evaluation)は、2010年9月に患者の登録を開始した重要な第2相試験で、この環境下での規制当局による承認のための決定的な臨床データを提供する事を目的としている。この試験については、2012年12月に良好な結果が報告さた<ref name="ASH2012" /><ref name="PACE2012">{{cite web|title=Ponatinib Retains Luster in Leukemia|url=http://www.medpagetoday.com/MeetingCoverage/ASHHematology/36368|author=Gever J|publisher=MedPageToday.com|date=Dec 10, 2012|work=Oncology/Hematology|accessdate=2021-09-18}}</ref>。 |
|||
EPIC(Evaluation of Ponatinib versus Imatinib in CML)試験は、2012年6月に開始され<ref name="epic">{{cite document|date=5 November 2014|title=Ponatinib in Newly Diagnosed Chronic Myeloid Leukemia|url=http://clinicaltrials.gov/ct2/show/NCT01650805}}</ref>、2013年10月18日に中止された<ref name="newsrelease_101813" />。 |
|||
== 歴史 == |
|||
ポナチニブは、ARIAD社の計算機と構造活性相関に基づく薬剤設計プラットフォームを用いて設計され、BCR-ABLの酵素活性を非常に高い効力と幅広い特異性で阻害する。ポナチニブは、生来のBCR-ABLだけでなく、既存のチロシンキナーゼ阻害剤に抵抗性を示す変異を持つBCR-ABLのアイソフォームも標的とすることが意図されており、特に有効な治療法が存在しないT315I変異を含む<ref name="pmid21118377">{{cite journal|date=January 2011|title=Structural mechanism of the Pan-BCR-ABL inhibitor ponatinib (AP24534): lessons for overcoming kinase inhibitor resistance|journal=Chemical Biology & Drug Design|volume=77|issue=1|pages=1–11|doi=10.1111/j.1747-0285.2010.01054.x|pmid=21118377|vauthors=Zhou T, Commodore L, Huang WS, Wang Y, Thomas M, Keats J, Xu Q, Rivera VM, Shakespeare WC, Clackson T, Dalgarno DC, Zhu X|s2cid=22604788}}</ref>。 |
|||
アリアドが開発したATP競合型デュアルSrc/Abl阻害剤の最初の1つであるAP23464は、その発見への道筋を示している。AP23464は、構造ベースのドラッグデザインと三置換[[プリン (化学)|プリン]]類似体の合成ライブラリを用いて同定さた。AP23464は、SrcおよびBcr-Ablキナーゼを強力に阻害し、イマチニブ抵抗性のBcr-Abl変異の多くを含る。A |
|||
== |
== 参考資料 == |
||
{{reflist|35em}} |
{{reflist|35em}} |
||
2021年9月18日 (土) 11:01時点における版
 | |
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 発音 | [poʊˈnætɪnɪb] poh-NAT-i-nib |
| 販売名 | Iclusig |
| Drugs.com | monograph |
| MedlinePlus | a613029 |
| ライセンス | EMA:リンク、US Daily Med:リンク |
| 胎児危険度分類 |
|
| 法的規制 |
|
| 投与経路 | By mouth (tablets) |
| 薬物動態データ | |
| 生物学的利用能 | Unknown |
| 血漿タンパク結合 | >99% (in vitro) |
| 代謝 | Liver (CYP3A4, 2C8, 2D6, 3A5) |
| 半減期 | 12–66 hours |
| 排泄 | Feces (87%), urine (5%)[1] |
| 識別 | |
| CAS番号 | 943319-70-8 |
| ATCコード | L01EA05 (WHO) |
| PubChem | CID: 24826799 |
| DrugBank | DB08901 |
| ChemSpider | 24747381 |
| UNII | 4340891KFS |
| KEGG | D09950 |
| ChEBI | CHEBI:78543 |
| ChEMBL | CHEMBL1171837 |
| 別名 | AP24534 |
| 化学的データ | |
| 化学式 | C29H27F3N6O |
| 分子量 | 532.57 g·mol−1 |
| |
| |
ポナチニブ(Ponatinib、開発コード:AP24534)は、慢性期慢性骨髄性白血病 (CML)およびフィラデルフィア染色体陽性(Ph+)急性リンパ性白血病(ALL)治療のための経口薬で、多標的のチロシンキナーゼ阻害剤である[2]。CMLの中にはT315I変異を有するものがあり、イマチニブ等の治療に抵抗性を示すが、ポナチニブは、このようなタイプの腫瘍に効果を示す様に設計されている[3]。
米国食品医薬品局は、2012年12月に本剤を承認候補薬として認定したが、「生命を脅かす血栓や重度の血管狭窄のリスクがある」として、2013年10月31日に販売を一時停止させた[4][5]。その後、添付文書に新たな「黒枠警告」が設置され、本剤を使用する事によるリスクとベネフィットをより適切に評価するための「リスク評価および軽減戦略」が策定され、2013年12月20日に停止が一部解除された。
日本では、2016年1月に大塚製薬が製造販売承認申請を行い[6]、同年9月に承認された[7]。
効能・効果
日本で取得されている承認は、下記の2つである[8]。
- 前治療薬に抵抗性または不耐容の慢性骨髄性白血病
- 再発または難治性のフィラデルフィア染色体陽性急性リンパ性白血病
ポナチニブは、米国では2012年12月14日に、抵抗性または不耐症のCMLおよびPh+ ALLの患者を対象に、PACE第2相試験の結果がASH年次総会で報告され、米国FDAから仮承認された[9]。その承認は、FDAの早期承認プログラムの下で行われた為、申請者は追加試験を実施する必要があった。これらの追加試験に基づき、添付文書を更新して、他のチロシンキナーゼ阻害剤による治療が適応とならない慢性期、移行期、急性転化期の慢性骨髄性白血病およびフィラデルフィア染色体陽性の急性リンパ性白血病の患者を対象として本承認された。また、T315I陽性のフィラデルフィア染色体陽性の急性リンパ芽球性白血病についても承認を取得した[10]。
副作用
重大な副作用は[8]、
- 冠動脈疾患(3.8%)
- 心筋梗塞(2.1%)、狭心症(0.8%)、急性冠症候群(0.4%)、心筋虚血(0.4%)、不安定狭心症(0.2%)等
- 脳血管障害(2.9%)
- 脳梗塞(1.1%)、脳血管発作(0.8%)、脳動脈狭窄(0.4%)、一過性脳虚血発作(0.2%)、大脳動脈狭窄(0.2%)、脳虚血(0.2%)、脳幹梗塞(0.2%)等
- 末梢動脈閉塞性疾患(2.7%)
- 間欠性跛行(1.3%)、末梢動脈狭窄(0.4%)、四肢壊死(0.2%)、網膜動脈閉塞症(0.2%)、腎動脈狭窄(頻度不明)等
- 静脈血栓塞栓症(1.7%)
- 網膜静脈血栓症(0.6%)、深部静脈血栓症(0.4%)、肺塞栓症(0.4%)、静脈塞栓症(0.2%)等
- 骨髄抑制(48.8%)
- 血小板数減少(38.3%)、好中球数減少(20.6%)、貧血(13.9%)、白血球数減少(5.1%)、発熱性好中球減少症(2.1%)、汎血球減少症(1.9%)、リンパ球数減少(1.9%)、骨髄機能不全(0.2%)等
- 高血圧(14.1%)
- 高血圧クリーゼを含む
- 肝機能障害(17.5%)
- ALT、AST、ビリルビン、γ-GTP等の上昇を伴う肝機能障害(17.5%)、黄疸(0.4%)、肝不全
- 膵炎(6.1%)
- 体液貯留(11.6%)
- 末梢性浮腫(6.3%)、胸水(4.0%)、心嚢液貯留(2.3%)、肺うっ血(0.2%)、肺水腫(0.2%)等
- 感染症(12.4%)
- 肺炎(1.7%)、敗血症(1.1%)等
- 重度の皮膚障害(1.7%)
- 剥脱性皮膚炎(1.1%)、多形紅斑(0.8%)等
- 出血(2.3%)
- 鼻出血(2.1%)、胃腸出血(0.2%)、咽頭出血(0.2%)、出血性胃炎(0.2%)、性器出血(0.2%)、硬膜下血腫(頻度不明)等
- 心不全(1.9%)、うっ血性心不全(0.8%)
- 不整脈(4.6%)
- 心房細動(2.3%)、徐脈(1.1%)、QT間隔延長(0.8%)、頻脈(0.4%)、心室性不整脈(0.2%)、心停止(0.2%)、房室ブロック(0.2%)等
- 腫瘍崩壊症候群(0.2%)
- ニューロパチー(3.2%)
- 末梢性ニューロパチー(1.9%)、末梢性感覚ニューロパチー(0.8%)、多発ニューロパチー(0.2%)、末梢性運動ニューロパチー(0.2%)、末梢性感覚運動ニューロパチー(0.2%)等
- 肺高血圧症(1.3%)
である。
2013年10月9日、米国食品医薬品局(FDA)は、ポナチニブを服用している患者に血栓の増加が認められた為、新規試験の登録を一部保留した[11]。その後、10月18日にEPIC試験が中止された[12]。その後、慢性期の慢性骨髄性白血病を対象に、4年間に亘ってポナチニブを投与した449名の患者を対象とした試験で、以下の副作用が認められた。150 名の患者が、心血管系(21%)、末梢血管系(12%)、脳血管系(9%)の動脈閉塞性イベントを経験した。静脈血栓塞栓症は患者の6%に発生した。最も多かった全グレードの有害事象は、高血圧(69%)、発疹(63%)、腹痛(48%)、疲労(47%)、頭痛(43%)、動脈性虚血(42%)、皮膚の乾燥(42%)、便秘(41%)、関節痛(32%)、吐き気(28%)、発熱(26%)、末梢神経障害(24%)、筋肉痛(24%)、四肢の痛み(23%)、腰痛(21%)、下痢(20%)などであった。また、可逆性後頭葉白質脳症の報告例もある[10]。
作用機序
ポナチニブの主な標的は、CMLおよびPh+ ALLの特徴である異常なチロシンキナーゼであるBCR-ABLである。CMLは、BCR-ABLタンパク質を産生する遺伝子異常により、骨髄で白血球が過剰かつ無秩序に産生されることが特徴である。白血球が過剰に産生される慢性期を経て、CMLは通常、移行期、急性転化期などのより積極的な病相へと移行する。Ph+ ALLは、BCR-ABLを産生するPh+染色体を有する急性リンパ性白血病のサブタイプである。CMLよりも侵攻性が高く、化学療法とチロシンキナーゼ阻害剤を併用して治療することが多い。これらの疾患はいずれもBCR-ABLタンパク質を発現しているため、ポナチニブによる治療を受けられる可能性がある。CML患者の95%にBCR-ABLが検出される[要出典]。
ニロチニブやダサチニブの一次治療を受けているCML患者は、22~33%の患者が有害事象や治療失敗などの理由で2年までに治療を中止している[要出典]。
臨床試験
2010年、ARIAD社は、抵抗性・難治性の慢性骨髄性白血病(CML)およびフィラデルフィア陽性の急性リンパ性白血病(Ph+ ALL)の患者を対象としたponatinibの第1相試験の結果を発表した。この試験では、ポナチニブを投与した慢性期のCML患者において、T315I変異も有する患者の100%を含む66%の患者が細胞遺伝学的に大きな奏効を得たことが実証された[要出典]。
PACE試験(Ponatinib Ph+ ALL and CML Evaluation)は、2010年9月に患者の登録を開始した重要な第2相試験で、この環境下での規制当局による承認のための決定的な臨床データを提供する事を目的としている。この試験については、2012年12月に良好な結果が報告さた[9][13]。
EPIC(Evaluation of Ponatinib versus Imatinib in CML)試験は、2012年6月に開始され[14]、2013年10月18日に中止された[12]。
歴史
ポナチニブは、ARIAD社の計算機と構造活性相関に基づく薬剤設計プラットフォームを用いて設計され、BCR-ABLの酵素活性を非常に高い効力と幅広い特異性で阻害する。ポナチニブは、生来のBCR-ABLだけでなく、既存のチロシンキナーゼ阻害剤に抵抗性を示す変異を持つBCR-ABLのアイソフォームも標的とすることが意図されており、特に有効な治療法が存在しないT315I変異を含む[15]。
アリアドが開発したATP競合型デュアルSrc/Abl阻害剤の最初の1つであるAP23464は、その発見への道筋を示している。AP23464は、構造ベースのドラッグデザインと三置換プリン類似体の合成ライブラリを用いて同定さた。AP23464は、SrcおよびBcr-Ablキナーゼを強力に阻害し、イマチニブ抵抗性のBcr-Abl変異の多くを含る。A
参考資料
- ^ “Iclusig (ponatinib) Tablets, for Oral Use. Full Prescribing Information”. ARIAD Pharmaceuticals, Inc. 26 Landsdowne Street, Cambridge, MA 02139-4234. 2016年10月2日閲覧。
- ^ “Discovery of 3-[2-(imidazo[1,2-b]pyridazin-3-yl)ethynyl]-4-methyl-N-{4-[(4-methylpiperazin-1-yl)methyl]-3-(trifluoromethyl)phenyl}benzamide (AP24534), a potent, orally active pan-inhibitor of breakpoint cluster region-abelson (BCR-ABL) kinase including the T315I gatekeeper mutant”. J. Med. Chem. 53 (12): 4701–19. (June 2010). doi:10.1021/jm100395q. PMID 20513156.
- ^ “AP24534, a pan-BCR-ABL inhibitor for chronic myeloid leukemia, potently inhibits the T315I mutant and overcomes mutation-based resistance”. Cancer Cell 16 (5): 401–12. (November 2009). doi:10.1016/j.ccr.2009.09.028. PMC 2804470. PMID 19878872.
- ^ “FDA asks manufacturer of the leukemia drug Iclusig (ponatinib) to suspend marketing and sales”. FDA Drug Safety Communication. U.S. Food and Drug Administration (2013年10月31日). Template:Cite webの呼び出しエラー:引数 accessdate は必須です。
- ^ Grady D (2013年10月31日). “Serious Danger of Blood Clots Halts Sale of Leukemia Drug”. Business. New York Times. 2021年9月18日閲覧。
- ^ “大塚製薬 白血病治療薬として「ポナチニブ」を国内製造販売承認申請|ニュースリリース|大塚製薬”. 大塚製薬株式会社 Otsuka Pharmaceutical. 2021年9月18日閲覧。
- ^ “白血病治療薬「アイクルシグ®錠15㎎」 国内製造販売承認を取得|ニュースリリース|大塚製薬”. 大塚製薬株式会社 Otsuka Pharmaceutical. 2021年9月18日閲覧。
- ^ a b “アイクルシグ錠15mg”. www.info.pmda.go.jp. 2021年9月18日閲覧。
- ^ a b Gever J (2012年12月14日). “Ponatinib Wins Early FDA Nod”. Oncology/Hematology. MedPageToday.com. 2021年9月18日閲覧。
- ^ a b “FDA Grants Ponatinib Full Approval for Rare Leukemias”. 2021年9月18日閲覧。
- ^ Carroll J. “UPDATED: Ariad hammered on toxicity concerns for leukemia drug Iclusig”. FierceBiotech. 2021年9月18日閲覧。
- ^ a b “ARIAD Announces Discontinuation of the Phase 3 Epic Trial of Iclusig in Patients with Newly Diagnosed Chronic Myeloid Leukemia”. Template:Cite webの呼び出しエラー:引数 accessdate は必須です。
- ^ Gever J (2012年12月10日). “Ponatinib Retains Luster in Leukemia”. Oncology/Hematology. MedPageToday.com. 2021年9月18日閲覧。
- ^ "Ponatinib in Newly Diagnosed Chronic Myeloid Leukemia" (Document). 5 November 2014.
{{cite document}}: Cite documentでは|publisher=が必須です。 (説明); 不明な引数|url=は無視されます。 (説明) - ^ “Structural mechanism of the Pan-BCR-ABL inhibitor ponatinib (AP24534): lessons for overcoming kinase inhibitor resistance”. Chemical Biology & Drug Design 77 (1): 1–11. (January 2011). doi:10.1111/j.1747-0285.2010.01054.x. PMID 21118377.
