シス–トランス異性体
表示
(シス-トランス異性体から転送)
シス–トランス異性体(シス–トランスいせいたい、英: cis–trans isomer) または幾何異性体(きかいせいたい、英: geometrical isomer)は有機化合物や錯体の立体異性体の一種である。
「幾何異性体」という名称はIUPACでは推奨されていない[1]。
シス–トランス異性体と呼ばれるものは次の3種類である。
- 有機化合物の二重結合への置換による異性
- 環状化合物の環への置換による異性
- 錯体配位子の位置の違いによる異性
二重結合
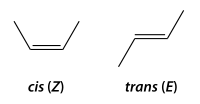
[編集]まず炭素の二重結合に2つずつの異なった基が結合する場合を例に取ると、主鎖(炭素数最多の鎖)となる炭素骨格が同じ側(同じ炭素ではない)につくとシス (cis) 型、反対側につくとトランス (trans) 型の幾何異性体となる。IUPACでは基の優先度(置換基の順位規則。カーン・インゴルド・プレローグ順位則)が定められており、その基準で置換基の配置がシス型のときZ、トランス型のときEとして表す。Zはドイツ語のzusammen(いっしょに)、Eはentgegen(逆に)(いずれも副詞)に由来する。
ただし、炭素‐窒素間あるいは窒素‐窒素間の2重結合による幾何異性の場合(オキシムなど)は、代わりにsyn, antiを使用する。
環状化合物
[編集]環状化合物で隣接する炭素がどちらも三級炭素の場合、環から飛び出す置換の向きが環平面に対して同じ側か異なるかでcis, transを使用する(E, Zは使用されない)。
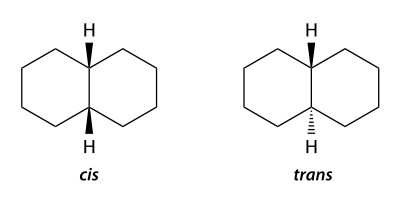
飽和縮合環化合物の場合も同様に、環平面に対して同じ側か異なるかでcis, transを使用する(E, Zは使用されない)。
環の幾何異性の位置が2つ以上ある複雑な場合はcis, trans表記よりも、(R), (S) の絶対配置で表記するのが適当である。
錯体の幾何異性
[編集]詳細は「錯体#幾何異性体」を参照
脚注
[編集]- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). オンライン版: (2006-) "geometric isomerism".