Masna kiselina
| Tipovi masti u hrani |
|---|
|
| Vidi još |
Masne kiseline su jedinjenja koja ulaze u sastav masti i ulja. U hemiji, posebno biohemiji, masna kiselina je karboksilna kiselina, uglavnom sa dugim nerazgranatim nizom (lancem). Najčešće je reč o lancima sa parnim brojem ugljenikovih atoma, od 4 do 30, najviše 36 C-atoma. Razlog parnom broju jeste što njihova biosinteza uključuje acetil koenzim A, koji daje doprinos od dva atoma ugljenika.[1][2]
Masne kiseline mogu biti zasićene ili nezasićene, u zavisnosti da li poseduju dvostruku vezu. Pojam zasićene masne kiseline govori da, osim u karboksilnoj grupi, gde je karbonilni ugljenik vezan za kiseonik, nema dvostrukih veza. Od nezasićenih, u mastima se mogu naći one koje sadrže dvostruke i trostruke veze, kao i istovremeno prisustvo i dvostrukih i trostrukih veza. Masne kiseline životinjskog porekla ukoliko su nezasićene, sadrže do 6 dvostrukih veza. S druge strane, u strukturi biljaka pored zasićenih i nezasićenih (sa jednom ili više dvostrukih veza), pronađene su i kiseline sa trostrukom vezom, ali i epoksi-, hidroksi- i keto-grupama, kao i sa ciklopentanovim prstenom.
Masne kiseline se industrijski proizvode putem hidrolize esterskih veza masti ili bioloških ulja (koji su zapravo trigliceridi), uklanjanjem alkohola glicerola.
Masne kiseline spadaju u grupu uljnih hemikalija.
Fizička svojstva
[уреди | уреди извор]Masne kiseline su uglavnom mono-karbonske kiseline, koje imaju između 4 i 36 ugljenikovih atoma, obično su pravog niza i parnog broja C atoma.
Masne kiseline se sastoje iz hidrofobnog dela – dugačkog ugljeničnog niza, i iz hidrofilnog dela – polarne karboksilne grupe. Karboksilna grupa pokazuje veliku sklonost ka dimerizaciji zahvaljujući prisustvu OH-grupe i CO-grupe, zbog čega se smanjuje i onako mala rastvorljivost u vodi.
Fizička svojstva masnih kiselina zavise od dužine lanca, stepenu nezasićenosti i razgranatosti lanca.[1] Uglavnom su slabo rastvorne u vodi, a dobro rastvorne u nepolarnim organskim rastvaračima, poput benzena. Objašnjenje za to jeste da kada se ugljovodonični niz nađe u polarnom rastvaraču, može izuvijati dajući manje ili više kompaktan molekul, stabilizovan intramolekulskim hidrofobnim kontaktima. Za razliku od toga, u nepolarnom rastvaraču može doći do intermolekulskih hidrofobnih interakcija pri čemu se molekuli manje ili više izduženi. U tabeli 1 dati su primeri nekoliko viših masnih kiselina sa, između ostalog, njihovom rastvorljivošću u različitim rastvaračima.
Sa povećanjem dužine niza, smanjuje se rastvorljivost masnih kiselina, tako da se samo sirćetna i buterna kiselina mešaju sa vodom u neograničenom odnosu, dok ostalim kiselinama rastvorljivost naglo opada. Najbolji rastvarač za masne kiseline je dietil-etar.
| Struktura | Tačka topljenja (℃) | Voda | Benzen |
|---|---|---|---|
| 44,2 | 0,0630 | 2600 | |
| 53,9 | 0,0240 | 874 | |
| 63,1 | 0,0083 | 348 | |
| 69,6 | 0,0034 | 124 |
Iz tabelarnog prikaza vidi se da tačka topljenja masnih kiselina linearno raste sa povećanjem broja ugljenikovih atoma. Ta činjenica je dokaz da u stabilizaciji molekula učestvuju i privlačne sile ugljovodoničnih nizova masnih kiselina. Zasićene masne kiselina sa neparnim brojem ugljenikovih atoma i razgranatim nizom imaju nešto niže temperature topljenja od odgovarajućih kiselina sa normalnim nizom, što ukazuje na dobro pakovanje bočnih metil-grupa u kristalnu rešetku. Nezasićene masne kiseline imaju niže tačke topljenja, uz pravilo da su temperature još niže ukoliko ima veći broj dvostrukih veza ili ukoliko su one bliže centru ugljovodoničnog niza.
Nomenklatura
[уреди | уреди извор]IUPAC nomenklatura masnih kiselina se navodi prema standardnoj Ženevskoj sistematizaciji, izvodeći iz imena ugljovodonika koji ima isti broj ugljenikovih atoma. Prema tome, imenu ugljovodonika (koje je izvedeno iz grčkih brojeva) sa istim brojem C-atoma dodaje se sufiks -ska i reč kiselina.
Na primer, pentanska kiselina (C5) ima pet ugljenikovih atoma, to je niža masna kiselina, a izvodi se iz ugljovodonika pentana. Međutim, ova kiselina ima trivijalno ime valerijanska jer se u prirodi nalazi u biljci valerijani.
Broj dvostrukih veza u masnoj kiselini označava se modifikovanjem prefiksa. Tako se oleinska kiselina sa jednom dvostrukom vezom zove oktadecenska kiselina; linolna kiselina sa dve dvostruke veze oktadekandienska kiselina itd. Položaj dvostruke veze označava se brojem prvog ugljenikovog atoma te veze, počinjući numerisanje ugljenikovihatoma od karboksilne grupe, pri čemu je ugljenikov atom karboksilne grupe C1.
Skraćena oznaka masnih kiselina se predstavlja u vidu zapisa npr. 12:0, što predstavlja broj ugljenikovih atoma i broj dvostrukih veza. Ukoliko, pak u strukturi postoji dvostruka veza, neophodno je naznačiti na kom ugljenikovom atomu se ona i nalazi. Primer palmitoleinske kiseline (cis-9-heksadecenoinska kiselina) 16:1(∆9). Ipak, veoma su zastupljeni gorepomenuti trivijalni nazivi, koji uglavnom potiču od derivata. Tako imamo, primera radi, palmitinsku kiselinu, budući da se nalazi u drveću palmi, stearinsku kiselinu (grč. stear, u prevodu tvrda mast)...
Vrste masnih kiselina
[уреди | уреди извор]Zasićene masne kiseline
[уреди | уреди извор]Zasićene masne kiseline ne sadrže dvostruke kovalentne veze ili druge funkcionalne grupe u molekularnom lancu. Sam pojam "zasićen" se odnosi na vodonik koji je u maksimalnom mogućem broju vezan na ugljenikove atome u lancu (osim kod karboksilne grupe -COOH). Drugim riječima, zato što je ugljenik 4-valentan, na svakom atomu ugljenika vežu se druga dva atoma ugljenika i po dva atoma vodonika, osim na drugom kraju lanca masne kiseline (CH3-).
Zasićene masne kiseline formiraju ravne lance atoma, i kao rezultat toga mogu se zgusnuto skladištiti u organizmu, što povećava količinu energije po jedinici zapremine. Masno tkivo čoveka i životinja sadrži velike količine dugolančanih zasićenih masnih kiselina.
Skraćeni opisni naziv masnih kiselina sadrži samo broj atoma ugljenika i broj dvostrukih veza u njima (npr. C18:0 ili 18:0 - stearinska kiselina sadrži 18 atoma ugljenika i 0 dvostrukih veza između atoma ugljenika, dok C18:1 - oleinska kiselina sadrži osim 18 atoma ugljenika i jednu dvostruku vezu, te je ona nezasićena masna kiselina).
| Ime | Hemijska struktura | C:D |
|---|---|---|
| Laurinska kiselina (dodekadska) | CH3(CH2)10COOH | 12:0 |
| Miristinska kiselina (tetradekadska) | CH3(CH2)12COOH | 14:0 |
| Palmitinska kiselina (heksadekadska) | CH3(CH2)14COOH | 16:0 |
| Stearinska kiselina (oktadekadska) | CH3(CH2)16COOH | 18:0 |
| Arahidska kiselina (eikozanoidna) | CH3(CH2)18COOH | 20:0 |
| Behenijska kiselina (dokozanoidna) | CH3(CH2)20COOH | 22:0 |
| Lignocerinska kiselina | CH3(CH2)22COOH | 24:0 |
| Kerotinska kiselina | CH3(CH2)24COOH | 26:0 |
Nezasićene masne kiseline
[уреди | уреди извор]
Nezasićene masne kiseline su kiseline sličnog oblika, osim što postoji jedna ili više alkenskih funkcionalnih grupa unutar lanca gde svaki alken zamenjuje jednostruku ugljenikovu vezu "-CH2-CH2-" u delu lanca sa dvostrukom vezom "-CH=CH-".
Takve dvostruke veze mogu biti formirane u cis ili trans konfiguraciji.
- cis
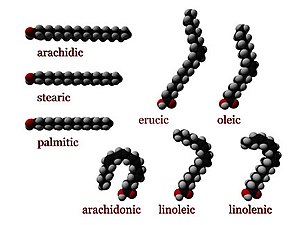
- Cis konfiguracija ima dva atoma vodonika na istoj strani dvostruke veze. Krutost dvostruke veze zamrzava njihovu konformaciju, a "cis" forma izomera uzrokuje da se lanac presavija. To ograničava konformacionu slobodu masne kiseline. Što je više dvostrukih veza u cis obliku, to je manja lanac savitljiv. Kada lanac ima mnogo cis veza, postaje izrazito zakrivljen u svim mogućim konformerima. Na primer oleinska kiselina, koja ima jednu dvostruku vezu ima manji pregib u lancu od linolne kiseline s dve dvostruke veze. Linolenska kiselina, koja ima tri dvostruke veze, posve je zavinuta u obliku kuke. Učinak svega ovoga je da u ograničenom okruženju, kao kada su masne kiseline deo fosfolipida u lipidnom dvosloju, ili triglicerida u kapljici lipida, "cis" veza ograničava sposobnost masne kiseline da se uskladišti u manjem prostoru, te na taj način utiče na tačku topljenja membrane ili masnoće.
- trans
- Trans konfiguracija, suprotno od gore opisane, ima dva susjedna atoma vodonika vezana na suprotnim stranama dvostruke veze. Rezultat toga je da ne oblikuje lanac koji je savijen, te je oblik sličan ravnom lancu kao što je u zasićenim masnim kiselinama.
U prirodi se nezasićene masne kiseline pojavljuju samo u "cis" formi. "Trans" oblik isključivo nastaje uticajem čoveka i njegove namere da prerađuje masnoće (npr. hidrogenizacijom).
Ove razlike u geometriji između "cis" i "trans" oblika nezasićenih masnih kiselina, te između zasićenih i nezasićenih masnih kiselina igraju vrlo značajnu ulogu u biološkim procesima (npr. u ljudskom tijelu) i u izgradnji bioloških struktura (u izgradnji ćelijske membrane).
Dok kod zasićenih masnih kiselina ne postoje dvostruke veze, položaj dvostruke veze kod nezasićenih masnih kiselina je bitan za njihova svojstva. Zbog toga govorimo o početku i kraju lanca tih kiselina. Početak je mesto gde se nalazi karboksilna grupa -COOH, dok je kraj mesto na lancu gde se nalaze vezana tri atoma vodonika na atomu ugljenika (CH3-). Kraj se naziva omega (ω), te prema mestu prve dvostruke veze od tog kraja govorimo o omega-3, omega-6 ili o omega-9 masnim kiselinama.
| Trivijalno ime | Hemijska struktura | Δx | C:D | n−x |
|---|---|---|---|---|
| Miristoleinska kiselina | CH3(CH2)3CH=CH(CH2)7COOH | cis-Δ9 | 14:1 | n−5 |
| Palmitoleinska kiselina | CH3(CH2)5CH=CH(CH2)7COOH | cis-Δ9 | 16:1 | n−7 |
| Sapienska kiselina | CH3(CH2)8CH=CH(CH2)4COOH | cis-Δ6 | 16:1 | n−10 |
| Oleinska kiselina | CH3(CH2)7CH=CH(CH2)7COOH | cis-Δ9 | 18:1 | n−9 |
| Linolna kiselina | CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH | cis,cis-Δ9,Δ12 | 18:2 | n−6 |
| α-Linoleinska kiselina | CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7COOH | cis,cis,cis-Δ9,Δ12,Δ15 | 18:3 | n−3 |
| Arahidonska kiselina | CH3(CH2)4CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)3COOH[3] | cis,cis,cis,cis-Δ5Δ8,Δ11,Δ14 | 20:4 | n−6 |
| Eikozapentaenoinska kiselina | CH3CH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)3COOH | cis,cis,cis,cis,cis-Δ5,Δ8,Δ11,Δ14,Δ17 | 20:5 | n−3 |
| Erukinska kiselina | CH3(CH2)7CH=CH(CH2)11COOH | cis-Δ13 | 22:1 | n−9 |
| Dokozaheksaenoinska kiselina | CH3CH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)2COOH | cis,cis,cis,cis,cis,cis-Δ4,Δ7,Δ10,Δ13,Δ16,Δ19 | 22:6 | n−3 |
Dakle, linolenska, eikozapentaenoinska i dokozaheksaenoinska kiselina su omega-3 masne kiseline; linolna i arahidonska su omega-6; a oleinska i erukinska kiselina su omega-9 masne kiseline.
Razlika između zasićenih i nezasićenih kiselina gledajući isti broj atoma ugljenika, je u dvostrukim vezama, te skladno tome u manjem broju atoma vodonika za dva (npr. stearinska C18H36O2 za razliku od oleinske C18H34O2).
Esencijalne masne kiseline
[уреди | уреди извор]Ljudsko telo može sintetisati sve masne kiseline koje mu trebaju za rast i život osim dve, a to su linolna i linolenska kiselina. Zato ih nazivamo esencijalnim jer su vrlo važne za naš organizam i moramo ih unositi putem hrane. One su široko rasprostranjene u biljnoj i životinjskoj hrani (u uljnom obliku). U našem organizmu one pomažu pravilnom radu ćelija i organa, a od njih se stvaraju jedinjenja slična hormonima koji upravljaju širokim spektrom životnih funkcija, kao što su krvni pritisak, zgrušavanje krvi, nivo lipida u krvi (masnoća), imunološko stanje, te upalni odgovor na pretnju infekcije.
Esencijalne masne kiseline su višestruko nezasićene masne kiseline i od njih se u organizmu stvaraju nizovi omega-6 i omega-3 masnih kiselina. Ljudski organizam može jednostavno proizvesti zasićene masne kiseline ili jednostruko nezasićene masne kiseline s dvostrukom vezom na devetom atomu ugljenika brojeći od kraja lanca (omega-9 kiseline), ali ne može stvoriti dvostruku vezu na šestom ili trećem atomu ugljenika zbog nepostojanja enzima koji bi to omogućio.
Esencijalne masne kiseline regulišu krvni pritisak i ojačavaju imunski sistem jer se pomoću njih stvaraju jedinjenja kao što su prostaglandini. U mozgu se nalaze povećane količina derivata linolne i linolenske kiseline. Neravnoteža ili pomanjkanje omega-3 kiselina u odnosu na količinu omega-6 (danas se pretpostavlja da je ispravan odnos tih dviju kiselina 1 : 2) je krivac za mnoge bolesti kao što su: depresija i poremećaji ponašanja (uključujući nasilje), dijabetes 2. tipa (staračka šećerna bolest), artritis i rak.
Transmasne kiseline
[уреди | уреди извор]Transmasne kiseline su nezasićene masne kiseline koje sadrže trans dvostruku vezu između atoma ugljenika koja čini lanac molekule manje zakrivljenim u odnosu na masne kiseline sa cis dvostrukom vezom. Takve 'trans' strukture nastaju industrijskom preradom, postupkom koji se naziva hidrogenizacija biljnih ulja.
Istraživanja pokazuju da transmasne kiseline u nedostatku esencijalnih masnih kiselina zauzmu njihovo mesto u vitalnim procesima i uzrokuju cirkulacijske bolesti kao što su arterioskleroza i bolest srčanog mišića.
Slobodne masne kiseline
[уреди | уреди извор]Masne kiseline mogu biti povezane ili pridružene drugim molekulima kao što su trigliceridi ili fosfolipidi. Ako nisu povezane, nazivamo ih slobodnim masnim kiselinama. Slobodne masne kiseline nastaju razlaganjem triglicerida na početne komponente, masne kiseline i glicerol.
Slobodne masne kiseline su važan izvor energije za mnoga tkiva, jer mogu dostaviti relativno velike količine ATP-a. Gorivo za ćelije može biti glukoza ili masne kiseline. Veći broj tipova ćelija daju prednost masnim kiselinama (ćelije srca, mišića). S druge strane, mozak ne može koristiti kiseline već koristi glukozu ili ketonska tela (ketonska tela se stvaraju u jetri putem metabolizma masnih kiselina za vreme gladovanja ili za vreme niskog unosa ugljenih hidrata).
Masne kiseline u prehrambenim masnoćama
[уреди | уреди извор]Sledeća tablica prikazuje udeo masnih kiselina i holesterola u svakodnevnim prehrambenim masnoćama.[4][5]
| zasićene | jednostruko nezasićene | višestruko nezasićene | holesterol | Vitamin E | |
|---|---|---|---|---|---|
| g/100g | g/100g | g/100g | mg/100g | mg/100g | |
| Masnoće životinjskog porekla | |||||
| Svinjska mast | 40.8 | 43.8 | 9.6 | 93 | 0.00 |
| Maslac | 54.0 | 19.8 | 2.6 | 230 | 2.00 |
| Biljne masnoće | |||||
| Ulje kokosa | 85.2 | 6.6 | 1.7 | 0 | .66 |
| Palmino ulje | 45.3 | 41.6 | 8.3 | 0 | 33.12 |
| Ulje pamučnog semenja | 25.5 | 21.3 | 48.1 | 0 | 42.77 |
| Ulje pšeničnih klica | 18.8 | 15.9 | 60.7 | 0 | 136.65 |
| Sojino ulje | 14.5 | 23.2 | 56.5 | 0 | 16.29 |
| Maslinovo ulje | 14.0 | 69.7 | 11.2 | 0 | 5.10 |
| Kukuruzno ulje | 12.7 | 24.7 | 57.8 | 0 | 17.24 |
| Ulje suncokreta | 11.9 | 20.2 | 63.0 | 0 | 49.0 |
| Šafranovo ulje | 10.2 | 12.6 | 72.1 | 0 | 40.68 |
| Repičino ulje | 5.3 | 64.3 | 24.8 | 0 | 22.21 |
Račvaste i ciklične masne kiseline
[уреди | уреди извор]Što se tiče drugih prirodnih masnih kiselina, postoje i masne kiseline koje su račvaste strukture. Primer takve je zasićena tuberkulostearinska (10-metiloktadekanska) kiselina, viša masna kiseline, za koju je karakteristično to što je proizvode bakterije aktinomicete, a sam naziv je dobila kada je prvi put izolovana 1927. godine iz bacila tuberkuloze (lat. Mycobacterium tuberculosis).
Taririnska ili 6-oktadecinska kiselina je prirodna masna kiselina koja sadrži trostruku vezu. To je ne tako redak primer, ali javljaju se gotovo isključivo samo kod biljaka.
Masne kiseline pored hidroksilne grupe u okviru karboksilne grupe mogu da sadrže OH-grupu i na nekom drugom ugljenikovom atomu i onda se nazivaju hidroksi kiseline. Primer je ricinolna kiselina, 12-hidroksi, cis-9-oktadecenska. Ricinolna kiselina čini 80-90% količinskog udela ricinusovog ulja, a kao i druge hidroksi-kiseline, optički je aktivna, pa je i samo ulje optički aktivno i veoma viskozno. Ricinusovo ulje se koristi u medicini za lečenje i kao pomoćno sredstvo kod mnogih oboljenja, najpoznatije je njegovo purgativno dejstvo, ali se još više koristi u kozmetologiji, za raznorazne preparate za rast kose, noktiju, brade, u proizvodnji krema za lice, losiona za telo i slično.
Ciklične masne kiseline nisu česta pojava kod prirodnih proizvoda. Ipak, čaulmugrova (Hydnocarpus wightianus) je primer (IUPAC naziv 13-∆2,3-ciklopetenil-n-tridekanska kiselina), čije ulje se koristi u indijskoj i kineskoj medicini kao lek protiv lepre, a kasnije i nekih drugih kožnih oboljenja.
Kiselost
[уреди | уреди извор]Kratkolančane karboksilne kiseline kao što su mravlja i sirćetna kiselina se mogu mešati sa vodom i disocirati se, tako da su umereno jake kiseline(pKa 3.77 i 4.76, respektivno). Ali kako se kompleksnost kiseline povećava, a lanac molekule kiseline produžava, tako se ubrzano smanjuje rastvorljivost kiselina.
One masne kiseline koje nisu rastvorne u vodi, rastvorne su u toplom etanolu i mogu se titrisati ili neutralisati rastvorom natrijum ili kalcijum hidroksida, uz fenolftalein kao indikator. Promjena boje indikatora ukazuje na tačku neutralizacije slobodnih masnih kiselina. Ova analiza se upotrebljava u određivanju udela slobodnih masnih kiselina u masnoći, tj. udela hidrolizovanih triglicerida, i obično se izražava kao "ukupna kiselost" u mgKOH/g.
Reakcije masnih kiselina
[уреди | уреди извор]Masne kiseline reaguju kao i sve druge karboksilne kiseline, npr. učestvuju u reakcijama esterifikacije i kiselo-baznim reakcijama. Redukcijom masnih kiselina dobivaju se masni alkoholi.
Nezasićene masne kiseline mogu biti izložene hidrogenizaciji, kako bi se biljna ulja pretvorila u margarine (i na taj način produžio vek trajanja prehrambenih namirnica). Delimičnom hidrogenizacijom, nezasićene masne kiseline prelaze iz cis stanja u trans oblik.
Oksidacija i užeglost
[уреди | уреди извор]Masne kiseline se već na sobnoj temperaturi menjaju putem oksidacije. Molekul masne kiseline se deli na ugljovodonike, ketone, aldehide, te u manjoj mjeri na epokside i alkohole. Teški metali i u malim količinama ubrzavaju oksidaciju (čime pokazuju stupanj zagađenja). Masnoće i ulja se zbog toga često tretiraju s helatima kao što je limunska kiselina.
Reference
[уреди | уреди извор]- ^ а б Fatty Acid and Lipid Chemistry. Berlin: Springer Verlag. 1996. ISBN 0-8342-1342-7.
- ^ Chow, Ching Kuang (2008). Fatty acids in foods and their health implications. Boca Raton: CRC Press. ISBN 0-8493-7261-5.
- ^ „Arachidonic acid”.
- ^ Food Standards Agency (1991). „Fats and Oils”. McCance & Widdowson's The Composition of Foods. Royal Society of Chemistry.
- ^ Ted Altar. „More Than You Wanted To Know About Fats/Oils”. Sundance Natural Foods Online. Pristupljeno 31. 8. 2006.
Literatura
[уреди | уреди извор]- Хемија природних органских једињења, Слободан Д. Петровић, Душан Ж. Мијин, Надежда Д. Стојановић; Технолошко-металуршки факултет, Београд, 2009.
- Индустријски производи уља и масти по Бејлију (наслов оригинала Bailey’s Industrial Oil and Fat Products), Данијел Сверн; Накладни завод Знање, Загреб, 1972.
- Хемија природних производа, др Бојана Грујић-Ињац, др Стеван Лајшић; ГРО “Просвета”, Ниш, 1983.
- Употреба молекула - хемијски есеји о молекулима и њиховим применама, Живорад Чековић; Завод за уџбенике, 2012.
- Природно лечење болести и тегоба (наслов оригинала Curing Everyday Ailments the Natural Way) mr sci med dr Милена Комарчевић, Маријана Грошељ, Бранка Маричић; Reader’s Digest; Младинска књига Београд, 2005.
- Fatty Acid and Lipid Chemistry. Berlin: Springer Verlag. 1996. ISBN 0-8342-1342-7.
- Chow, Ching Kuang (2008). Fatty acids in foods and their health implications. Boca Raton: CRC Press. ISBN 0-8493-7261-5.
- Food Standards Agency (1991). „Fats and Oils”. McCance & Widdowson's The Composition of Foods. Royal Society of Chemistry.




