Епоксипропан: відмінності між версіями
| [перевірена версія] | [перевірена версія] |
Немає опису редагування |
|||
| Рядок 159: | Рядок 159: | ||
}} |
}} |
||
'''Епоксипропан''' (''оксид пропілену'', ''пропіленоксид'') |
'''Епоксипропан''' (''оксид пропілену'', ''пропіленоксид'') — один із найпоширеніших оксидів [[Алкени|алкенів]]. При кімнатних умовах — це безбарвна прозора [[рідина]] з ефірним запахом, розчинна у більшості органічних [[Розчинник|розчинників]]. |
||
За хімічними властивостями епоксипропан подібний до [[Оксиран|окисирану]]. Для нього характерні реакції приєднання, зумовлені відносною легкістю розмикання циклу. Найбільш розповсюдженою є реакція [[Гідратація|гідратації]] з утворенням [[Пропіленгліколь|пропіленгліколю]]. Саме у виробництві останнього полягає головне застосування епоксипропану. Крім цього він є вихідною сировиною для виробництва пропіленкарбонату, ізопропаноламінів, поліоксипропіленполіолів, поліпропіленоксиду, пропіленоксидних канчуків, пропіленсульфіду, деяких [[Поверхнево-активні речовини|ПАР]]. |
За хімічними властивостями епоксипропан подібний до [[Оксиран|окисирану]]. Для нього характерні реакції приєднання, зумовлені відносною легкістю розмикання циклу. Найбільш розповсюдженою є реакція [[Гідратація|гідратації]] з утворенням [[Пропіленгліколь|пропіленгліколю]]. Саме у виробництві останнього полягає головне застосування епоксипропану. Крім цього він є вихідною сировиною для виробництва пропіленкарбонату, ізопропаноламінів, поліоксипропіленполіолів, поліпропіленоксиду, пропіленоксидних канчуків, пропіленсульфіду, деяких [[Поверхнево-активні речовини|ПАР]]. |
||
Епоксипропан володіє цитотоксичною та [[Мутаген|мутагенною]] дією. [[Гранично допустима концентрація|ГДК]] |
Епоксипропан володіє цитотоксичною та [[Мутаген|мутагенною]] дією. [[Гранично допустима концентрація|ГДК]] — 1мг/м<sup>3</sup><ref name="ХЕ">Химическая энциклопедия / Под. ред. [[Зефиров Микола Серафимович|Зефирова Н. С.]] — Москва: Большая российская энциклопедия, 1995. — Т. 4, с. 105 {{ref-ru}}.</ref>:. |
||
== Відкриття == |
== Відкриття == |
||
| Рядок 174: | Рядок 174: | ||
|} |
|} |
||
Аналогічний результат отримав [[Красуський Костянтин Адамович|Красуський]] при дії на 1-хлорпропанол-2 оксиду свинцю і [[Вода|води]]<ref>К. |
Аналогічний результат отримав [[Красуський Костянтин Адамович|Красуський]] при дії на 1-хлорпропанол-2 оксиду свинцю і [[Вода|води]]<ref>К. Красуский, Журнал Русского физико-химического общества, 34, 287–315 (1902) {{ref-ru}}.</ref>. |
||
== Отримання == |
== Отримання == |
||
| Рядок 209: | Рядок 209: | ||
|} |
|} |
||
Оскільки приєднання [[Хлор|хлору]] відбувається значно швидше, ніж приєднання [[Гіпохлоритна кислота|гіпохлоритної кислоти]], потрібно за можливості пригнічувати реакцію хлору з [[Пропілен|пропіленом]]<ref>G. С. Israel, Journal of the Chemical Society (London), 1950, |
Оскільки приєднання [[Хлор|хлору]] відбувається значно швидше, ніж приєднання [[Гіпохлоритна кислота|гіпохлоритної кислоти]], потрібно за можливості пригнічувати реакцію хлору з [[Пропілен|пропіленом]]<ref>G. С. Israel, Journal of the Chemical Society (London), 1950, 1282–1286 {{ref-en}}.</ref>. Для цього взаємодію хлору з [[Вода|водою]] слід проводити в окремій колоні. Власне хлоргідринування відбувається в наступній — другій колоні. Велике значення має хороший контакт між [[Рідина|рідкою фазою]] і [[Вуглеводні|вуглеводнем]]. Доцільно вибрати двокамерну установку. |
||
При промисловому одержанні процес найкраще йде в реакторі з подвійною камерою, який застосовується для перетворення етиленхлоргідрину<ref>M. P. Ferrerо et al., Ind. Chim. beige, 19, 133 (1954) {{ref-en}}.</ref>. При порівнянних робочих умовах вихід в такому реакторі складає 87,5 |
При промисловому одержанні процес найкраще йде в реакторі з подвійною камерою, який застосовується для перетворення етиленхлоргідрину<ref>M. P. Ferrerо et al., Ind. Chim. beige, 19, 133 (1954) {{ref-en}}.</ref>. При порівнянних робочих умовах вихід в такому реакторі складає 87,5% пропіленхлоргідрину з одночасним утворенням 11,0% пропілендихлориду і 1,5% дихлордиізопропілового ефіру. На противагу цьому реактор з однією камерою дає тільки 69,2% продукту і 21,6% прореагованого пропілену осаджується у вигляді пропілендихлориду, а 9,2% перетворюється в дихлордиізопропіловий ефір. Це свідчить про безсумнівну перевагу двокамерної системи для процесу перетворення [[Пропілен|пропілену]] в хлоргідрин. У першій камері такої установки [[хлор]] розчиняється разом із поданою свіжою [[вода|водою]] в циркулюючому пропіленхлоргідрині, також попередньо розбавленому водою. Після введення хлор-суміш подається в другу камеру, де потрапляє в потік пропілену, і реакція закінчується. |
||
При хлоруванні пропілену не можна уникнути утворення побічних продуктів, оскільки в розчині хлоргідрину поряд з вільною HOCl є ще вільні НСl і Сl<sub>2</sub>. Реагуючи з пропіленом, Сl<sub>2</sub> викликає утворення 1,2-дихлорпропану, а в результаті реакції з пропіленхлоргідрином виходить дихлордиізопропіловий ефір. Для пригнічення побічних реакцій необхідно працювати при [[Температура|температурі]] нижче 50—60 °С. |
При хлоруванні пропілену не можна уникнути утворення побічних продуктів, оскільки в розчині хлоргідрину поряд з вільною HOCl є ще вільні НСl і Сl<sub>2</sub>. Реагуючи з пропіленом, Сl<sub>2</sub> викликає утворення 1,2-дихлорпропану, а в результаті реакції з пропіленхлоргідрином виходить дихлордиізопропіловий ефір. Для пригнічення побічних реакцій необхідно працювати при [[Температура|температурі]] нижче 50—60 °С. |
||
| Рядок 222: | Рядок 222: | ||
==== Окиснення пропілену в рідкій фазі під тиском ==== |
==== Окиснення пропілену в рідкій фазі під тиском ==== |
||
Перші досліди з прямого [[окиснення]] [[Пропілен|пропілену]] в епоксипропан в [[Рідина|рідкій фазі]] були описані в [[1957]] році в американському [[Патент|патенті]]<ref>Патенти США 2780634, 2780635, 2784202, 1957 {{ref-en}}.</ref>. Окисненню піддають або чистий пропілен при 21,1 кгс/см<sup>2</sup> і |
Перші досліди з прямого [[окиснення]] [[Пропілен|пропілену]] в епоксипропан в [[Рідина|рідкій фазі]] були описані в [[1957]] році в американському [[Патент|патенті]]<ref>Патенти США 2780634, 2780635, 2784202, 1957 {{ref-en}}.</ref>. Окисненню піддають або чистий пропілен при 21,1 кгс/см<sup>2</sup> і 175–225 °С, або суміш пропілену і [[Пропан|пропану]] (1:1) при 52,7 кгс/см<sup>2</sup> і 160–180 °С у присутності пропіонату [[Марганець|марганцю]], розчиненого в [[Бензен|бензені]]. Щоб уникнути [[Гідроліз|гідролізу]] епоксипропану в пропіленгліколь необхідно працювати з [[Інертний матеріал|інертним]] розчинником. По відношенню до витраченого пропілену вихід процесу складає 40% епоксипропану і 20% пропіленгліколю поряд з [[Кислота|кислотами]], [[Діоксид вуглецю|діоксидом вуглецю]] та метилформіатом. Добавка пропану підвищує вихід. В якості розчинників використовують сполуки, які інертні до [[Оксиген|кисню]] та епоксипропану, не змішуються з [[вода|водою]] і розчиняють великі кількості пропілену: [[бензен]], ізооктан, [[неопентан]], ізододекан і т. д. Можна проводити окиснення в [[Толуен|толуені]] при підвищених температурах (210–230 °С) при введенні водного фосфатного буферу (pH = 6,5)<ref>Патент США 2824119, 1958 {{ref-en}}.</ref>. |
||
Доброму окисненню пропілену в [[Ароматичні вуглеводні|ароматичних вуглеводнях]] сприяє додавання до реакційної суміші Na<sub>2</sub>CO<sub>3</sub><ref>Англійський патент 950669, 1964 {{ref-en}}.</ref> або К<sub>2</sub>СO<sub>3</sub><ref name="book_41">Французький патент 1334158, 1963 {{ref-fr}}.</ref> для нейтралізації утворених кислот. За першим методом при конверсії 12,5 |
Доброму окисненню пропілену в [[Ароматичні вуглеводні|ароматичних вуглеводнях]] сприяє додавання до реакційної суміші Na<sub>2</sub>CO<sub>3</sub><ref>Англійський патент 950669, 1964 {{ref-en}}.</ref> або К<sub>2</sub>СO<sub>3</sub><ref name="book_41">Французький патент 1334158, 1963 {{ref-fr}}.</ref> для нейтралізації утворених кислот. За першим методом при конверсії 12,5% отримують 28,8 мол. % епоксипропану і 18 мол. % пропіленгліколю поряд з кислотами і ефірами. Для ініціювання реакції рекомендується вводити сполуки з [[Карбонільна група|карбонільними]] або [[Карбоксильна група|карбоксильними групами]], наприклад пропіоновий [[Альдегіди|альдегід]] або ацетальдегід. За другим методом, завдяки спеціальній конструкції реакційної камери, отримують високу конверсію (94,2%) і високий вихід на одиницю об'єму за одиницю часу: 100 г/год епоксипропану і 50 г/год пропіленгліколю<ref name="book_41"/>. |
||
Проведені дослідження рідкофазного окиснення пропілену показали, що при |
Проведені дослідження рідкофазного окиснення пропілену показали, що при 145–220 °С і тиску 2-10 кгс/см<sup>2</sup> нафтенат [[Марганець|марганцю]] є найкращим за селективністю [[Каталізатор|каталізатором]] для утворення епоксипропану<ref>J. Imamura et al., Tokyo Kogyo Shikensho Hokoku, 59, № 10, 447–457 (1964) {{ref-ja}}.</ref><ref>J. Imamura et al., Kogyo Kagaku Zasshi, 67, № 7, 1026–1031 (1964) {{ref-ja}}.</ref>. Індукційний період скорочують підвищенням [[Парціальний тиск|парціального тиску]] [[Оксиген|кисню]] і концентрації пропілену, а також добавкою раніше отриманого оксидату. Збільшення [[Температура|температури]] реакції чинить аналогічну дію. Окиснення протікає за [[Радикал (хімія)|радикальним]] механізмом, обривають ланцюг перекисні сполуки типу СН<sub>2</sub>=СН-СН<sub>2</sub>O<sub>2</sub>. |
||
Епоксипропан можна виділити шляхом [[Екстракція|екстрагування]] [[Вода|водою]] під [[Тиск|тиском]] при 20 °С<ref>D. A. S. 1192171, 1965 {{ref-de}}.</ref>. |
Епоксипропан можна виділити шляхом [[Екстракція|екстрагування]] [[Вода|водою]] під [[Тиск|тиском]] при 20 °С<ref>D. A. S. 1192171, 1965 {{ref-de}}.</ref>. |
||
Окиснення без тиску при 200 °С можна проводити в багатьох розчинниках ([[диметилфталат]], [[силіконове масло]], фторвуглеводні, дибутилсебацінат та ін.), але конверсія становить лише 1,0-1,5 |
Окиснення без тиску при 200 °С можна проводити в багатьох розчинниках ([[диметилфталат]], [[силіконове масло]], фторвуглеводні, дибутилсебацінат та ін.), але конверсія становить лише 1,0-1,5% в [[Година|годину]], селективність не вище 55-60%<ref>F. W. Meadоw, K. U. Ingоld. The Canadian Journal of Chemical Engineering, 42, № 2, 86—87 (1964) {{ref-en}}.</ref>.Для окиснення під тиском рекомендуються [[нітрили]], наприклад ацетонітрил<ref>Патент США 3210380, 1965 {{ref-en}}.</ref>. |
||
=== Окиснення пропілену в газовій фазі=== |
=== Окиснення пропілену в газовій фазі === |
||
За даними фірми Farbenfabriken Вауег в окиснювальний реактор, який складається з підігрівального пристрою, реакційної камери [[Об'єм| |
За даними фірми Farbenfabriken Вауег в окиснювальний реактор, який складається з підігрівального пристрою, реакційної камери [[Об'єм|об'ємом]] 0,8 л і холодильника, при 9 кгс/см<sup>2</sup> подають щогодини 20 м<sup>3</sup> газової суміші з вмістом 45% об'ємних [[Пропілен|пропілену]] і 5% об'ємних [[Оксиген|кисню]] (решту становить переважно [[азот]], [[Монооксид вуглецю|монооксид]] і [[діоксид вуглецю]])<ref>Бельгійський патент 623552, 1963 {{ref-en}}.</ref>. У підігрівачі підтримується [[температура]] 280–300 °С, в реакційній камері вона підвищується до 430–450 °С. У результаті реакції [[окиснення]] вміст кисню падає до 0,5-1% об'ємних. Реакційна суміш, що виходить з окисної печі, охолоджується і промивається [[Вода|водою]] під [[Тиск|тиском]]. |
||
З решти [[Газ|газоподібних]] [[Фракція (хімія)|фракцій]], що містять поряд з пропіленом кисень, азот, монооксид і діоксид вуглецю, виділяють монооксид вуглецю і перетворюють його в діоксид, який потім видаляють промиванням [[Луг (хімія)|лугом]]. До газів, що залишилися, додають відпрацьований пропілен з киснем, і суміш знову подають через [[компресор]] в окиснювальний реактор. |
З решти [[Газ|газоподібних]] [[Фракція (хімія)|фракцій]], що містять поряд з пропіленом кисень, азот, монооксид і діоксид вуглецю, виділяють монооксид вуглецю і перетворюють його в діоксид, який потім видаляють промиванням [[Луг (хімія)|лугом]]. До газів, що залишилися, додають відпрацьований пропілен з киснем, і суміш знову подають через [[компресор]] в окиснювальний реактор. |
||
| Рядок 270: | Рядок 270: | ||
|} |
|} |
||
[[Ізомеризація]] епоксипропану в пропаналь (пропіоновий альдегід) легко проходить на таких каталізаторах, як Сr<sub>2</sub>O<sub>3</sub> |
[[Ізомеризація]] епоксипропану в пропаналь (пропіоновий альдегід) легко проходить на таких каталізаторах, як Сr<sub>2</sub>O<sub>3</sub> — CdCl<sub>2</sub> — CdO, Cr<sub>2</sub>O<sub>3</sub> — WO<sub>3</sub> — Fe<sub>2</sub>O<sub>3</sub> або Cr<sub>2</sub>O<sub>3</sub> — WO<sub>3</sub>. |
||
{| border="0" cellpadding="5" cellspacing="0" align="center" |
{| border="0" cellpadding="5" cellspacing="0" align="center" |
||
| Рядок 277: | Рядок 277: | ||
|} |
|} |
||
При використанні Li<sub>3</sub>PO<sub>4</sub><ref name="Lundstedt">L. G. Lundstedt et al., Industrial & Engineering Chemistry, 43, |
При використанні Li<sub>3</sub>PO<sub>4</sub><ref name="Lundstedt">L. G. Lundstedt et al., Industrial & Engineering Chemistry, 43, 728–730 (1951) {{ref-en}}.</ref><ref>П. Г. Сepгeeв и др. Химическая наука и промы.шленность, 2, 133 (1957) {{ref-ru}}.</ref><ref>Патент США 2986585, 1961 {{ref-en}}.</ref><ref>Англійський патент 902953, 1962 {{ref-en}}.</ref> або Li<sub>3</sub>AsO<sub>4</sub><ref name="patentusa">Патент США 3209037, 1965 {{ref-en}}.</ref> можна перегрупувати епоксипропан в аліловий спирт (2-пропен-1-ол). |
||
З [[Альдегіди|альдегідами]] і [[Кетони|кетонами]] епоксипропан утворює циклічні ацеталі, з кетенами γ-лактони, наприклад<ref> |
З [[Альдегіди|альдегідами]] і [[Кетони|кетонами]] епоксипропан утворює циклічні ацеталі, з кетенами γ-лактони, наприклад<ref name="ХЕ"></ref>: |
||
[[Файл:Епоксипропан+кетени.png|600px|center]] |
[[Файл:Епоксипропан+кетени.png|600px|center]] |
||
| Рядок 286: | Рядок 286: | ||
Основна кількість епоксипропану йде на виробництво [[Поліуретани|поліуретанових]] [[Пластмаса|пластмас]] та пропіленгліколю. Останній є вихідним продуктом для виробництва поліефірів. |
Основна кількість епоксипропану йде на виробництво [[Поліуретани|поліуретанових]] [[Пластмаса|пластмас]] та пропіленгліколю. Останній є вихідним продуктом для виробництва поліефірів. |
||
Полілропіленгліколь (діапазон молекулярних мас від 400 до 2000), який отримують [[полімеризація|полімеризацією]] епоксипропану в лужному або кислому середовищі, є важливим проміжним продуктом для виробництва [[Пінополіуретан|пінополіуретанів]], [[Алкідні смоли|алкідних смол]], [[Емульгатор|емульгаторів]], [[Деемульгатори|деемульгаторів]], мастильних засобів, гальмівних рідин<ref>Kirk |
Полілропіленгліколь (діапазон молекулярних мас від 400 до 2000), який отримують [[полімеризація|полімеризацією]] епоксипропану в лужному або кислому середовищі, є важливим проміжним продуктом для виробництва [[Пінополіуретан|пінополіуретанів]], [[Алкідні смоли|алкідних смол]], [[Емульгатор|емульгаторів]], [[Деемульгатори|деемульгаторів]], мастильних засобів, гальмівних рідин<ref>Kirk — Othmer, Encyclopedia of Chemical Technology, N. Y., v. 7, 1951, p. 261–262 {{ref-ru}}.</ref>. Дипропіленгліколь окремо і разом з диетиленгліколем використовується при отриманні друкарських фарб і в якості гідравлічної рідини з низькою температурою затвердіння. Він володіє незначною [[Токсичність|токсичністю]] в порівнянні з [[Етиленгліколь|етиленгліколем]], що дозволяє застосовувати його при виготовленні фармацевтичних і косметичних засобів, а також [[Харчові продукти|харчових продуктів]]. Суміш [[Поліетилен|поліетилену]] з поліпропіленгліколем є цікавою вихідною речовиною для одержання неіоногенних [[Поверхнево-активні речовини|детергентів]] і спеціальних мастил. |
||
Ізопропаноламіни, які отримують взаємодією епоксипропану з [[Аміак|аміаком]], |
Ізопропаноламіни, які отримують взаємодією епоксипропану з [[Аміак|аміаком]], є цікавими проміжним продуктами для синтезу [[Барвник|барвників]], [[Фармацевтичні засоби|фармацевтичних засобів]] і, за певних умов, поліефірних [[Аміди|амідів]]. |
||
Можливість ізомеризації епоксипропану за допомогою Li<sub>3</sub>PO<sub>4</sub><ref name="Lundstedt"/> або Li<sub>3</sub>AsO<sub>4</sub><ref name="patentusa"/> в аліловий спирт і в пропіоновий альдегід використана в промисловості фірмою Olin Mathieson Chemicals Ltd., яка розробила на основі цього методу процес синтезу [[Гліцерин|гліцерину]]<ref>Патенти США 2426264, 1947; 2435460, 1948; 2521170, 1949 {{ref-en}}.</ref>. |
Можливість ізомеризації епоксипропану за допомогою Li<sub>3</sub>PO<sub>4</sub><ref name="Lundstedt"/> або Li<sub>3</sub>AsO<sub>4</sub><ref name="patentusa"/> в аліловий спирт і в пропіоновий альдегід використана в промисловості фірмою Olin Mathieson Chemicals Ltd., яка розробила на основі цього методу процес синтезу [[Гліцерин|гліцерину]]<ref>Патенти США 2426264, 1947; 2435460, 1948; 2521170, 1949 {{ref-en}}.</ref>. |
||
Співполімеризація епоксипропану з іншими ненасиченими епоксисполуками (епоксибутадієн, алілгліцидиловий ефір, оксид вінілциклогексену та ін.) в присутності [[Каталізатор|каталізатора]] приводить до отримання каучукоподібних полімерів, сфера застосовуються яких є досить широкою<ref>Е. Е. Gruber et al., Industrial & engineering chemistry product research and development, 3,. |
Співполімеризація епоксипропану з іншими ненасиченими епоксисполуками (епоксибутадієн, алілгліцидиловий ефір, оксид вінілциклогексену та ін.) в присутності [[Каталізатор|каталізатора]] приводить до отримання каучукоподібних полімерів, сфера застосовуються яких є досить широкою<ref>Е. Е. Gruber et al., Industrial & engineering chemistry product research and development, 3,. 194–199 (1964) {{ref-en}}.</ref><ref>L. Marker et al., Kautschuk, Gummi, Kunststoffe, 19, 337 (1966) {{ref-de}}.</ref>. |
||
== Фізіологічний вплив == |
== Фізіологічний вплив == |
||
| Рядок 304: | Рядок 304: | ||
==== Тварини ==== |
==== Тварини ==== |
||
Викликає загальне збудження, рухову активність, яка змінюються [[Адинамія|адинамією]], почастішання [[дихання]] і [[Пульс|пульсу]], порушення координації, слинотечу, клонічні [[Спазм|судоми]]. Наркотична дія виражена слабко, проте чітко проявляється [[Подразнення|подразнююча]] дія. При гострому отруєнні відбувається різке згущення [[Кров|крові]] і підвищення вмісту [[Гістамін|гістаміну]] в ній (одночасно зі зниженням в [[Печінка|печінці]] та [[Кишечник|кишечнику]]). Для білих [[Миша|мишей]] при експозиції 2 год ЛК<sub>50</sub> = 4,2; 4,5 і 6,2 м/л (за різними даними): для білих щурів 9,5-10 мг/л. При введенні в шлунок для мишей і щурів ЛД<sub>50</sub> = 580 і 750 мг/кг відповідно<ref>Пугаев В. П. и др. Гигиена труда, 1970, № |
Викликає загальне збудження, рухову активність, яка змінюються [[Адинамія|адинамією]], почастішання [[дихання]] і [[Пульс|пульсу]], порушення координації, слинотечу, клонічні [[Спазм|судоми]]. Наркотична дія виражена слабко, проте чітко проявляється [[Подразнення|подразнююча]] дія. При гострому отруєнні відбувається різке згущення [[Кров|крові]] і підвищення вмісту [[Гістамін|гістаміну]] в ній (одночасно зі зниженням в [[Печінка|печінці]] та [[Кишечник|кишечнику]]). Для білих [[Миша|мишей]] при експозиції 2 год ЛК<sub>50</sub> = 4,2; 4,5 і 6,2 м/л (за різними даними): для білих щурів 9,5-10 мг/л. При введенні в шлунок для мишей і щурів ЛД<sub>50</sub> = 580 і 750 мг/кг відповідно<ref>Пугаев В. П. и др. Гигиена труда, 1970, № 11, с. 55—58 {{ref-ru}}.</ref><ref name="beliaev">Беляев В. А. и др. Гигиена труда, 1971, № 2, с. 48—49 {{ref-ru}}.</ref>. Концентрація, яка змінює нервово-м'язову збудливість у щурів при одноразовому впливі, 0,02 мг/л. Після введення епоксипропану в шлунок у [[Повітря|повітрі]], що видихалося, та крові отруєних тварин виявлявся [[формальдегід]]. Терапевтичний ефект здійснював [[тіосульфат натрію]]. При його застосуванні виживали смертельно отруєні щурі та [[Кріль|кролики]]. [[Гемодіаліз]] різко знижував концентрацію формальдегіду в крові. У загиблих тварин фіксувалося білкове і жирове переродження клітин печінки, застійне повнокров'я [[Нирки|нирок]], [[Селезінка|селезінки]], [[Бронхіт|бронхіти]], [[Пневмонія|пневмонія]]<ref>Беляев В. А., Политыкии А. Я. Фармакология и токсикология, 1971, т. 34, № 3. с. 362–364 {{ref-ru}}.</ref>. |
||
==== Людина ==== |
==== Людина ==== |
||
Поріг сприйняття запаху 0,36 мг/л. Описано гостре отруєння при [[Аварія|аварії]], коли потерпілий протягом 10-15 хв вдихав (без будь-якого захисту) епоксипропан концентрацією |
Поріг сприйняття запаху 0,36 мг/л. Описано гостре отруєння при [[Аварія|аварії]], коли потерпілий протягом 10-15 хв вдихав (без будь-якого захисту) епоксипропан концентрацією 1400–1500 мг/л. В цьому випадку людина відразу відчула стиснення в грудях, подразнення [[Слизова оболонка|слизових оболонок]], пізніше різкий [[Головний біль|головний біль]], слабкість, [[Діарея|пронос]], [[Непритомність|непритомний стан]], [[Колапс (медицина)|колапс]]. Після відповідної терапії залишилися загальмованість, сильна слабкість, пронос, [[Блювання|блювота]], блідість, [[ціаноз]], слабкий пульс, жорстке дихання, судоми м'язів [[Гомілка|гомілки]]. При застосуванні [[Антигістамінні препарати|антигістамінних препаратів]] і тіосульфату натрію настало швидке поліпшення. Через десять днів залишилася ще слабкість<ref name="beliaev"/>. |
||
=== Хронічне отруєння === |
=== Хронічне отруєння === |
||
Повторні отруєння парами епоксипропану протягом |
Повторні отруєння парами епоксипропану протягом 112–218 днів по 7 год в день 5 разів на тиждень у [[Кріль|кроликів]] і [[Мавпи|мавп]] не викликали жодних симптомів, у білих щурів і морських свинок — подразнення [[Слизова оболонка|слизових оболонок]], незначне уповільнення росту, загибель тварин переважно внаслідок [[Пневмонія|запалення легень]]. Вдихання 0,037-0,025 мг/л протягом 6 місяців по 4 год в день викликало у щурів фазні зміни [[Біоелектричні потенціали|біопотенціалів]] [[Головний мозок|мозку]] і нервово-м'язової збудливості, зниження [[Артеріальний тиск|артеріального тиску]], порушення антитоксичної функції печінки та білкового обміну. Відзначений [[лімфоцитоз]] з відповідною нейтропенією. |
||
=== Невідкладна терапія === |
=== Невідкладна терапія === |
||
Версія за 22:08, 2 грудня 2012
| Епоксипропан | |
|---|---|
 |
 |
| Назва за IUPAC | Епоксипропан |
| Інші назви | Оксид пропілену, пропілен оксид, метилоксиран; 1,2-епоксипропан |
| Ідентифікатори | |
| Номер CAS | 75-56-9 |
| Номер EINECS | 200-879-2 |
| Номер EC | 200-879-2 |
| KEGG | C15508 |
| ChEBI | 38685 |
| RTECS | TZ2975000 |
| SMILES | CC1CO1 |
| InChI | InChI=1S/C3H6O/c1-3-2-4-3/h3H,2H2,1H3 |
| Номер Бельштейна | 79763 |
| Номер Гмеліна | 81761 |
| Властивості | |
| Молекулярна формула | CH3CHCH2O |
| Молярна маса | 58,08 г/моль |
| Молекулярна маса | 58 а. о. м. |
| Зовнішній вигляд | безбарвна рідина |
| Густина | 0,8313 г/см³ |
| Тпл | −112,1 °C |
| Ткип | 34,2 °C |
| Розчинність (вода) | 40,5 % мас (при 20 оС) |
| Показник заломлення (nD) | 1,363 |
| В'язкість | 0,28 сП |
| Дипольний момент | 2,00 |
| Структура | |
| Дипольний момент | 2,00 |
| Термохімія | |
| Ст. ентальпія згоряння ΔcH 298 |
453,1 ккал/моль |
| Теплоємність, c p |
0,51 кал/(г • К) |
| Небезпеки | |
| ГДК (Україна) | 1 мг/м3 |
| ЛД50 | 580 мг/кг |
| NFPA 704 | |
| Температура спалаху | - 44 °С |
| Температура самозаймання | 747 °С |
| Вибухові границі | 2,8 - 36,8 |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Епоксипропан (оксид пропілену, пропіленоксид) — один із найпоширеніших оксидів алкенів. При кімнатних умовах — це безбарвна прозора рідина з ефірним запахом, розчинна у більшості органічних розчинників.
За хімічними властивостями епоксипропан подібний до окисирану. Для нього характерні реакції приєднання, зумовлені відносною легкістю розмикання циклу. Найбільш розповсюдженою є реакція гідратації з утворенням пропіленгліколю. Саме у виробництві останнього полягає головне застосування епоксипропану. Крім цього він є вихідною сировиною для виробництва пропіленкарбонату, ізопропаноламінів, поліоксипропіленполіолів, поліпропіленоксиду, пропіленоксидних канчуків, пропіленсульфіду, деяких ПАР.
Епоксипропан володіє цитотоксичною та мутагенною дією. ГДК — 1мг/м3[1]:.
Відкриття
Епоксипропілен був відкритий Озером, коли він обробляв 1-хлорпропанол-2 їдким калі[2]:
Аналогічний результат отримав Красуський при дії на 1-хлорпропанол-2 оксиду свинцю і води[3].
Отримання
Отримання епоксипропілену через пропіленхлоргідрин
Метод отримання епоксипропілену шляхом приєднання гіпохлоритної кислоти до пропілену, вперше докладно описаний В. Марковніковим, досі є найпоширенішим[4]. Процеси, що протікають при цьому можна записати таким чином:
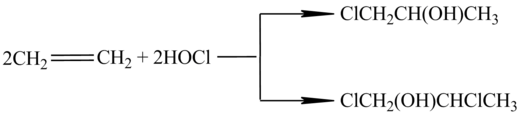
Мольне співвідношення α- і β-пропіленхлоргідринів становить 9:1.
У результаті впливу елементарного хлору на пропілен і хлоргідрин в якості побічних продуктів утворюються дихлорпропан і дихлордиізопропіловий ефір:
Оскільки приєднання хлору відбувається значно швидше, ніж приєднання гіпохлоритної кислоти, потрібно за можливості пригнічувати реакцію хлору з пропіленом[5]. Для цього взаємодію хлору з водою слід проводити в окремій колоні. Власне хлоргідринування відбувається в наступній — другій колоні. Велике значення має хороший контакт між рідкою фазою і вуглеводнем. Доцільно вибрати двокамерну установку.
При промисловому одержанні процес найкраще йде в реакторі з подвійною камерою, який застосовується для перетворення етиленхлоргідрину[6]. При порівнянних робочих умовах вихід в такому реакторі складає 87,5% пропіленхлоргідрину з одночасним утворенням 11,0% пропілендихлориду і 1,5% дихлордиізопропілового ефіру. На противагу цьому реактор з однією камерою дає тільки 69,2% продукту і 21,6% прореагованого пропілену осаджується у вигляді пропілендихлориду, а 9,2% перетворюється в дихлордиізопропіловий ефір. Це свідчить про безсумнівну перевагу двокамерної системи для процесу перетворення пропілену в хлоргідрин. У першій камері такої установки хлор розчиняється разом із поданою свіжою водою в циркулюючому пропіленхлоргідрині, також попередньо розбавленому водою. Після введення хлор-суміш подається в другу камеру, де потрапляє в потік пропілену, і реакція закінчується.
При хлоруванні пропілену не можна уникнути утворення побічних продуктів, оскільки в розчині хлоргідрину поряд з вільною HOCl є ще вільні НСl і Сl2. Реагуючи з пропіленом, Сl2 викликає утворення 1,2-дихлорпропану, а в результаті реакції з пропіленхлоргідрином виходить дихлордиізопропіловий ефір. Для пригнічення побічних реакцій необхідно працювати при температурі нижче 50—60 °С.
Отримання епоксипропану прямим окисленням
Якщо отримання оксирану вже віддавна здійснюють прямим окисненням на срібних каталізаторах, то виробництво епоксипропану все ще базується на класичному методі хлоргідруванні. Вихід епоксипропану при прямому окисненні пропілену досі залишається незначним, хоча роботи з дослідження цього процесу почалися ще в 30-х роках 20-го століття. Досліди з дослідження прямого окиснення пропілену в епоксипропан з отриманням хорошого виходу тривають і в даний час.
Окиснення пропілену в рідкій фазі під тиском
Перші досліди з прямого окиснення пропілену в епоксипропан в рідкій фазі були описані в 1957 році в американському патенті[7]. Окисненню піддають або чистий пропілен при 21,1 кгс/см2 і 175–225 °С, або суміш пропілену і пропану (1:1) при 52,7 кгс/см2 і 160–180 °С у присутності пропіонату марганцю, розчиненого в бензені. Щоб уникнути гідролізу епоксипропану в пропіленгліколь необхідно працювати з інертним розчинником. По відношенню до витраченого пропілену вихід процесу складає 40% епоксипропану і 20% пропіленгліколю поряд з кислотами, діоксидом вуглецю та метилформіатом. Добавка пропану підвищує вихід. В якості розчинників використовують сполуки, які інертні до кисню та епоксипропану, не змішуються з водою і розчиняють великі кількості пропілену: бензен, ізооктан, неопентан, ізододекан і т. д. Можна проводити окиснення в толуені при підвищених температурах (210–230 °С) при введенні водного фосфатного буферу (pH = 6,5)[8].
Доброму окисненню пропілену в ароматичних вуглеводнях сприяє додавання до реакційної суміші Na2CO3[9] або К2СO3[10] для нейтралізації утворених кислот. За першим методом при конверсії 12,5% отримують 28,8 мол. % епоксипропану і 18 мол. % пропіленгліколю поряд з кислотами і ефірами. Для ініціювання реакції рекомендується вводити сполуки з карбонільними або карбоксильними групами, наприклад пропіоновий альдегід або ацетальдегід. За другим методом, завдяки спеціальній конструкції реакційної камери, отримують високу конверсію (94,2%) і високий вихід на одиницю об'єму за одиницю часу: 100 г/год епоксипропану і 50 г/год пропіленгліколю[10].
Проведені дослідження рідкофазного окиснення пропілену показали, що при 145–220 °С і тиску 2-10 кгс/см2 нафтенат марганцю є найкращим за селективністю каталізатором для утворення епоксипропану[11][12]. Індукційний період скорочують підвищенням парціального тиску кисню і концентрації пропілену, а також добавкою раніше отриманого оксидату. Збільшення температури реакції чинить аналогічну дію. Окиснення протікає за радикальним механізмом, обривають ланцюг перекисні сполуки типу СН2=СН-СН2O2.
Епоксипропан можна виділити шляхом екстрагування водою під тиском при 20 °С[13].
Окиснення без тиску при 200 °С можна проводити в багатьох розчинниках (диметилфталат, силіконове масло, фторвуглеводні, дибутилсебацінат та ін.), але конверсія становить лише 1,0-1,5% в годину, селективність не вище 55-60%[14].Для окиснення під тиском рекомендуються нітрили, наприклад ацетонітрил[15].
Окиснення пропілену в газовій фазі
За даними фірми Farbenfabriken Вауег в окиснювальний реактор, який складається з підігрівального пристрою, реакційної камери об'ємом 0,8 л і холодильника, при 9 кгс/см2 подають щогодини 20 м3 газової суміші з вмістом 45% об'ємних пропілену і 5% об'ємних кисню (решту становить переважно азот, монооксид і діоксид вуглецю)[16]. У підігрівачі підтримується температура 280–300 °С, в реакційній камері вона підвищується до 430–450 °С. У результаті реакції окиснення вміст кисню падає до 0,5-1% об'ємних. Реакційна суміш, що виходить з окисної печі, охолоджується і промивається водою під тиском.
З решти газоподібних фракцій, що містять поряд з пропіленом кисень, азот, монооксид і діоксид вуглецю, виділяють монооксид вуглецю і перетворюють його в діоксид, який потім видаляють промиванням лугом. До газів, що залишилися, додають відпрацьований пропілен з киснем, і суміш знову подають через компресор в окиснювальний реактор.
Хімічні властивості
Хімічні властивості епоксипропану подібні до властивостей оксирану. Він також реагує зі сполуками, що мають активні атоми гідрогену, наприклад з водою дає пропіленгліколь. Гідратація епоксипропану легко йде при звичайній температурі в присутності щавлевої кислоти як каталізатора, яку згодом легко можна виділити у вигляді оксалату кальцію. Реакція проходить в кислому розчині майже в 5 разів швидше, ніж у випадку з оксираном.
При реакції епоксипропану з водним розчином аміаку утворюється переважно тільки ізомерний моноізопропаноламін і більші чи менші кількості ди- та триізонропаноламіну в залежності від співвідношення вихідних продуктів.
При каталітичному приєднанні спиртів і фенолу в результаті дії лугу майже завжди утворюється первинний моноефір пропіленгліколю:
Кислотна або некаталітична реакція дає крім того і вторинний ефір пропіленгліколю .
Полімеризація епоксипропану приводить до утворення поліпропіленгліколю.
Ізомеризація епоксипропану в пропаналь (пропіоновий альдегід) легко проходить на таких каталізаторах, як Сr2O3 — CdCl2 — CdO, Cr2O3 — WO3 — Fe2O3 або Cr2O3 — WO3.
При використанні Li3PO4[17][18][19][20] або Li3AsO4[21] можна перегрупувати епоксипропан в аліловий спирт (2-пропен-1-ол).
З альдегідами і кетонами епоксипропан утворює циклічні ацеталі, з кетенами γ-лактони, наприклад[1]:
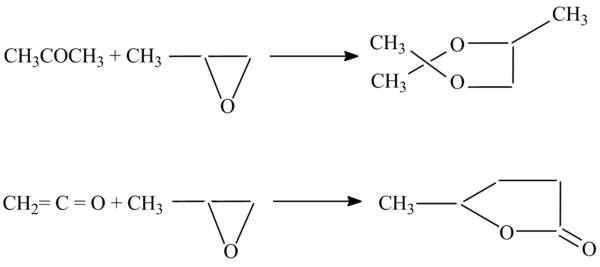
Застосування
Основна кількість епоксипропану йде на виробництво поліуретанових пластмас та пропіленгліколю. Останній є вихідним продуктом для виробництва поліефірів.
Полілропіленгліколь (діапазон молекулярних мас від 400 до 2000), який отримують полімеризацією епоксипропану в лужному або кислому середовищі, є важливим проміжним продуктом для виробництва пінополіуретанів, алкідних смол, емульгаторів, деемульгаторів, мастильних засобів, гальмівних рідин[22]. Дипропіленгліколь окремо і разом з диетиленгліколем використовується при отриманні друкарських фарб і в якості гідравлічної рідини з низькою температурою затвердіння. Він володіє незначною токсичністю в порівнянні з етиленгліколем, що дозволяє застосовувати його при виготовленні фармацевтичних і косметичних засобів, а також харчових продуктів. Суміш поліетилену з поліпропіленгліколем є цікавою вихідною речовиною для одержання неіоногенних детергентів і спеціальних мастил.
Ізопропаноламіни, які отримують взаємодією епоксипропану з аміаком, є цікавими проміжним продуктами для синтезу барвників, фармацевтичних засобів і, за певних умов, поліефірних амідів.
Можливість ізомеризації епоксипропану за допомогою Li3PO4[17] або Li3AsO4[21] в аліловий спирт і в пропіоновий альдегід використана в промисловості фірмою Olin Mathieson Chemicals Ltd., яка розробила на основі цього методу процес синтезу гліцерину[23].
Співполімеризація епоксипропану з іншими ненасиченими епоксисполуками (епоксибутадієн, алілгліцидиловий ефір, оксид вінілциклогексену та ін.) в присутності каталізатора приводить до отримання каучукоподібних полімерів, сфера застосовуються яких є досить широкою[24][25].
Фізіологічний вплив
Загальний характер дії
Викликає гемодинамічні розлади, можливо внаслідок підвищення концентрації гістаміну та інших біологічних активних речовин. Епоксипропану властива цитотоксична, а також мутагенна дія.
Гостре отруєння
Тварини
Викликає загальне збудження, рухову активність, яка змінюються адинамією, почастішання дихання і пульсу, порушення координації, слинотечу, клонічні судоми. Наркотична дія виражена слабко, проте чітко проявляється подразнююча дія. При гострому отруєнні відбувається різке згущення крові і підвищення вмісту гістаміну в ній (одночасно зі зниженням в печінці та кишечнику). Для білих мишей при експозиції 2 год ЛК50 = 4,2; 4,5 і 6,2 м/л (за різними даними): для білих щурів 9,5-10 мг/л. При введенні в шлунок для мишей і щурів ЛД50 = 580 і 750 мг/кг відповідно[26][27]. Концентрація, яка змінює нервово-м'язову збудливість у щурів при одноразовому впливі, 0,02 мг/л. Після введення епоксипропану в шлунок у повітрі, що видихалося, та крові отруєних тварин виявлявся формальдегід. Терапевтичний ефект здійснював тіосульфат натрію. При його застосуванні виживали смертельно отруєні щурі та кролики. Гемодіаліз різко знижував концентрацію формальдегіду в крові. У загиблих тварин фіксувалося білкове і жирове переродження клітин печінки, застійне повнокров'я нирок, селезінки, бронхіти, пневмонія[28].
Людина
Поріг сприйняття запаху 0,36 мг/л. Описано гостре отруєння при аварії, коли потерпілий протягом 10-15 хв вдихав (без будь-якого захисту) епоксипропан концентрацією 1400–1500 мг/л. В цьому випадку людина відразу відчула стиснення в грудях, подразнення слизових оболонок, пізніше різкий головний біль, слабкість, пронос, непритомний стан, колапс. Після відповідної терапії залишилися загальмованість, сильна слабкість, пронос, блювота, блідість, ціаноз, слабкий пульс, жорстке дихання, судоми м'язів гомілки. При застосуванні антигістамінних препаратів і тіосульфату натрію настало швидке поліпшення. Через десять днів залишилася ще слабкість[27].
Хронічне отруєння
Повторні отруєння парами епоксипропану протягом 112–218 днів по 7 год в день 5 разів на тиждень у кроликів і мавп не викликали жодних симптомів, у білих щурів і морських свинок — подразнення слизових оболонок, незначне уповільнення росту, загибель тварин переважно внаслідок запалення легень. Вдихання 0,037-0,025 мг/л протягом 6 місяців по 4 год в день викликало у щурів фазні зміни біопотенціалів мозку і нервово-м'язової збудливості, зниження артеріального тиску, порушення антитоксичної функції печінки та білкового обміну. Відзначений лімфоцитоз з відповідною нейтропенією.
Невідкладна терапія
При інгаляційному отруєнні необхідно негайно забезпечити потерпілому доступ свіжого повітря, спокій, серцеві та інші засоби за показаннями, крапельне вливання глюкози, вітаміни, антигістамінні засоби (димедрол, піпольфен). Можливе швидке застосування тіосульфату натрію, яке сприяє, крім того, дегідратації тканин, збільшуючи масу циркулюючої крові). При важких отруєннях — обов'язкова госпіталізація.
Див. також
Примітки
- ↑ а б Химическая энциклопедия / Под. ред. Зефирова Н. С. — Москва: Большая российская энциклопедия, 1995. — Т. 4, с. 105 (рос.).
- ↑ Оser, Justus Liebigs Annalen der Chemie, 1, 255 (1861) (нім.).
- ↑ К. Красуский, Журнал Русского физико-химического общества, 34, 287–315 (1902) (рос.).
- ↑ W. Mаrkоwnikоw, Zeitschrift für anorganische und allgemeine Chemie, 423 (1870) (нім.).
- ↑ G. С. Israel, Journal of the Chemical Society (London), 1950, 1282–1286 (англ.).
- ↑ M. P. Ferrerо et al., Ind. Chim. beige, 19, 133 (1954) (англ.).
- ↑ Патенти США 2780634, 2780635, 2784202, 1957 (англ.).
- ↑ Патент США 2824119, 1958 (англ.).
- ↑ Англійський патент 950669, 1964 (англ.).
- ↑ а б Французький патент 1334158, 1963 (фр.).
- ↑ J. Imamura et al., Tokyo Kogyo Shikensho Hokoku, 59, № 10, 447–457 (1964) (яп.).
- ↑ J. Imamura et al., Kogyo Kagaku Zasshi, 67, № 7, 1026–1031 (1964) (яп.).
- ↑ D. A. S. 1192171, 1965 (нім.).
- ↑ F. W. Meadоw, K. U. Ingоld. The Canadian Journal of Chemical Engineering, 42, № 2, 86—87 (1964) (англ.).
- ↑ Патент США 3210380, 1965 (англ.).
- ↑ Бельгійський патент 623552, 1963 (англ.).
- ↑ а б L. G. Lundstedt et al., Industrial & Engineering Chemistry, 43, 728–730 (1951) (англ.).
- ↑ П. Г. Сepгeeв и др. Химическая наука и промы.шленность, 2, 133 (1957) (рос.).
- ↑ Патент США 2986585, 1961 (англ.).
- ↑ Англійський патент 902953, 1962 (англ.).
- ↑ а б Патент США 3209037, 1965 (англ.).
- ↑ Kirk — Othmer, Encyclopedia of Chemical Technology, N. Y., v. 7, 1951, p. 261–262 (рос.).
- ↑ Патенти США 2426264, 1947; 2435460, 1948; 2521170, 1949 (англ.).
- ↑ Е. Е. Gruber et al., Industrial & engineering chemistry product research and development, 3,. 194–199 (1964) (англ.).
- ↑ L. Marker et al., Kautschuk, Gummi, Kunststoffe, 19, 337 (1966) (нім.).
- ↑ Пугаев В. П. и др. Гигиена труда, 1970, № 11, с. 55—58 (рос.).
- ↑ а б Беляев В. А. и др. Гигиена труда, 1971, № 2, с. 48—49 (рос.).
- ↑ Беляев В. А., Политыкии А. Я. Фармакология и токсикология, 1971, т. 34, № 3. с. 362–364 (рос.).
Джерела
- Андреас Ф., Гребе К. Химия и технология пропилена. — Ленинград : Химия, 1973. — 368 с. (рос.)
- Химическая энциклопедия / Под. ред. Зефиров Н. С. — Москва : Большая российская энциклопедия, 1995. — Т. 4. (рос.)
- Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей / Под. ред. Лазарев Н. В. и Левиной Э. Н. — Изд. 7. — Ленинград : Химия, 1976. — Т. 1. — С. 478-479. — 49000 прим. (рос.)
Посилання
- National Institute of Standards and Technology (англ.) .
- Вплив епоксипропану на навколишнє середовище (англ.) .
| Ця стаття є кандидатом у добрі статті. Обговорення номінації відбувається на сторінці пропозицій. |












![{\displaystyle \mathrm {nCH_{3}CHCH_{2}O\longrightarrow HO[-CH_{2}-CH(CH_{3})O-]_{n}H} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/43cfbc466d2a27d361aa2b51e2db0f57de033852)
