ثلاثي أكسيد الكربون
| ثلاثي أكسيد الكربون | |
|---|---|
متصاوغات ثلاثي أكسيد الكربون
| |
| الاسم النظامي (IUPAC) | |
Dioxiran-3-one |
|
| أسماء أخرى | |
Carbon trioxide |
|
| المعرفات | |
| رقم CAS | 12144-05-7 |
| بوب كيم (PubChem) | 19817254 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
|
|
| الخواص | |
| صيغة كيميائية | CO3 |
| كتلة مولية | 60.01 غ.مول−1 |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
ثلاثي أكسيد الكربون هو أكسيد غير مستقر للكربون، يتكون من ذرة كربون واحدة وثلاث ذرات أكسجين، بحيث أن له الصيغة المعتدلة CO3. يجب التمييز وعدم الخلط بين ثلاثي أكسيد الكربون وبين أنيون الكربونات 2−CO3.
التحضير
[عدل]يحضر المركب نظرياً من تفاعل ثنائي أكسيد الكربون CO2 مع الأكسجين الذري O، حيث يحدث التفاعل عند درجات حرارة مرتفعة وفي وسط من البلازما، حيث عثر على آثار من ثلاثي أكسيد الكربون في منطقة الانجراف للنفريغ الهالي corona discharge ذي الشحنة السالبة.[1] كما يمكن أن يحضر من تفاعل أحادي أكسيد الكربون مع الأكسجين الجزيئي.
من الطرق الأخرى للتحضير أيضاً تفاعل التفكك الضوئي للأوزون المنحل في ثنائي أكسيد الكربون السائل، أو في مزيج من ثنائي أكسيد الكربون مع سداسي فلوريد الكبريت CO2/SF6 عند درجة حرارة -45 °س، وذلك بالتعريض لإشعاع طول موجته 2537 أنغستروم.[2]
الخصائص
[عدل]
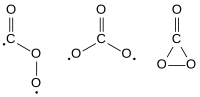
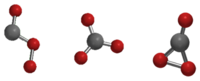
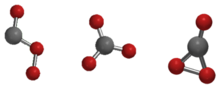
هناك ثلاثة بنى محتملة (متماكبات) لجزيء ثلاثي أكسيد الكربون من حيث التناظر الجزيئي وهي Cs و D3h و C2v. بيّنت الحسابات النظرية أن الشكل C2v هو الأكثر استقراراً، إذ أنه بذلك يعطي الحالة القاعية للجزيء.[3][4]
إن جزيء ثلاثي أكسيد الكربون غير مستقر، حيث يتفكك بشكل تلقائي حسب التفاعل:
يكون عمر الجزيء CO3 أقل من دقيقة واحدة.[2]
اقرأ أيضاً
[عدل]المراجع
[عدل]- ^ Sabin J. R., Kim H. (1971). "A theoretical study of the structure and properties of carbon trioxide". Chemical Physics Letters. ج. 11 ع. 5: 593–597. DOI:10.1016/0009-2614(71)87010-0. مؤرشف من الأصل في 2018-11-06.
- ^ ا ب DeMore W. B., Jacobsen C. W. (1969). "Formation of carbon trioxide in the photolysis of ozone in liquid carbon dioxide". Journal of Physical Chemistry. ج. 73 ع. 9: 2935–2938. DOI:10.1021/j100843a026.
- ^ Tim Kowalczyk, Electronic structure and spectroscopy of carbon trioxide [وصلة مكسورة] نسخة محفوظة 4 فبراير 2012 على موقع واي باك مشين.
- ^ T. Kowalczyk؛ A. I. Krylov (أغسطس 2007). "Electronic structure of carbon trioxide and vibronic interactions involving Jahn-Teller states". J. Phys. Chem. A. ج. 111 ع. 33: 8271–8276. DOI:10.1021/jp073627d. ISSN:1089-5639. PMID:17661455.