غليسرول
| Glycerol | |
|---|---|
 |
 |
| الاسم النظامي (IUPAC) | |
propane-1,2,3-triol |
|
| أسماء أخرى | |
glycerin |
|
| المعرفات | |
| رقم CAS | 56-81-5 |
| بوب كيم (PubChem) | 753 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
|
|
| الخواص | |
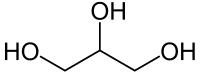
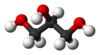
| صيغة كيميائية | C3H8O3 |
| كتلة مولية | 92.09 غ.مول−1 |
| المظهر | colorless liquid استرطاب |
| الرائحة | odorless |
| الكثافة | 1.261 g/cm3 |
| نقطة الانصهار | 17.8 °س، 291 °ك، 64 °ف |
| نقطة الغليان | 290 °س، 563 °ك، 554 °ف |
| معامل الانكسار (nD) | 1.4746 |
| اللزوجة | 1.412 Pa·s[1] |
| المخاطر | |
| صحيفة بيانات سلامة المادة | JT Baker |
| NFPA 704 |
|
| نقطة الوميض | 160 °م (320 °ف؛ 433 ك) (closed cup) 176 °م (349 °ف؛ 449 ك) (open cup) |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
الجليسرول[2] (ويعرف أيضاً باسم الجلسرين)[3] هو سائل لزج له طعم حلو، هيجروسكوبي، ليس له رائحة أو لون. الجليسرول هو كحول سكري وسبب ذوبانه في الماء هو وجود ثلاث مجاميع هيدروكسيل كحولية (-OH).
تفاعلاته الكيميائية
[عدل]للجليسرول استخدامات عديدة فهو مرطب للبشرة يستخدم في معظم كريمات البشرة ومستحضرات التجميل كما يدخل في صناعة النسيج لإٌكسابه النعومة وكذلك تحضير النيتروجليسرين.
وصف المادة
[عدل]سائل صاف عديم اللون جاذبة للرطوبة، يمتلك رائحة مميزة ضعيفة ليست قوية جداً وليست كريهة ، قابل للمزج مع الماء والكحول، عديم الانحلال في الكلوروفورم والأستر والزيوت الثابتة والطيارة، محاليلها حيادية الاستجابة لورقة دوار الشمس. وهي كذلك تباع مصنفة الألوان وله علاقه قويه بالدهون
الاستعمالات
[عدل]يستعمل الغليسيرين صيدلانياً كمادة حافظة حيوية ومادة مطرية ومرطبة وملدنة ومحلة ومحلية ورافعة للتوتر السطحي. توسيع الشرايين في علاج الأزمات القلبية، وكذلك يستعمل للعناية بالأظافر وكذلك المساعدة على النمو .
أهم فوائد الجلسرين كمستحضر تجميلي:
- يُعالج الجلسرين تشققاتِ الجلدِ خاصةً التي توجد في كعب القدم، ويمكن الحصول على نتائج إضافية إذا خلط بأوزان متساوية من الجلسرين وزيت اللوز وزيت الزيتون.
- يمنح الجلسرين البشرة النعومة ويمنع جفافها، فاستخدامه بشكل منتظم يجعل البشرة أكثر نعومة ورطوبة من الداخلِ والخارج.
- يزيل الجلسرين البقع الداكنة ويفتح البشرة إذا تم خلطه بكمية متساوية من عصير الليمون الطبيعي ثم يدهن الخليط على المنطقة المصابة، وعندما يمتص الجلد الخليط يشطف بالماء الفاتر.
- يستخدم في صناعة الأطعمة والمشروبات والحلويات[4]
- يستخدم كمادة أساسية لسائل السيجارة الإلكترونية.
حفظ المادة
[عدل]من الممكن أن يتبلور الغليسيرين إذا حفظ في درجات الحرارة المنخفضة، ولا تذوب هذه البلورات إلا إذا تم تسخينها لدرجة 20 درجة مؤية. لذلك يجب أن يحفظ الغليسرين في عبوات محكمة الإغلاق، في أماكن رطبة وباردة.
الإنتاج
[عدل]يتم الحصول على الجلسرين بشكل عام من مصادر نباتية وحيوانية حيث يتواجد في الدهون الثلاثية (ثلاثي الغليسريد) وهي استرات الجلسرين مع الأحماض الكربوكسيلية طويلة السلسلة. يؤدي التحلل المائي أو التصبن أو تحويل هذه الدهون الثلاثية إلى إنتاج الجلسرين بالإضافة إلى مشتق الأحماض الدهنية:
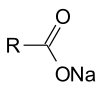
ويمكن تصبن الدهون الثلاثية (ثلاثي الغليسريد) مع هيدروكسيد الصوديوم لإعطاء الجلسرين وملح الصوديوم الدهني أو الصابون.
تشمل المصادر النباتية النموذجية فول الصويا وزيت النخيل، والشحم المشتق من الحيوانات. ويتم إنتاج ما يقرب من 950 ألف طن سنويًا في الولايات المتحدة وأوروبا؛ حيث تم إنتاج 350.000 طن من الجلسرين سنويًا في الولايات المتحدة وحدها من عام 2000 إلى عام 2004. [5] وقد وضع توجيه الاتحاد الاوربي 2003/30/EC [الإنجليزية] شرطًا يقضي باستبدال 5.75% من الوقود البترولي بمصادر الوقود الحيوي في جميع الدول الأعضاء في الاتحاد الأوروبي عام 2010. وفي عام 2006 كان المتوقع إنه بحلول عام 2020 سيكون الإنتاج أكثر من الطلب بستة أضعاف، مما يخلق فائضًا من الجلسرين كمنتج ثانوي لإنتاج الوقود الحيوي. [6]
يتم إنتاج الجلسرين من الدهون الثلاثية (ثلاثي الغليسريد) على نطاق واسع، ولكن المنتج الخام ذو جودة متفاوتة بسعر منخفض يصل إلى (0.02-0.05)$ دولار أمريكي للكيلوغرام الواحد حسب عام 2011. [7] ومن المُمكن تنقيته لكن ستكون العملية مكلفة. يتم حرق بعض الجلسرين للحصول على الطاقة لكن قيمته الحرارية منخفضة. [8]
يمكن تنقية الجلسرين الخام الناتج عن التحلل المائي للدهون الثلاثية (ثلاثي الغليسريد) عن طريق المعالجة بالكربون المنشط لإزالة الشوائب العضوية، والقلويات لإزالة استرات الجلسرين غير المتفاعلة، والتبادل الأيوني لإزالة الأملاح. بينما يتم الحصول على الجلسرين عالي النقاء بمستوى يفوق (99.5%) عن طريق التقطير الفوري متعدد المراحل [الإنجليزية]، تعد الغرفة المفرغة ضرورية نظرًا لارتفاع درجة غليانها (290° درجة مئوية). [6]
الجلسرين الاصطناعي
[عدل]بسبب إنتاج وقود الديزل الحيوي من الدهون على نطاق واسع، حيث يكون الجلسرين أحد منتجات النفايات، فإن سوق الجلسرين يعاني من الكساد. وبالتالي، فإن العمليات الاصطناعية ليست اقتصادية. ونظرًا لفائض العرض، تُبذل الجهود لتحويل الجلسرين إلى سلائف اصطناعية (Synthetic Precursors)، مثل الأكرولين والإبيكلوروهيدرين. [9]
على الرغم من أن الجلسرين عادة لا يكون فعالاً من حيث التكلفة لأنه يتم إنتاج الكثير من خلال معالجة الدهون، إلا أنه يمكن إنتاج الجلسرين بطرق مختلفة. وخلال الحرب العالمية الثانية، أصبحت عمليات الجلسرين الاصطناعية من أولويات الدفاع الوطني لأنها مقدمة للنيتروجليسرين. ويعتبر الإيبكلوروهيدرين هو من السلائف الأكثر أهمية. وبهلجنة البروبيلين ينتج كلوريد الأليل الذي يتأكسد مع الهيبوكلوريت إلى ثنائي كلوروهيدرين [الإنجليزية] والذي يتفاعل مع قاعدة قوية ليعطي الإبيكلوروهدرين، حيث يُمكن ان يتحلل الإيبكلوروهيدرين إلى الجلسرين. تشمل العمليات الخالية من الكلور من بروبيلين تخليق الجلسرين من الأكرولين وأكسيد البروبيلين. [6]
انظر أيضًا
[عدل]مراجع
[عدل]- ^ Segur، J. B.؛ Oberstar، H. E. (1951). "Viscosity of Glycerol and Its Aqueous Solutions". Industrial & Engineering Chemistry. ج. 43 ع. 9: 2117. DOI:10.1021/ie50501a040.
- ^ محمد هيثم الخياط (2006). المعجم الطبي الموحد: إنكليزي - عربي (بالعربية والإنجليزية) (ط. 4). بيروت: مكتبة لبنان ناشرون، منظمة الصحة العالمية. ص. 611. ISBN:978-9953-33-726-5. OCLC:192108789. QID:Q12193380.
- ^ مصطفى الشهابي (2003). أحمد شفيق الخطيب (المحرر). معجم الشهابي في مصطلحات العلوم الزراعية (بالعربية والإنجليزية واللاتينية) (ط. 5). بيروت: مكتبة لبنان ناشرون. ص. 835. ISBN:978-9953-10-550-5. OCLC:1158683669. QID:Q115858366.
- ^ Stevens, Alan. "Preserving flowers and decorative foliages with glycerin and dye" (PDF). مؤرشف من الأصل (PDF) في 2020-03-24.
- ^ Nilles, Dave (2005). "A Glycerin Factor". Biodiesel Magazine. مؤرشف من الأصل في 2007-11-08. اطلع عليه بتاريخ 2022-02-21.
- ^ ا ب ج Christoph، Ralf؛ Schmidt، Bernd؛ Steinberner، Udo؛ Dilla، Wolfgang؛ Karinen، Reetta (2006). "Glycerol". Ullmann's Encyclopedia of Industrial Chemistry. DOI:10.1002/14356007.a12_477.pub2. ISBN:3527306730.
- ^ San Kong، Pei؛ Kheireddine Aroua، Mohamed؛ Ashri Wan Daud، Wan Mohd (2016). "Conversion of crude and pure glycerol into derivatives: A feasibility evaluation". Renewable and Sustainable Energy Reviews. ج. 63: 533–555. DOI:10.1016/j.rser.2016.05.054.
- ^ Sims, Bryan (25 أكتوبر 2011). "Clearing the way for byproduct quality: why quality for glycerin is just as important for biodiesel". Biodiesel Magazine. مؤرشف من الأصل في 2021-04-29. اطلع عليه بتاريخ 2022-02-21.
- ^ Yu، Bin (2014). "Glycerol". Synlett. ج. 25 ع. 4: 601–602. DOI:10.1055/s-0033-1340636.
| في كومنز صور وملفات عن: غليسرول |