Porfiria cutánea tarda
| Porfiria cutánea tarda | ||
|---|---|---|
 | ||
| Especialidad | endocrinología | |
La porfiria cutánea tarda, porfiria cutánea tardía o porfiria hepatocutánea es una enfermedad metabólica perteneciente al grupo de las porfirias, y es la más frecuente de las mismas.[2] Su nombre proviene de las manifestaciones cutáneas que ocurren tardíamente a lo largo de la vida. La causa de la enfermedad es la deficiencia de la enzima uroporfirinógeno III descarboxilasa, que interviene en la formación del grupo hemo. Esta molécula es un componente de la hemoglobina, la molécula que transporta el oxígeno que hay en la sangre.
La porfiria hepatoeritropoyética es una forma homocigota de la porfiria cutánea tarda,[3] aunque también puede darse si concurren dos mutaciones diferentes en el mismo locus.
Clasificación
[editar]Algunas fuentes dividen la porfiria cutánea tarda en dos tipos: esporádico y familiar o hereditario.[3] Otras fuentes incluyen un tercer tipo[4] bastante menos común.
| Tipo | OMIM | Descripción |
|---|---|---|
| Tipo I ("esporádico") | 176090 | La porfiria cutánea tarda tipo I, la forma esporádica, se caracteriza por la deficiencia de UROD que se observa solo en los hepatocitos y en ningún otro tejido del organismo. Genéticamente, estos individuos no presentarán mutaciones en el gen UROD, aunque otros factores genéticos pueden tener un papel clave, como la deficiencia de HFE (que produce hemocromatosis y el acúmulo de hierro en el hígado). Estos pacientes presentarán típicamente una variedad amplia de factores de riesgo como la ingesta de alcohol e infección por virus de la hepatitis C, cuyos efectos dañinos se suman hasta resultar en las manifestaciones clínicas de PCT. |
| Tipo II ("familiar") | 176100 | Los pacientes con porfiria cutánea tarda tipo II tienen una deficiencia específica en el gen UROD, transmitida siguiendo un patrón autosómico dominante. Aquellos con esta deficiencia son heterocigotos para este gen, por lo que no muestran una falta de función completa de la uroporfirinógeno III descarboxilasa, sino una reducción de la actividad enzimática que se traduce en la reducción de la conversión de uroporfirinógeno a coproporfirinógeno. Por tanto, la expresión de uroporfirinógeno III descarboxilasa estará reducida en todos los tejidos biológicos del organismo, mientras que esto solo ocurre en el hígado de aquellos con PCT tipo I. Aunque la presencia de mutaciones específicas es la principal diferencia entre la PCT tipo I y tipo II, los factores de riesgo mencionados previamente también suelen darse en las personas con PCT tipo II. En realidad, muchas de las personas con mutaciones en el gen UROD no presentarán manifestaciones clínicas de PCT en toda su vida. |
| Tipo III | - | Es el tipo menos común y es similar al tipo I, ya que el paciente posee un gen UROD normal. A pesar de esto, la PCT tipo III se observa en más de un miembro de una familia, lo que hace sospechar que exista un componente genético desconocido actualmente y no relacionado con la expresión de uroporfirinógeno III descarboxilasa. |
Un estudio determinó una reducción del 74% de la actividad de UROD como el punto de corte para clasificar a los pacientes. Aquellos por encima de él serían tipo II o tipo III dependiendo de si existe o no una asociación familiar o tipo I si estuvieran por debajo.[5]
Se han observado en pacientes con PCT variaciones genéticas asociadas con la hemocromatosis que podrían ayudar a explicar la PCT familiar no asociada a deficiencias de uroporfirinógeno III descarboxilasa.[6]
Epidemiología
[editar]La porfiria cutánea tarda tiene una prevalencia aproximada de entre 5 y 10 personas de cada 100 000.[7] Se estima que un 80% de estos casos son esporádicos.
Etiología
[editar]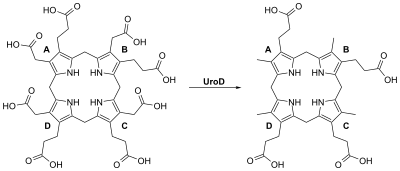

Las mutaciones heredadas en el gen UROD causan en torno al 20% de los casos de porfiria cutánea tarda y se clasifican como tipo II o hereditario. El otro 80% no presenta mutaciones en UROD y se clasifican como tipo I o esporádico. UROD codifica una enzima llamada uroporfirinógeno III descarboxilasa, que es imprescindible en el proceso de síntesis del grupo hemo. La actividad de esta enzima se reduce en torno a un 50% en todos los tejidos de las personas con la forma heredada de la enfermedad.
Factores no genéticos como el abuso del alcohol,[6] el exceso de hierro,[8] estrógenos o la infección por el virus de la hepatitis C[1] pueden aumentar la demanda de hemo y estimular la síntesis de enzimas requeridas para su producción. La combinación de esta demanda y la actividad reducida de la uroporfirinógeno III descarboxilasa afecta a la producción de este y permite que sus metabolitos intermediarios se acumulen en el organismo, desencadenando los signos y síntomas de la porfiria cutánea tarda.
El gen HFE produce una proteína que regula la absorción de hierro en el tubo digestivo y en las células del organismo. Alguna mutaciones de este gen causan hemocromatosis, una de las enfermedades por depósito de hierro. Las personas con mutaciones en este gen tienen un mayor riesgo de desarrollar porfiria cutánea tarda.
En el 20% de los casos en los que esta enfermedad se hereda, lo hace siguiendo un patrón autosómico dominante, lo que significa que una sola copia defectuosa del gen es suficiente para disminuir la actividad enzimática y causar los signos y síntomas del trastorno.
Otros
[editar]Además de las deficiencias congénitas de la enzima uroporfirinógeno III descarboxilasa que suelen llevar al desarrollo de PCT, existen además otros factores de riesgo que pueden causar o exacerbar los síntomas de la enfermedad. Uno de los más comunes es la infección por el virus de la hepatitis C.[9] Una revisión de artículos sobre la PCT documentó que hasta el 50% de los casos de porfiria cutánea tarda tienen además una infección por este virus. Otros factores de riesgo adicionales incluyen el abuso de alcohol, niveles altos de hierro, la exposición a hidrocarburos cíclicos clorados y al Agente Naranja.
Puede ser un síndrome paraneoplásico.[10]
Patogenia
[editar]La porfiria cutánea tarda tiene como causa principal la deficiencia de uroporfirinógeno III descarboxilasa (UROD). Esta enzima es un homodímero formado por dos subunidades. Participa en el quinto paso de la vía de síntesis del grupo hemo, y es activa en el citosol. La reacción catalizada tiene al coproporfirinógeno III como producto principal. Esto se produce mediante la eliminación en el sentido de las agujas del reloj de los cuatro grupos carboxilos presentes en la molécula cíclica de uroporfirinógeno III. Por tanto, una deficiencia de esta enzima causa la acumulación de uroporfirinógeno y porfirinógenos hepta-carboxílicos, y en menor medida de porfirinógenos hexa-carboxílicos y porfirinógenos penta-carboxílicos en la orina, que pueden ser útiles en el diagnóstico de este trastorno.[11][12]
Los signos dermatológicos de PCT, entre los cuales se incluyen las ampollas y las lesiones en zonas expuestas al sol son causadas por una acumulación de porfirinas (específicamente uroporfirinógeno) cerca de la superficie cutánea que son oxidadas por radicales libres o la luz del sol.[13] Las porfirinas oxidadas estimulan la desgranulación de mastocitos cutáneos,[14] que liberan proteasas que catabolizan las proteínas circundantes.[15] Esto desencadena un bucle de retroalimentación positiva mediado por células que encaja con la descripción de una reacción de hipersensibilidad tipo IV. Las ampollas resultantes, por tanto, no aparecen inmediatamente, sino que tardan en aparecer unos dos o tres días tras la exposición solar. Debido a la estructura altamente conjugada que tienen las porfirinas, debido a sus enlaces de carbonos simples y dobles alternados, estos compuestos exhiben un color morado oscuro, que se traduce en la decoloración observada en la piel. El abuso de alcohol reduce la producción de hepcidina, lo cual conlleva un aumento de la absorción intestinas de hierro y un aumento del estrés oxidativo. Este estrés oxidativo lleva a la inhibición de la uroporfirinógeno III descarboxilasa, creando un exceso de uroporfirinógeno III, el cual es oxidado desde su forma de porfirinógeno (relativamente inocua) a la forma reducida de porfirina, más dañina.[16] Un estrés oxidativo intenso (causado por alcohol, traumatismo, estrés psicológico, etc.) puede hacer que el hígado vierta estas porfirinas al torrente circulatorio, donde son susceptibles a la oxidación.
La fuerte asociación entre PCT y la infección por virus de la hepatitis C no se entiende completamente. Algunos estudios han sugerido que el efecto citopático del virus en los hepatocitos pueden llevar a la liberación de hierro libre. Este hierro puede interrumpir la actividad del citocromo p450, liberando especies reactivas de oxígeno. Estas pueden oxidar el substrato de UROD, el uroporfirinógeno III, lo cual puede causar en la inhibición UROD y disminuir su actividad enzimática.
El abuso de alcohol se asocia frecuentemente con la inducción de PCT[17] y el agravamiento de la enfermedad cuando existe un diagnóstico previo. Se piensa que hace esto causando daño oxidativo a las células hepáticas, lo que resulta en especies oxidadas de uroporfrinógeno III que inhiben la actividad de la UROD hepática. También se cree que aumenta la captación de hierro por los hepatocitos, lo cual conduce a una oxidación adicional del uroporfirinógeno III mediante la liberación de especies reactivas de oxígeno. Adicionalmente, la exposición a hidrocarburos cíclicos clorados pueden llevar a una deficiencia en la actividad de la uroporfirinógeno III descarboxilasa, causando la acumulación de uroporfirinógeno III extra. Además, el alcohol ha mostrado ser capaz de incrementar la actividad de la ácido aminolevulínico sintasa (ALA sintasa), que cataliza el paso limitante en la síntesis del grupo hemo en la mitocondria de ratas.[18] Por tanto, el alcohol puede incrementar la producción de uroporfirinógeno, exacerbando los síntomas de las personas con porfiria cutánea tarda.
Cuadro clínico
[editar]La porfiria cutánea tarda (abreviada como PCT) es uno de los tipos de porfirias más prevalentes.[19]
La enfermedad se caracteriza por onicólisis y formación de ampollas en las áreas cutáneas más expuestas a la luz solar. La causa de la enfermedad es una deficiencia de la enzima uroporfirinógeno III descarboxilasa (UROD), una enzima citosólica que cataliza una reacción de la vía metabólica de la síntesis del grupo hemo. Además de esto, existen varios factores genéticos y ambientales asociados a la PCT.[20]
Normalmente, los pacientes diagnosticados de PCT buscan tratamiento tras la aparición de ampollas y erosiones en áreas expuestas de la piel, consecuencia de la fotosensibilidad. Son más comunes en la cara, manos, antebrazos y piernas. Estas ampollas curan lentamente y forman cicatrices. Aunque las ampollas son la manifestación cutánea más común de la PCT, se han descrito otras como la hiperpigmentación y la hipertricosis (especialmente en las mejillas). La porfiria cutánea tarda es una enfermedad crónica, y los síntomas cutáneos suelen recurrir. Además de los problemas de la piel, es extremadamente común que existan problemas hepáticos crónicos concomitantes en pacientes con la forma esporádica de porfiria cutánea tarda. Se incluyen entre estos la fibrosis, cirrosis e inflamación. Sin embargo, los problemas hepáticos son menos comunes en los pacientes con la forma heredada de la enfermedad.[21] Además, los pacientes suelen tener una orina del color del vino tinto con una concentración aumentada de uroporfirina I debido al déficit enzimático.[22]
Deficiencias de minerales, vitaminas y enzimas
[editar]Algunas deficiencias vitamínicas, enzimáticas y de minerales suelen encontrarse en personas con porfiria cutánea tarda. Las más comunes son las de beta-carotenos,[23] retinol,[24] vitamina A[25] y vitamina C. El beta-caroteno es uno de los metabolitos necesarios para la síntesis de vitamina A, que a su vez se necesita en la producción de retinol. La falta de proteína ligadora de retinol se debe a la falta de retinol, que estimula su síntesis.[25]
Los efectos dañinos de las porfirinas que interactúan con hierro, al absorber fotones que emiten especies reactivas de oxígeno son el principal mecanismo de acción que resultan en las ampollas dolorosas y pruriginosas que se dan en la porfiria cutánea tarda.[23] Las especies reactivas de oxígeno interactúan y deplecionan los antioxidantes de la piel, principalmente beta-caroteno, vitamina C y vitamina E. Suplementar estas tres moléculas parece reducir los efectos oxidativos y podrían disminuir la severidad de las ampollas.[26] Ninguna de estas tres vitaminas inhibe los efectos dañinos de las porfirinas oxidadadas, específicamente uroporfirinas y coproporfirinas, pero el conjunto de las tres actúa sinérgicamente y es capaz de neutralizar sus efectos dañinos.
Diagnóstico
[editar]A pesar de que el síntoma más usual de la porfiria cutánea tarda sea la aparición de lesiones cutáneas y ampollas, la presencia de estas no se considera patognomónica. Las pruebas bioquímicas revelarán normalmente una alta concentración de uroporfirinógeno en la orina, lo que se conoce como uroporfirininogenuria. Además, se recomienda realizar pruebas para averiguar si se dan otros factores de riesgo, como hepatitis C y hemocromatosis, ya que requieren tratamiento adicional y su prevalencia en pacientes con PCT es muy alta. Si las pruebas bioquímicas son negativas pero la sospecha clínica de PCT persiste alta, se debería considerar el diagnóstico de pseudoporfiria.
Tratamiento
[editar]Ya que la PCT es una enfermedad crónica, debe ser tratada de forma integral para un control eficaz. Es especialmente importante evitar el consumo de alcohol, suplementos de hierro, estrógenos, reducir en la medida de lo posible la luz solar (especialmente en verano) y la exposición a hidrocarburos cíclicos clorados, ya que pueden exacerbar los síntomas de la enfermedad. Además, para tratar el exceso de hierro (debido a la asociación frecuente de hemocromatosis y PCT) se pueden realizar sangrías, siendo uno de los pocos usos de este tratamiento en la medicina actual. Una deficiencia moderada de hierro, sin llegar a la anemia parece tener un efecto protector al limitar la síntesis del grupo hemo. La ausencia de hierro, el cual se incorpora a la porfirina formada en el último paso de la síntesis del hemo, hace que una proteína de respuesta al hierro (IRP) se una al elemento de respuesta al hierro (IRE) del ARN mensajero de la proteína δ-aminolevulinato sintasa (ALAS2) eritroide en el citosol, lo cual inhibe la traducción de la enzima.[27]
Algunos antipalúdicos pueden ser usados a bajas dosis.[28] La cloroquina oral se absorbe bien en el intestino y se distribuye bien en el corazón, hígado, pulmón y riñones.[29] Su mecanismo de acción consiste en retirar el exceso de porfirinas del hígado aumentando su excreción mediante la formación de un complejo con el hierro de la porfirina, además de un puente de hidrógeno entre la cadena lateral de propionato de la porfirina y el átomo de nitrógeno protonado de la quinuclidina del alcaloide.[30] Debido a la presencia del átomo de cloro, el complejo es más hidrosoluble, lo cual incrementa la excreción renal y la retirada de la circulación sanguínea.[31][32] El tratamiento con cloroquina podría exacerbar paradójicamente los ataques de porfiria.[29] La remisión completa suele darse entre los 6 y 12 meses de tratamiento y cada dosis de antipalúdico solo puede eliminar una cantidad finita de porfirina, que pueden haber estado acumulándose durante décadas. Antiguamente solían usarse dosis más altas, pero no se recomienda hoy día debido a la hepatotoxicidad de estos medicamentos.[33][34] Por último, se debe dar tratamiento para la Hepatitis C si se da también el paciente. La cloroquina, hidroxicloroquina y las sangrías son el tratamiento usual de la enfermedad.[35]
Pronóstico
[editar]La respuesta al tratamiento es favorable al menos en el 90% de los casos. Las recaídas son más frecuentes en los pacientes que continúan bebiendo alcohol o fumando. Se recomienda la medición anual de los niveles de uroporfirina en plasma u orina para prevenir estas recaídas.[7] La toma oral de estrógenos es un factor de riesgo conocido, pero no parecen existir problemas cuando se administran por vía transdérmica.[36]
Sociedad y cultura
[editar]La porfiria cutánea tarda podría estar relacionada con el mito del vampiro. Esto es porque las personas con esta enfermedad evitan la exposición al sol debido a la fotosensibilidad e incluso pueden tener desfiguradas sus narices, párpados, labios y encías, lo que hace que sus colmillos se muestren prominentes.
Porfiria cutánea tarda es el nombre una canción del grupo de rock AFI en su álbum Black Sails in the Sunset, lanzado el 18 de mayo de 1999.
Véase también
[editar]Referencias
[editar]- ↑ a b «Porphyria Cutanea Tarda (PCT)» (en inglés). Consultado el 12 de enero de 2020.
- ↑ Phillips, J. D.; Bergonia, H. A.; Reilly, C. A.; Franklin, M. R.; Kushner, J. P. (2007). «A porphomethene inhibitor of uroporphyrinogen decarboxylase causes porphyria cutanea tarda». Proceedings of the National Academy of Sciences (en inglés) 104 (12): 5079-84. Bibcode:2007PNAS..104.5079P. JSTOR 25427147. PMC 1820519. PMID 17360334. doi:10.1073/pnas.0700547104.
- ↑ a b porphyria cutanea tarda en el Diccionario Médico de Dorland
- ↑ Méndez, M.; Poblete-Gutiérrez, P.; García-Bravo, M.; Wiederholt, T.; Morán-Jiménez, M.J.; Merk, H.F.; Garrido-Astray, M.C.; Frank, J.; Fontanellas, A.; Enríquez De Salamanca, R. (2007). «Molecular heterogeneity of familial porphyria cutanea tarda in Spain: Characterization of 10 novel mutations in the UROD gene». British Journal of Dermatology (en inglés) 157 (3): 501-7. PMID 17627795. doi:10.1111/j.1365-2133.2007.08064.x.
- ↑
- ↑ a b Frank, J; Poblete-Gutiérrez, P; Weiskirchen, R; Gressner, O; Merk, H. F.; Lammert, F (2006). «Hemochromatosis gene sequence deviations in German patients with porphyria cutanea tarda». Physiological Research (en inglés). 55 Suppl 2: S75-83. PMID 17298224.
- ↑ a b Bissell, Montgomery; Anderson, Karl E.; Bonkovsky, Herbert L. (2017). «Porphyria». New England Journal of Medicine (en inglés) 377: 862-872. ISSN 0028-4793. doi:10.1056/NEJMra1608634.
- ↑ Sampietro, M; Fiorelli, G; Fargion, S (1999). «Iron overload in porphyria cutanea tarda». Haematologica (en inglés) 84 (3): 248-53. PMID 10189391.
- ↑ Azim, James; McCurdy, H; Moseley, R. H (2008). «Porphyria cutanea tarda as a complication of therapy for chronic hepatitis C». World Journal of Gastroenterology (en inglés.) 14 (38): 5913-5. PMC 2751904. PMID 18855993. doi:10.3748/wjg.14.5913.
- ↑ Sökmen, M; Demirsoy, H; Ersoy, O; Gökdemir, G; Akbayir, N; Karaca, C; Ozdil, K; Kesici, B; Calişkan, C; Yilmaz, B (2007). «Paraneoplastic porphyria cutanea tarda associated with cholangiocarcinoma: Case report». The Turkish Journal of Gastroenterology (en inglés) 18 (3): 200-5. PMID 17891697.
- ↑ «Porphyrin Tests» (en inglés). Consultado el 30 de enero de 2020.
- ↑ Jackson, A. H.; Ferramola, A. M.; Sancovich, H. A.; Evans, N; Matlin, S. A.; Ryder, D. J.; Smith, S. G. (1976). «Hepta- and hexa-carboxylic porphyrinogen intermediates in haem biosynthesis». Annals of Clinical Research (en inglés). 8 Suppl 17: 64-9. PMID 1008499.
- ↑ Miller, Dennis M.; Woods, James S. (1993). «Urinary porphyrins as biological indicators of oxidative stress in the kidney». Biochemical Pharmacology (en inglés) 46 (12): 2235-41. PMID 8274157. doi:10.1016/0006-2952(93)90614-3.
- ↑ Brun, Atle; Sandberg, Sverre (1991). «Mechanisms of photosensitivity in porphyric patients with special emphasis on erythropoietic protoporphyria». Journal of Photochemistry and Photobiology B: Biology (en inglés) 10 (4): 285-302. PMID 1791486. doi:10.1016/1011-1344(91)80015-A.
- ↑ Lim, H. W. (1989). «Mechanisms of phototoxicity in porphyria cutanea tarda and erythropoietic protoporphyria». Immunology Series (en inglés) 46: 671-85. PMID 2488874.
- ↑ Ryan Caballes, F.; Sendi, Hossein; Bonkovsky, Herbert L. (2012). «Hepatitis C, porphyria cutanea tarda and liver iron: An update». Liver International (en inglés) 32 (6): 880-93. PMC 3418709. PMID 22510500. doi:10.1111/j.1478-3231.2012.02794.x.
- ↑ Porphyria Cutánea Tarda en eMedicine
- ↑ Held, H. (2009). «Effect of Alcohol on the Heme and Porphyrin Synthesis Interaction with Phenobarbital and Pyrazole». Digestion (en inglés) 15 (2): 136-46. PMID 838185. doi:10.1159/000197995.
- ↑ Danton, Malcolm; Lim, Chang Kee (2007). «Porphomethene inhibitor of uroporphyrinogen decarboxylase: Analysis by high-performance liquid chromatography/electrospray ionization tandem mass spectrometry». Biomedical Chromatography (en inglés) 21 (7): 661-3. PMID 17516469. doi:10.1002/bmc.860.
- ↑ Kushner, J P; Barbuto, A J; Lee, G R (1976). «An inherited enzymatic defect in porphyria cutanea tarda: Decreased uroporphyrinogen decarboxylase activity». Journal of Clinical Investigation (en inglés) 58 (5): 1089-97. PMC 333275. PMID 993332. doi:10.1172/JCI108560.
- ↑ Di Padova, C.; Marchesi, L.; Cainelli, T.; Gori, G.; Podenzani, S.A.; Rovagnati, P.; Rizzardini, M.; Cantoni, L. (1983). «Effects of Phlebotomy on Urinary Porphyrin Pattern and Liver Histology in Patients with Porphyria Cutanea Tarda». The American Journal of the Medical Sciences (en inglés) 285 (1): 2-12. PMID 6824014. doi:10.1097/00000441-198301000-00001.
- ↑ Goljan, E. F. (2011). Pathology (3rd ed., rev. reprint.). Philadelphia, PA: Mosby/Elsevier.[página requerida]
- ↑ a b Rocchi, E.; Stella, A. M.; Cassanelli, M.; Borghi, A.; Nardella, N.; Seium, Y.; Casalgrandi, G. (1 de julio de 1995). «Liposoluble vitamins and naturally occurring carotenoids in porphyria cutanea tarda». European Journal of Clinical Investigation (en inglés) 25 (7): 510-514. PMID 7556369. doi:10.1111/j.1365-2362.1995.tb01737.x.
- ↑ Rocchi, E.; Casalgrandi, G.; Masini, A.; Giovannini, F.; Ceccarelli, D.; Ferrali, M.; Marchini, S.; Ventura, E. (1 de diciembre de 1999). «Circulating pro- and antioxidant factors in iron and porphyrin metabolism disorders». Italian Journal of Gastroenterology and Hepatology (en inglés) 31 (9): 861-867. PMID 10669994.
- ↑ a b Benoldi, D.; Manfredi, G.; Pezzarossa, E.; Allegra, F. (1 de diciembre de 1981). «Retinol binding protein in normal human skin and in cutaneous disorders». The British Journal of Dermatology (en inglés) 105 (6): 659-665. PMID 7032574. doi:10.1111/j.1365-2133.1981.tb00976.x.
- ↑ Böhm, F.; Edge, R.; Foley, S.; Lange, L.; Truscott, T. G. (31 de diciembre de 2001). «Antioxidant inhibition of porphyrin-induced cellular phototoxicity». Journal of Photochemistry and Photobiology. B, Biology (en inglés) 65 (2–3): 177-183. PMID 11809377. doi:10.1016/s1011-1344(01)00259-7.
- ↑ Thunell, S (2000). «Porphyrins, porphyrin metabolism and porphyrias. I. Update». Scandinavian Journal of Clinical and Laboratory Investigation (en inglés) 60 (7): 509-40. PMID 11202048. doi:10.1080/003655100448310.
- ↑ Singal, Ashwani K.; Kormos–Hallberg, Csilla; Lee, Chul; Sadagoparamanujam, Vaithamanithi M.; Grady, James J.; Freeman, Daniel H.; Anderson, Karl E. (2012). «Low-Dose Hydroxychloroquine is as Effective as Phlebotomy in Treatment of Patients with Porphyria Cutanea Tarda». Clinical Gastroenterology and Hepatology (en inglés) 10 (12): 1402-9. PMC 3501544. PMID 22985607. doi:10.1016/j.cgh.2012.08.038.
- ↑ a b «Resochín (cloroquina fosfato)». Agencia Española de Medicamentos y Productos Sanitarios. Consultado el 30 de enero de 2020.
- ↑ De Villiers, Katherine A.; Gildenhuys, Johandie; Le Roex, Tanya (2012). «Iron(III) Protoporphyrin IX Complexes of the Antimalarial Cinchona Alkaloids Quinine and Quinidine». ACS Chemical Biology (en inglés) 7 (4): 666-71. PMID 22276975. doi:10.1021/cb200528z.
- ↑ Asghari-Khiavi, Mehdi; Vongsvivut, Jitraporn; Perepichka, Inna; Mechler, Adam; Wood, Bayden R.; McNaughton, Don; Bohle, D. Scott (2011). «Interaction of quinoline antimalarial drugs with ferriprotoporphyrin IX, a solid state spectroscopy study». Journal of Inorganic Biochemistry (en inglés) 105 (12): 1662-9. PMID 22079977. doi:10.1016/j.jinorgbio.2011.08.005.
- ↑ Alumasa, John N.; Gorka, Alexander P.; Casabianca, Leah B.; Comstock, Erica; De Dios, Angel C.; Roepe, Paul D. (2011). «The hydroxyl functionality and a rigid proximal N are required for forming a novel non-covalent quinine-heme complex». Journal of Inorganic Biochemistry (en inglés) 105 (3): 467-75. PMC 3010338. PMID 20864177. doi:10.1016/j.jinorgbio.2010.08.011.
- ↑ Sweeney, G. D.; Saunders, S. J.; Dowdle, E. B.; Eales, L (1965). «Effects of Chloroquine on Patients with Cutaneous Porphyria of the "symptomatic" Type». British Medical Journal (en inglés) 1 (5445): 1281-5. PMC 2166040. PMID 14278818. doi:10.1136/bmj.1.5445.1281.
- ↑ Scholnick, Perry L.; Epstein, John; Marver, Harvey S. (1973). «The Molecular Basis of the Action of Chloroquine in Porphyria Cutanea Tarda». Journal of Investigative Dermatology (en inglés) 61 (4): 226-32. PMID 4744026. doi:10.1111/1523-1747.ep12676478.
- ↑ Sarkany, R. P. E. (2001). «The management of porphyria cutanea tarda». Clinical and Experimental Dermatology (en inglés) 26 (3): 225-32. PMID 11422163. doi:10.1046/j.1365-2230.2001.00825.x.
- ↑ Bulaj, Zaneta J.; Franklin, Michael R.; Phillips, John D.; Miller, Karen L.; Bergonia, Hector A.; Ajioka, Richard S.; Griffen, Linda M.; Guinee, Donald J.; Edwards, Corwin Q.; Kushner, James P. (2000). «Transdermal estrogen replacement therapy in postmenopausal women previously treated for porphyria cutanea tarda». Journal of Laboratory and Clinical Medicina (en inglés) 136 (6): 482-488. ISSN 0022-2143. doi:10.1067/mlc.2000.111024.
Enlaces externos
[editar]- Esta obra contiene una traducción parcial derivada de «Porphyria cutanea tarda» de Wikipedia en inglés, concretamente de esta versión del 26 de diciembre de 2019, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
