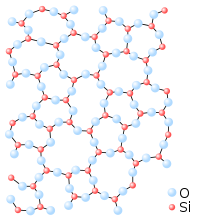
Solido

Egoera solidoa edo gotorra deformazioarekiko eta bolumen aldaketekiko erresistentea den materiaren egoera bat da. Presioa konstante mantenduz eta tenperatura baxuan, solidoek gehienetan kristal-egiturak osatzen dituzte[1]. Horri esker, indarrak jasan ditzake itxura batean deformatu gabe. Hortaz, multzo zurrunak, konprimiezinak, gogorrak eta erresistenteak izan ohi dira. Bolumen konstantea daukate eta ez dira hedatzen.
- Egoera solidoaren fisikak, materia kondentsatua, modu esperimentalean eta teorikoan aztertzen du, hau da, 1019 atomo baino gehiago elkarren artean kontaktua dituzten likidoak eta solidoak[2].
- Solido deformagarrien mekanikak medio jarraituen mekanikaren ikuspegitik aztertzen ditu propietate mikroskopikoak, hala nola tentsioa, deformazioa eta magnitude termodinamikoak[3], eta ez du barne-egitura atomikorik ezagutzen, arazo mota batzuetarako ez baita garrantzitsua.
- Materialen zientzia batez ere solidoen propietateez arduratzen da, hala nola egitura eta fase-transformazioez[4].
- Egoera solidoaren kimika material berrien sintesian espezializatzen da.
Ezagutzen den solidorik arinena material artifizial bat da: aerogela, 3 mg/cm3 edo 3 kg/m3-ko dentsitatearekin; beira, 1,9 g/cm3-ko dentsitatearekin; dentsitaterik trinkoena duena, berriz, metal bat da: osmioa (Os), 22,6 g/cm3-ko[5].
Deskribapen mikroskopikoa
[aldatu | aldatu iturburu kodea]
Atomoak, molekulak edo ioiak osatzen dituzten solidoak errepikapen-eredu ordenatu batean, edo modu irregularrean egon daitezke. Osagaiak eredu erregular batean dituzten materialei kristalak esaten zaie. Kasu batzuetan, ordenamendu erregularrak eskala handian jarrai dezake etengabe, diamanteetan adibidez, non diamante bakoitza kristal bakarrekoa den. Ikusteko eta manipulatzeko bezain handiak diren objektu solidoak gutxitan izaten dira kristal bakar batez osatuak, normalean, kristal indibidual ugariz osatuak izaten dira, klasto izenaz ezagutzen direnak, eta horien tamaina nanometro gutxi batzuetatik metro batzuetaraino alda daitezke. Material horiei polikristal deitzen zaie. Metal arrunt gehienak eta zeramiko asko polikristalinoak dira.
Beste material batzuetan, ez dago irismen luzeko ordenarik atomoen posizioan. Solido horiei solido amorfo esaten zaie; adibide batzuek poliestirenoa eta beira dira.
Solido bat kristalinoa edo amorfoa izatea kasuan kasuko materialaren eta hura eratzeko baldintzen araberakoa da. Hozte geldoaren bidez sortzen diren solidoek kristalinoak izateko joera dute, eta azkar izozten direnak, berriz, amorfoak izateko joera handiagoa dute. Era berean, solido kristalino batek hartzen duen kristal-egitura espezifikoa material horren eta hura sortzeko moduaren araberakoa da.
Objektu komun asko, izotz-kubitu bat edo txanpon bat kasu, kimikoki guztiz berdinak diren bitartean, beste material komun asko elkarren artean lotutako substantzia ezberdinez osatuta daude. Adibidez, harri tipiko bat mineral eta mineraloide ezberdinen agregatua da, konposizio kimiko espezifikorik gabe. Zura material organiko naturala da, batez ere lignina organikoaren matrize batean txertatutako zelulosazko zuntzez osatua. Materialen zientzian, material konposatzaile bat baino gehiagoko konpositeak nahi diren propietateak izateko diseina daitezke.
Solido baten propietateak
[aldatu | aldatu iturburu kodea]- Elastikotasuna: Solido bat deformatzen denean, jatorrizko forma berreskuratzen du[6]. Malguki batean ikus dezakegu propietate hori, jatorrizko formara itzultzen baita.
- Hauskortasuna: Solido bat zati askotan hauts daiteke (hauskorra)[7].
- Gogortasuna: Gogortasuna da materialek hainbat alteraziori eskaintzen dieten aurkakotasuna, hala nola sartzeari, urratzeari, marratzeari, ebakitzeari eta deformazio iraunkorrei, besteak beste. Diamantea gogortasun handiko solidoa da.
- Forma zehaztua: Forma zehaztua dute; nahiko zurrunak dira, eta ez dira isurtzen gasak eta likidoak bezala, ingurunearen muturreko presiopean izan ezik.
- Dentsitate handia: Solidoek dentsitate altu samarrak dituzte molekulen hurbiltasunagatik. Horregatik esaten da astunagoak direla.
- Flotagarritasuna: Solido batzuek ezaugarri hori betetzen dute baldin eta bere dentsitatea kokatzen den likidoarena baino txikiagoa bada.
- Inertzia: sistema fisiko batek edo sistema sozial batek izan ditzakeen aldaketen aurka jartzen duen zailtasuna edo erresistentzia da; solidoen kasuan, bere atseden-egoera aldatzeko erresistentzia jartzen du.
- Irmotasuna: Materialen zientzian, irmotasun edo tinkotasuna material batek pitzadurak edo artesituak hedatzearen aurka egiten duen erresistentzia da.
- Xaflakortasuna: Materiaren propietatea da, gorputzak deformazioz lantzen dituena. Xaflakortasunak material-xafla meheak lortzeko aukera ematen du, hautsi gabe, eta elkarren artean duten ezaugarria da ez dagoela horiek kuantifikatzeko metodorik.
- Harikortasuna: Harikortasuna dagokio solidoetatik hariak lortzeko duten gaitasunari.
- Zurruntasuna: Solido batzuek beste batzuek baino gehiago eutsi diezaiekete tolestura eta bihurdurei.
- Deformazioa: Solido batzuk deformatu daitezke hautsi gabe, eta beste forma bat har dezakete.
- Aleagarritasuna: Aleagarritasuna da aleazioak osatzeko materialek duten gaitasuna material berriak sortzeko eta prestazioak hobetzeko.
- Bero espezifikoa: Substantzia baten bero-ahalmenaren tenperatura 1° C igotzeko behar den energia da.
Solido motak
[aldatu | aldatu iturburu kodea]Solido baten atomoen arteko indarrek forma desberdinak har ditzakete. Adibidez, sodio klorurozko kristala (gatz arrunta) sodio eta kloro ioiek osatzen dute, eta lotura ionikoen bidez lotuta mantentzen dira[8]. Diamantean[9] edo silizioan, atomoek elektroiak partekatzen dituzte, eta lotura kobalenteak osatzen dituzte[10]. Metaletan, elektroiak lotura metaliko bidez partekatzen dira[11]. Solido batzuk, bereziki konposatu organiko gehienak, Van der Waalsen indarrarekin elkartuta mantentzen dira, molekula bakoitzean karga elektronikoko hodeia polarizatzearen ondorioz. Solido-moten arteko desberdintasunak haien loturen arteko desberdintasunen ondorio dira.
Metalak
[aldatu | aldatu iturburu kodea]
Metalak indartsuak, trinkoak eta eroale onak izaten dira, bai elektrizitatearenak, bai beroarenak[12][13]. Taula periodikoko elementu gehienak, borotik poloniora doan lerro diagonal baten ezkerraldean daudenak metalak dira. Osagai nagusia metal bat duten bi elementuren edo gehiagoren nahasketei aleazioak esaten zaie.
Historiaurretik, gizakiak hainbat helburutarako erabili ditu metalak. Metalen indarrak eta fidagarritasunak, orokorrean, eraikinen eta bestelako egituren eraikuntzan erabiltzera eraman ditu, baita ibilgailu gehienetan, aparatu eta erreminta askotan, hodietan, trafiko-seinaleetan eta trenbideetan ere. Burdina eta aluminioa dira gehien erabiltzen diren egitura-metalak. Lurrazalean ere metal ugarienak dira. Burdina, batez ere aleazio moduan erabiltzen da, altzairua, % 2,1 arteko karbonoa duena, eta horrek burdina purua baino askoz gogorragoa egiten du.
Metalak elektrizitatearen eroale onak direnez, baliotsuak dira tresna elektrikoetan eta energia gutxi galdu edo desegiten duten korronte elektrikoa distantzia luzeetan garraiatzeko. Horrela, sare elektrikoak kable metalikoetan oinarritzen dira elektrizitatea banatzeko. Etxeko sistema elektrikoak, adibidez, kobrez kableatzen dira propietate eroale onak dituztelako eta mekanizazio erraza dutelako. Metal gehienen eroankortasun termiko handiak sukaldeko tresnetarako ere balio du.
Elementu metalikoen eta horien aleazioen azterketa egoera solidoaren kimikaren, fisikaren, materialen zientziaren eta ingeniaritzaren zati garrantzitsua da.
Solido metalikoak elektroi partekatu eta deslokalizatuen dentsitate handi batek lotzen ditu, lotura metaliko gisa ezagutzen dena. Metal batean, atomoek erraz galtzen dituzte kanpoko elektroiak (balentzia) ioi positiboak osatuz. Elektroi askeak solido osoan zehar banatzen dira, eta solido hori ioien eta elektroi-hodeien arteko interakzio elektrostatikoen bidez lotzen da[14]. Elektroi askeen kopuru handiak eroankortasun elektriko eta termikoko balio handiak ematen dizkie metalei. Elektroi libreek ere argi ikusgaiaren transmisioa eragozten dute metalak opakoak, dirdiratsuak eta distiratsuak izan daitezen.
Metalen propietateen eredu aurreratuenek ioi-nukleo positiboek elektroi deslokalizatuetan duten eragina hartzen dute kontuan. Metal gehienek kristal-egitura dutenez, ioi horiek sare periodiko batean egoten dira. Matematikoki, nukleo ionikoen potentziala hainbat ereduren bidez trata daiteke, errazena izanik elektroi ia libreen eredua.
Mineralak
[aldatu | aldatu iturburu kodea]
Mineralak solido naturalak dira, presio handiko prozesu geologikoen bidez sortuak[15]. Benetako mineral gisa sailkatua izateko, substantzia batek kristal-egitura bat izan behar du, eta propietate fisiko guztiak uniformeak izan behar ditu. Mineralen osaera elementu puru eta gatz sinplenetatik milaka forma ezagun dituzten silikato oso konplexuetara aldatzen da. Aldiz, arroka-lagin bat mineralen eta/edo mineraloideen ausazko agregatua da, eta ez du konposizio kimiko espezifikorik. Lurrazaleko arroka gehienak kuartzoz (SiO2 kristalinoa), feldespatoz, mikaz, kloritaz, kaolinitaz, kaltzitaz, epidotaz, olibinoaz, augitaz, hornblendaz, magnetitaz, hematitez, limonitaz eta beste mineral batzuez osatuta daude. Mineral batzuk (kuartzoa, mika edo feldespatoa adibidez) ohikoak dira, eta beste batzuk, berriz, munduko leku gutxi batzuetan baino ez dira aurkitu. Mineral multzo handiena silikatoena da, alde handiarekin (harri gehienak ≥% 95 silikato dira), neurri handi batean silizioz eta oxigenoz osatuak, aluminio, magnesio, burdina, kaltzio eta beste metal batzuen ioiak gehituz.
Zeramika
[aldatu | aldatu iturburu kodea]
Solido zeramikoak konposatu ez-organikoz osatuta daude, normalean elementu kimikoen oxidoz[16]. Kimikoki inerteak dira, eta, sarritan, ingurune azido edo kaustiko batean sortzen den higadura kimikoa jasateko gai dira. Zeramikazko materialek, oro har, tenperatura altuak jasan ditzakete, 1000 eta 1600° C artean (1800 eta 3000° F bitartean). Salbuespenak herdoildu gabeko material ez-organikoak dira, hala nola nitruroak, boruroak eta karburoak.
Lehengai zeramiko tradizionalen artean, buztinezko mineralak daude, hala nola kaolinita; material berrienen artean, aluminio oxidoa dago (alumina). Zeramika aurreratu gisa sailkatutako zeramikazko material modernoek, silizio-karburoa eta tungsteno-karburoa hartzen dituzte. Biak urradurarekiko erresistentziagatik baloratzen dira, eta horregatik erabiltzen dira meatze-eragiketetan birrintze-ekipoen higadura-plakak bezalako aplikazioetan.
Zeramikazko material gehienak, hala nola alumina eta bere konposatuak, hauts finetatik sortzen dira, eta ale fineko polikristalino bat sortzen da, argia barreiatzeko erdigunez beteta dagoena eta argi ikusgaiaren uhin-luzerarekin aldera daitezkeenak. Beraz, material opakoak izaten dira material gardenak ez bezala. Hala ere, nanoeskalako teknologia berriak (adibidez, sol-gel) zeramika garden polikristalinoak ekoiztea ahalbidetu du, hala nola alumina gardena eta alumina konposatuak, potentzia handiko laserrak bezalako aplikazioetarako. Zeramika aurreratua medikuntzan eta industria elektriko eta elektronikoan ere erabiltzen da.
Zeramika teknikoa da egoera solidoan dauden material, pieza eta gailu zeramikoak sortzeko zientzia eta teknologia. Hori beroaren eraginez, edo, tenperatura baxuagoetan, soluzio kimikoetatik abiatuz prezipitazio-erreakzioak erabiliz egiten da. Terminoaren barruan sartzen dira: lehengaiak garbitzea, konposatu kimikoak aztertzea eta ekoiztea, osagaietan eratzea eta horien egitura, osaera eta propietateak aztertzea.
Ikuspegi mekanikotik, zeramikazko materialak dira: hauskorrak, gogorrak, konpresioarekiko indartsuak eta ahulak zizaila eta tentsiorako. Material hauskorrek trakzioarekiko erresistentzia handia izan dezakete, karga estatikoa jasaten baitute. Gogortasunak material batek mekanikoki huts egin aurretik zenbat energia xurgatu dezakeen adierazten du, eta hausturarekiko tinkotasunak (KIc denotatua) deskribatzen du berezko akats mikroestrukturalak dituen material batek pitzadurak hazi eta hedatuz hausturari aurre egiteko duen gaitasuna. Material batek hausturarekiko erresistentzia-balio handia badu, hausturaren mekanikaren oinarrizko printzipioek iradokitzen dute litekeena dela haustura harikorra izatea. Haustura hauskorra oso bereizgarria da zeramikazko eta bitrozeramikazko material gehienetan, eta KIc-ren balio baxuak (eta sendotasunik gabeak) izaten dituzte.
Zeramikaren aplikazioen adibide gisa, zirkonioaren muturreko gogortasuna labana-orriak fabrikatzeko erabiltzen da, baita ebaketa industrialeko beste erreminta batzuetan ere. Alumina, boro-karburoa eta silizio-karburoa bezalako zeramikak erabili dira balen aurkako txalekoetan kalibre handiko errifleen tiroei aurre egiteko. Silizio nitrurozko piezak zeramikazko bola-errodamenduetan erabiltzen dira, gogortasun handia dutenez higadurarekiko erresistenteak baitira. Oro har, zeramikak ere kimikoki erresistenteak dira, eta altzairuzko kojineteek oxidazioa (edo herdoila) izan dezaketen ingurune hezeetan erabil daitezke.
80ko hamarkadaren hasieran, zeramikaren aplikazioen beste adibide bat da Toyotak 6.000 °F-tik (3.300 °C-tik) gorako funtzionamendu-tenperatura zuen zeramikazko motor adiabatiko baten ekoizpena ikertu zuela. Zeramikazko motorrek ez dute hozte-sistemarik behar, eta, beraz, pisua nabarmen murriztea, eta, ondorioz, erregaia eraginkorragoa izatea ahalbidetzen dute. Motor metaliko konbentzional batek, erregaiak askatutako energiaren zati handi bat hondar-bero gisa desegin behar du pieza metalikoen fusioa saihesteko. Gas motorreko turbinarako ere zeramikazko piezak garatzen ari dira. Zeramikaz fabrikatutako turbina-motorrek modu eraginkorragoan funtziona dezakete, hegazkinei autonomia eta karga erabilgarri handiagoa emanez erregai kopuru jakin baten truke. Hala ere, motor horiek ez dira fabrikatzen zeramikazko piezak behar besteko zehaztasunez eta iraunkortasunez fabrikatzea zaila eta garestia delako. Prozesatze-metodoek akats mikroskopikoen banaketa zabala eragin ohi dute, eta, sarritan, zeregin kaltegarria izaten dute sinterizazio-prozesuan; ondorioz, pitzadurak ugaritu egiten dira, eta azken akats mekanikoa gertatzen da.
Bitrozeramika
[aldatu | aldatu iturburu kodea]
Bitrozeramikazko materialek propietate asko dituzte, bai beira ez-kristalinoekin, bai material kristalinoekin eta material zeramikoekin. Beira bat bezala eratzen dira, eta, ondoren, partzialki kristalizatzen dira tratamendu termiko baten bidez, fase amorfoak zein kristalinoak sortuz. Horrela, ale kristalinoak ale arteko fase ez-kristalino batean txertatuta daude.
Bitrozeramika sukaldeko tresnak egiteko (jatorrian CorningWare izenez ezagutzen direnak), eta talka termikoarekiko erresistentzia handia eta likidoekiko iragazkortasun oso txikia duten sukaldeko plakak egiteko erabiltzen da. Zeramika kristalinoaren faseko hedapen termiko negatiboaren koefizientea beira fasearen koefiziente positiboarekin oreka daiteke. Puntu jakin batean (~% 70 kristalinoa), bitrozeramikak zero inguruko hedapen termikoko koefiziente garbia du. Bitrozeramika mota horrek propietate mekaniko bikainak ditu, eta tenperatura-aldaketa errepikatuak eta azkarrak jasan ditzake, 1.000 °C-rainokoak.
Bitrozeramika modu naturalean ere gerta daiteke tximista batek Hondartza-harea gehienetan dauden ale kristalinoak jotzen dituenean (kuartzoarenak, adibidez). Kasu horretan, tximistaren muturreko eta berehalako beroak (~2.500 °C) sustrai moduko egitura hutsal eta adarkatuak sortzen ditu fusio bidez eta fulgurita deritzenak.
Solido kristalinoak
[aldatu | aldatu iturburu kodea]Solido kristalinoa gelaxka-unitate deritzon egitura elementaletik eratorritako solidoa da. Solido hauek sistema kristalino ezberdinetatik eratortzen dira eta kristalografia da sistema hauek aztertzen dituen zientziaren arloa. Laburki, solido kristalinoa partikulak ordenatuta dituen solidoa da.
Solido metalikoak
[aldatu | aldatu iturburu kodea]Ezagutzen diren elementu guztietatik, hiru laurden metalak dira. Dena den, nahiz eta elementu batzuen metal-izaera argia izan, beste batzuena ezin da esan guztiz metala direnik. Taula periodikoa hartuta, metalak dira:
- Alkalinoak
- Lurralkalinoak
- Trantsiziozko elementuak
- Lantanidoak eta aktinidoak
- B-Si-As-Te-At elementuetatik diagonal bat eginez gero, eskualdeko elementuak ez-metalak dira eta ezkerraldekoa metalak; diagonaletik gertu dauden substantzia batzuk erdimetalak dira: Si, Ge, As, Sb, Te, Po, At.

- Beste kasu batzuetan- elementuen forma alotropikoaren arabera aldatzen da metal-izaera:

Solido ionikoak
[aldatu | aldatu iturburu kodea]Atomo elektropositibo batek, atomo elektronegatibo batekin elkartzean, balentzia elektroiak ematen dizkio eta konposatu ioniko solido bat lortzen da. Elementu elektropositiboa oxidatzen da katioia sortuz eta elementu elektronegatiboa berriz, erreduzitzen da anioi bihurtuz. Katioia eta anioia erakarpen elektrostatikoaren bidez lotzen dira. Lotura horri lotura ioniko deritzo.
Solido ionikoak elektronegatibotasun oso desberdineko atomoen artean sortzen dira: metal alkalino, lurralkalino edo trantsiziozkoak, halogeno edo oxigeno taldekoekin (besteak beste, haluroak, oxidoak eta sulfuroak). Batzuetan, elementuen elektronegatibotasun-diferentzia ez da oso handia eta lotura ez da izango ioniko purua, izaera kobalente edo metalikoa izango du.
Lotura ionikoak ekarpen elektrostatikoa duenez, sendoa da, eta ez du norabide nagusirik, izaera kobalente oso handia ez bada. Lotura ionikoaren sendotasuna ioien tamaina eta kargarekin aldatzen da. Zenbat eta ioiak txikiagoak izan, elkarrengana gehiago hurbil daitezke eta indar elektrostatikoa sendotu egiten da. Ondorio bera du ioien karga handitzeak.
Solido kobalenteak
[aldatu | aldatu iturburu kodea]Solido kobalenteen partikula osagaiak atomo elektronegatiboak dira, ez-metalak, eta lotura kobalenteen bitartez lotzen dira. Lotura horiek kristal osoan zehar hedatzen dira, ez dago molekula isolaturik, eta kristal osoa molekulatzat har dezakegu. Lotura kobalentea lotura zuzendua da, hau da, atomoen posizioak lotura kobalenteak mugatzen ditu (lotura metalikoak eta ionikoak ez dute norabide nagusirik), eta horri esker solido kobalenteen propietateak oso bereziak dira.
Ez daude solido kobalenteen kasu asko; batez ere, sistema periodikoaren karbono taldeko elementuetan, eta elementu horien konposatu batzuetan aurkitzen dira. Taula honetan solido kobalenteak eratzen dituzten elementuak eta forma alotropikoak daude.

Solido molekularrak
[aldatu | aldatu iturburu kodea]Kristal molekularretan errepikatzen den unitatea kargarik gabeko molekula osoa da (gas nobleen kasuan izan ezik, non atomoak diren). Kristal-egituran molekulak molekulen arteko interakzioen bidez lotzen dira: van der Waalsen indarrak edo hidrogeno-loturak. Oro har, indar horiek ahulagoak dira beste solido motetan aurkitzen ditugunak baino.
Elementuen artean, inguruneko tenperaturan gas diren elementuek solido molekularrak ekoizten dituzte, zeinetan molekula, gas nobleetan izan ezik, X2 formakoa baita. Likido edo solido diren beste elementu batzuk solido molekular moduan lortzen dira: bromo, iodoa, astatoa, fosforo zuria (P4) eta sufrea (S8).
Konposatuei begiratzen badiegu, giro-tenperaturan gasak edo likidoak diren ia konposatu guztiek solido molekularrak sortzen dituzte: CO2, SO2, NH3, HCl, CH4, besteak beste, eta baita konposatu organiko guztiak ere.
Solido organikoak
[aldatu | aldatu iturburu kodea]
Kimika organikoak karbonozko eta hidrogenozko konposatu kimikoen (nitrogenoa, oxigenoa eta halogenoak: fluorra, kloroa, bromoa eta iodoa) egitura, propietateak, konposizioa, erreakzioak eta prestaketa aztertzen ditu sintesi bidez (edo beste bitarteko batzuen bidez). Konposatu organiko batzuek fosforoa edo sufrea ere izan dezakete. Solido organikoen adibide batzuk zura, parafina-argizaria, naftalenoa eta polimero eta plastiko ugari dira.
Zura
[aldatu | aldatu iturburu kodea]Zura material organiko naturala da, batez ere lignina matrize batean txertatutako zelulosazko zuntzez osatua. Propietate mekanikoei dagokienez, zuntzak gogorrak dira tentsioan, eta lignina matrizeak konpresioari eusten dio. Horregatik, zura eraikuntzako material garrantzitsua izan da gizakia babeslekuak eraikitzen eta ontziak erabiltzen hasi zenetik. Eraikuntzarako erabiltzen den zurari, egurra edo eraikuntzarako zura esaten zaio. Eraikuntzan, zura egiturazko materiala izateaz gain, hormigoiaren moldea osatzeko ere erabiltzen da.
Zuretik eratorritako materialak ere asko erabiltzen dira ontzietarako (adibidez, kartoia) eta papererako, pulpa finduarekin sortzen direnak. Ore kimikoa fabrikatzeko prozesuek tenperatura altuko konbinazio bat eta produktu kimiko alkalinoak (kraft) edo azidoak (sulfitoa) erabiltzen dituzte ligninaren lotura kimikoak erre aurretik hausteko.
Polimeroak
[aldatu | aldatu iturburu kodea]
.
Kimika organikoan, karbonoaren propietate garrantzitsu bat da konposatu jakin batzuk osa ditzakeela eta horien molekula indibidualak elkarrekin batzeko gai direla, horrela kate edo sare bat eratuz. Prozesuari polimerizazioa esaten zaio, eta, kateei edo sareei, polimeroak; jatorrizko konposatua, berriz, monomeroa da. Bi polimero multzo nagusi daude: artifizialki fabrikatutakoei polimero industrial edo polimero sintetiko (plastikoak) deitzen zaie, eta jatorri naturalekoei biopolimero.
Monomeroek hainbat ordezkatzaile kimiko edo talde funtzional izan ditzakete, konposatu organikoen propietate kimikoei eragin diezaieketenak, hala nola disolbagarritasunari eta erreaktibotasun kimikoari, baita propietate fisikoei ere, esaterako gogortasunari, dentsitateari, erresistentzia mekanikoari edo trakzioari, urradurarekiko erresistentziari, beroarekiko erresistentziari, gardentasunari, koloreari eta abarri. Proteinetan, desberdintasun horiek polimeroari egitura biologikoki aktibo bat hartzeko gaitasuna ematen diote, beste batzuen aurretik.
Gizakiak mendeak daramatza polimero organiko naturalak erabiltzen argizari eta laka-goma moduan, polimero termoplastiko gisa sailkatzen dena. Zelulosa izeneko landare-polimero batek zuntz eta soka naturalen trakzioarekiko erresistentzia ematen zuen, eta XIX. mendearen hasieran kautxu naturala erabilera orokorrekoa zen. Polimeroak dira plastikoak deritzona fabrikatzeko erabiltzen diren lehengaiak (erretxinak). Plastikoak azken produktua dira, prozesatzean erretxina bati polimero edo gehigarri bat edo gehiago gehitu ondoren sortzen dena eta azken forma ematen zaiona. Gaur egun modu orokorrean erabiltzen diren polimeroak polietilenoa, polipropilenoa, polibinilo kloruroa, poliestirenoa, niloiak, poliesterra, akrilikoak, poliuretanoa eta polikarbonatoa eta silikonazko silikona dira. Plastikoak, oro har, plastiko oinarrizkoetan, berezietan eta ingeniaritzakoetan sailkatzen dira.
Erreferentziak
[aldatu | aldatu iturburu kodea]- ↑ (Gaztelaniaz) Tambutti, Romilio. (2000). Introducción a la física y a la química 1. Editorial Limusa ISBN 978-968-18-5866-7. (Noiz kontsultatua: 2023-03-22).
- ↑ (Gaztelaniaz) Cromer, Alan H.. (1986). Física en la ciencia y en la industria. Reverte ISBN 978-84-291-4156-6. (Noiz kontsultatua: 2023-03-22).
- ↑ (Gaztelaniaz) Agustin, Valera Negrete, Jose Pedro. (2005). Apuntes de Fisica General. UNAM ISBN 978-970-32-2987-1. (Noiz kontsultatua: 2023-03-22).
- ↑ (Gaztelaniaz) Viñas, Wenceslao González; Mancini, Héctor L.. (2003). Ciencia de los materiales. Grupo Planeta (GBS) ISBN 978-84-344-8059-9. (Noiz kontsultatua: 2023-03-22).
- ↑ (Gaztelaniaz) Ebbing, Darrell D.; Gammon, Steven D.. (2010-06-24). Quimica General. Thomson Paraninfo ISBN 978-607-481-306-7. (Noiz kontsultatua: 2023-03-22).
- ↑ (Gaztelaniaz) LLARDENT, Mariano RODRÍGUEZ-AVIAL; GARCÍA, Antonio GONZÁLEZ-ALBERTO. (2012-11-19). Elasticidad y resistencia de materiales I. Editorial UNED ISBN 978-84-362-6518-7. (Noiz kontsultatua: 2023-03-22).
- ↑ (Gaztelaniaz) Luna, Beatriz Moraleda; Vaca, Luis Llanos. (2018). FPB - Ciencias aplicadas I - Ciencias 1 (2018). Editex ISBN 978-84-9161-433-3. (Noiz kontsultatua: 2023-03-22).
- ↑ (Ingelesez) Holley, Dennis. (2017-05-31). GENERAL BIOLOGY I: Molecules, Cells and Genes. Dog Ear Publishing ISBN 978-1-4575-5274-8. (Noiz kontsultatua: 2023-03-22).
- ↑ (Ingelesez) Rogers, Ben; Adams, Jesse; Pennathur, Sumita. (2014-10-28). Nanotechnology: Understanding Small Systems, Third Edition. CRC Press ISBN 978-1-4822-1172-6. (Noiz kontsultatua: 2023-03-22).
- ↑ (Ingelesez) Nahum, Alan M.; Melvin, John W.. (2013-03-09). Accidental Injury: Biomechanics and Prevention. Springer Science & Business Media ISBN 978-1-4757-2264-2. (Noiz kontsultatua: 2023-03-22).
- ↑ (Ingelesez) Narula, G. K.; Narula, K. S.; Gupta, V. K.. (1989). Materials Science. Tata McGraw-Hill ISBN 978-0-07-451796-3. (Noiz kontsultatua: 2023-03-22).
- ↑ «Google Books» books.google.com (Noiz kontsultatua: 2023-03-22).
- ↑ «Editorial Libros.com - Publicamos libros mediante crowdfunding» web.archive.org 2015-11-05 (Noiz kontsultatua: 2023-03-22).
- ↑ Mortimer, Charles E. aut. (1975). Chemistry : a conceptual approach. New York [etc.] : D. Van Nostrand ISBN 978-0-442-25554-1. (Noiz kontsultatua: 2023-03-22).
- ↑ (Ingelesez) Bar-Cohen, Yoseph; Zacny, Kris. (2009-08-04). Drilling in Extreme Environments: Penetration and Sampling on Earth and other Planets. John Wiley & Sons ISBN 978-3-527-62663-2. (Noiz kontsultatua: 2023-03-22(Ingelesez)).
- ↑ html «Cerámicas[Betiko hautsitako esteka]». autocww.colorado.edu. 2017-05-09an begiratua.