Bis(2-méthoxyéthoxy)aluminohydrure de sodium
| Bis(2-méthoxyéthoxy) aluminohydrure de sodium | |||
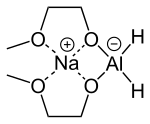
| |||
| Structure du Red-Al | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | bis(2-méthoxyéthoxy) aluminohydrure de sodium | ||
| Synonymes |
Red-Al, Vitride, Synhydrid |
||
| No CAS | |||
| No ECHA | 100.041.056 | ||
| PubChem | 16684438 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | C6H16AlNaO4 [Isomères] |
||
| Masse molaire[1] | 202,160 1 ± 0,007 1 g/mol C 35,65 %, H 7,98 %, Al 13,35 %, Na 11,37 %, O 31,66 %, |
||
| Propriétés physiques | |||
| Masse volumique | 1,036 g·cm-3[2] à 25 °C | ||
| Point d’éclair | 4 °C[2] | ||
| Précautions | |||
| SGH[2] | |||
| H225, H260, H304, H315, H318, H336, H361d, H373, P210, P223, P261, P231+P232, P370+P378 et P422 |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Le bis(2-méthoxyéthoxy)aluminohydrure de sodium, commercialisé sous les appellations Red-Al, Vitride et Synhydrid, est un complexe d'hydrure de formule chimique NaAlH2(OCH2CH2OCH3)2. Le nom Red-Al renvoie au fait qu'il s'agit d'un réducteur à base d'aluminium. Il est utilisé essentiellement comme réducteur en synthèse organique. Il présente un atome d'aluminium lié à deux ligands hydrure et deux alcoolates de 2-méthoxyéthanol CH3OCH2CH2OH. Les solutions commerciales sont visqueuses et incolores ou légèrement tintées de jaune pâle. Elles se solidifient à basse température (< −60 °C) en formant une substance vitreuse pulvérisable qui ne présente pas de température de fusion nette.

Le Red-Al est un réducteur polyvalent. Il convertit facilement les aldéhydes, les cétones, les acides carboxyliques, les esters, les halogénures d'acyle et les anhydrides en alcools primaires. Les composés cycliques comme les lactones et les époxydes sont réduits en diols. Les dérivés azotés comme les amides, les nitriles, les imines et la plupart des molécules azotées sont réduites en amines correspondantes. Les nitroarènes peuvent être convertis en azoxyarènes, azoarènes ou hydroazoarènes selon les conditions de réaction[3]. La planche ci-dessous résume les principales réactions de réduction réalisées avec le Red-Al :

Comparaison avec l'aluminohydrure de lithium
[modifier | modifier le code]Le Red-Al est un réducteur comparable a l'aluminohydrure de lithium LiAlH4, auquel il est une alternative plus pratique. En particulier, il ne présente pas le caractère pyrophorique, instable et faiblement soluble du LiAlH4. Bien qu'il soit très réactif et de manipulation dangereuse, le Red-Al ne prend pas feu au contact de l'air et de l'humidité — mais la réaction reste exothermique — et peut tolérer des températures atteignant 200 °C. Il peut rester stable indéfiniment tant qu'il est protégé de toute trace d'humidité. Il est soluble dans les solvants aromatiques alors que le LiAlH4 n'est soluble que dans les éthers. On peut ainsi trouver dans le commerce des solutions de Red-Al dans le toluène à des concentrations pondérales excédant 60 %. Le réactif peut être modifié pour réaliser des réductions partielles[3].
Le Red-Al dissous dans le toluène est l'un des rares réducteurs capables de convertir les p-toluènesulfonates TsNR2 en amines dans les conditions normales ; le LiAlH4 ne peut réaliser cette réaction que dans des conditions particulières[4].
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Red-Al® sodium bis(2-methoxyethoxy)aluminum hydride solution ≥60 wt. % in toluene, consultée le 30 juillet 2017.
- (en) Melinda Gugelchuk, Luiz F. Silva III, Ramon S. Vasconcelos et Samir A. P. Quintiliano, « Sodium Bis(2-methoxyethoxy)aluminum Hydride », e-EROS Encyclopedia of Reagents for Organic Synthesis, (DOI 10.1002/9780470842898.rs049.pub2)
- (en) Michael B. Smith, Organic Synthesis, Academic Press, 2011, Cambridge, Mass., États-Unis, p. 368, (ISBN 978-0-1241-5884-9).






