Hexafluorure de sélénium
| Hexafluorure de sélénium | |
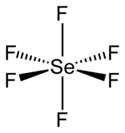
| |
| Structure de l'hexafluorure de sélénium | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.149.506 |
| No CE | 620-577-8 |
| Apparence | gaz incolore à l'odeur âcre[1] |
| Propriétés physiques | |
| T° fusion | −46,6 °C[1] (sublimation) |
| T° ébullition | −34,7 °C[1] (sous pression) |
| Masse volumique | 8,687 kg·m-3[1] |
| Point critique | 72,4 °C[1] |
| Point triple | −34,7 °C[1] |
| Précautions | |
| SGH[1] | |
| H280, H314, H330 et EUH071 |
|
| Transport[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'hexafluorure de sélénium est un composé chimique de formule SeF6. C'est un gaz incolore à l'odeur généralement décrite comme « repoussante ». Il s'agit d'une molécule hypervalente à géométrie octaédrique qui n'a pas d'application commerciale[2]. Les liaisons Se–F ont une longueur de 168,8 pm.
On peut obtenir du SeF6 à partir de sélénium et de fluor F2 ou en faisant réagir du dioxyde de sélénium SeO2 avec du trifluorure de brome BrF3. Le produit obtenu est ensuite purifié par sublimation.
La réactivité de l'hexafluorure de sélénium est intermédiaire entre celle de l'hexafluorure de tellure TeF6 et celle de l'hexafluorure de soufre SF6, ce dernier étant chimiquement inerte par rapport à l'hydrolyse jusqu'à haute température. Le SeF6 est également résistant à l'hydrolyse. Il peut traverser de l'hydroxyde de sodium NaOH ou de l'hydroxyde de potassium KOH à 10 % sans réagir, mais réagit avec l'ammoniac NH3 gazeux à 200 °C[3].
Notes et références
[modifier | modifier le code]- Entrée « Selenium hexafluoride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 29 juin 2018 (JavaScript nécessaire)
- (en) Bernd E. Langner, « Selenium and Selenium Compounds », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a23_525, lire en ligne)
- (en) B. Krebs, S. Bonmann et I. Eidenschink, « Selenium-Inorganic Chemistry », R. B. King, Encyclopedia of Inorganic Chemistry, John Wiley & Sons, 1994. (ISBN 0-471-93620-0)





