N6-Méthyladénosine
| N6-Méthyladénosine | |
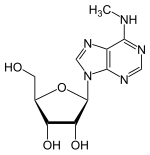
| |
| Identification | |
|---|---|
| Nom UICPA | N-Méthyladénosine |
| Synonymes |
m6A |
| No CAS | |
| PubChem | |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C11H15N5O4 [Isomères] |
| Masse molaire[1] | 281,267 9 ± 0,012 1 g/mol C 46,97 %, H 5,38 %, N 24,9 %, O 22,75 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
La N6-méthyladénosine (m6A) est un nucléoside dérivé de l'adénosine que l'on retrouve abondamment dans l'ARN messager de certains virus[2],[3] et chez la plupart des eucaryotes, y compris des mammifères[4],[5],[6],[7], des insectes[8], des plantes[9],[10],[11] et des levures[12],[13]. Elle est également présente dans des ARN de transfert, ARN ribosomiques, et dans des petites ribonucléoprotéines nucléaires ainsi que dans divers ARN non codants de grande taille, comme le Xist[14],[15].
La méthylation de l'adénosine est catalysée par un grand complexe d'enzymes contenant la m6A méthyltransférase, la METTL3 comme la sous-unité catalytique du complexe MAC, liée au SAM[16]. In vitro, ce complexe méthyltransférase méthyle préférentiellement les séquences de GGACU[17] sur les ARN oligonucléotidiques. Cette même préférence de méthylation spécifique a été observée in vivo dans l'ARN du virus du sarcome de Rous[18] et dans l'ARN codant la prolactine chez les bovins[19].
Le complexe methyltransférase (MAC) possédant l’activité catalytique, est soutenu et régulé principalement par un second complexe MACOM (M6A-METTL3-associated complex).
Répartition chez les différentes espèces
[modifier | modifier le code]Levures
[modifier | modifier le code]Chez les levures bourgeonantes comme Saccharomyces cerevisiae, l'homologue de la METTL3, l'IME4, est produit dans les cellules diploïdes lorsque la levure n'a plus assez de nutriments, comme l'azote et des sources de carbone fermentable. Il est aussi requis dans la méthylation d'ARNm, dans l'initiation de méioses correctes et dans la sporulation de ces levures[12],[13].
Les ARNm de IME1 et IME2, gènes codant des protéines inductrices de la méiose, s'avèrent être des cibles de la méthylation, comme le transcrit de l'IME4[13].
Plantes
[modifier | modifier le code]Chez les plantes, la majorité des m6A est contenue dans les 150 nucléotides précédant le début de la queue poly (A)[20].
Chez l'Arabidopsis thaliana, un autre analogue de METTL3 appelé MTA, peut subir des mutations provoquant un arrêt de la phase globulaire chez l'embryon. Une réduction supérieure à 90 % du taux de m6A chez les plantes matures conduit à des schémas de croissance considérablement altérés et à des anormalités homéotiques des fleurs[20].
Mammifères
[modifier | modifier le code]La localisation de la base nucléique m6A dans l'ARN de l'homme et de la souris a été identifiée sur au moins 18000 sites dans les transcrits de plus de 7000 gènes humains avec une séquence consensus de [G/A/U][G>A]m6AC[U>A/C][14],[15] en accord avec la séquence précédemment identifiée.
La localisation des sites individuels de m6A dans beaucoup d'ARNm est très semblable entre humain et souris[14],[15]. L'analyse du large transcriptome résultant de la grande variété des ARNm révèle que l'on trouve des m6A dans des régions de haute conservation. On trouve des m6A dans de longs exons, elles sont préférentiellement en grand nombre dans la région 3'-UTR et au niveau des codons-stop. Aussi les m6A dans la région [3'-UTR] sont associées à la présence de sites de liaison aux microARN, c'est le cas d'environ 2/3 des ARNm[14]. Le m6A est sensible à la régulation dynamique, autant au long du développement qu'en réponse à des stimuli cellulaires. L'analyse deS m6A dans un ARN de Cerveau souris révèle que les taux de m6A sont bas durant le développement embryonnaire et augmente significativement à l'âge adulte[14]. De plus, l'initiation de la m6A méthyltransférase, la METTL3 affecte significativement l'expression des gènes et altère les motifs d'épissage de l'ARN, en résulte la modulation de la voie de signalisation de la protéine p53 (aussi appelé TP53), oncogène une fois inactive, et de l'apoptose[15]. L'importance de la méthylation du m6A pour les procédés physiologiques a été récemment démontrée. L'inhibition de la méthylation du m6A par une inhibition pharmacologique des méthylations dans la cellule ou plus spécifiquement par des pARNi, petits ARN interférents, inhibant la m6A méthylase ("METTL3") ce qui amène à une prolongation de l'horloge circadienne. En revanche, la surexposition de la "METTL3" conduit à une diminution de cette période. L'horloge circadienne des mammifères, composé d'une boucle de rétroaction de transcription étroitement régulée qui oscille sur une période 24h est en conséquence très sensible aux processus d'épissage de l'ARN dépendant des m6A, cela est probablement dû à la présence de sites m6A dans les transcrits de gènes de "l'horloge biologique"[21],[22].
Importance clinique
[modifier | modifier le code]Le gène FTO, gène augmentant les risques d'être touché par l'obésité code la première m6A déméthylase identifiée[14],[23]. Les mutations de ce gène ont été associés à l'augmentation des risques d'obésité et des 2 types de diabète, ce qui implique la m6A dans d'importants mécanismes physiologiques relatif aux maladies humaines. L'ARN FTO une fois détruit par un petit ARN interférent, un pARNi, provoque une augmentation des taux de m6A dans la queue poly(A) des ARN de la cellule[15], alors que la surexpression du gène FTO cause une diminution du nombre de m6A dans les cellules humaines[14]. L'enzyme codée par le gène FTO est localisée au niveau des splicéosomes[23], ce qui conforte l'hypothèse que la m6A des ARN nucléaires est le substrat physiologique majoritaire de l'enzyme. Les conséquences du ciblages de la déméthylation de l'ARN FTO sont inconnus à ce jour, mais il est probable que cela affecte le processus d'ARN pré-messager, d'autres ARN nucléaires ou les deux. La découverte des fonctions du gène FTO comme celle du codage de la m6A déméthylase suppose que l'augmentation de l'activité de ce gène chez des patients atteints de mutations du FTO conduit à un taux anormalement bas de m6A dans les ARNm ciblés. Les incertitudes sur les cibles exactes contribue à un au début de compréhension de l'obésité des maladies relatives.
Références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Beemon K, Keith J, « Localization of N6-methyladenosine in the Rous sarcoma virus genome », J. Mol. Biol., vol. 113, no 1, , p. 165–79 (PMID 196091, DOI 10.1016/0022-2836(77)90047-X)
- Aloni Y, Dhar R, Khoury G, « Methylation of nuclear simian ! virus 40 RNAs », J. Virol., vol. 32, no 1, , p. 52–60 (PMID 232187, PMCID 353526)
- Desrosiers R, Friderici K, Rottman F, « Identification of methylated nucleosides in messenger RNA from Novikoff hepatoma cells », Proc. Natl. Acad. Sci. U.S.A., vol. 71, no 10, , p. 3971–5 (PMID 4372599, PMCID 434308, DOI 10.1073/pnas.71.10.3971)
- Adams JM, Cory S, « Modified nucleosides and bizarre 5'-termini in mouse myeloma mRNA », Nature, vol. 255, no 5503, , p. 28–33 (PMID 1128665, DOI 10.1038/255028a0)
- Wei CM, Gershowitz A, Moss B, « 5'-Terminal and internal m! ethylated nucleotide sequences in HeLa cell mRNA », Biochemistry, vol. 15, no 2, , p. 397–401 (PMID 174715, DOI 10.1021/bi00647a024)
- Perry RP, Kelley DE, Friderici K, Rottman F, « The methylated constituents of L cell messenger RNA: evidence for an unusual cluster at the 5' terminus », Cell, vol. 4, no 4, , p. 387–94 (PMID 1168101, DOI 10.1016/0092-8674(75)90159-2)
- Levis R, Penman S, « 5'-terminal structures of poly(A)+ cytoplasmic messenger RNA and of poly(A)+ and poly(A) - heterogeneous nuclear RNA of cells of the dipteran Drosophila melanogaster », J. Mol. Biol., vol. 120, no 4, , p. 487–515 (PMID 418182, DOI 10.1016/0022-28! 36(78)90350-9)
- Nichols JL, « In maize poly(A)-containing RNA », Plant Science Letters, vol. 15, no 4, , p. 357 (DOI 10.1016/0304-4211(79)90141-X)
- Kennedy TD, Lane BG, « Wheat embryo ribonucleates. XIII. Methyl-substituted nucleoside constituents and 5'-terminal dinucleotide sequences in bulk poly(AR)-rich RNA from imbibing wheat embryos », Can. J. Biochem., vol. 57, no 6, , p. 927–31 (PMID 476526, DOI 10.1139/o79-112)
- Zhong S, Li H, Bodi Z, Button J, Vespa L, Herzog M, Fray RG, « MTA is an Arabidopsis messenger RNA adenosine methylase and interacts with a homolog of a sex-specific splicing factor », Plant Cell, vol. 20, no 5, , p. 1278–88 (PMID 18505803, PMCID 2438467, DOI 10.1105/tpc.108.058883)
- Clancy MJ, Shambaugh ME, Timpte CS, Bokar JA, « Induction of sporulation in Saccharomyces cerevisiae leads to the formation of N6-methyladenosine in mRNA: a potential mechanism for the activity of the IME4 gene », Nucleic Acids Res., vol. 30, no 20, , p. 4509–18 (PMID 12384598, PMCID 137137, DOI 10.1093/nar/gkf573)
- Bodi Z, Button JD, Grierson D, Fray RG, « Yeast targets for mRNA methylation », Nucleic Acids Res., vol. 38, no 16, , p. 5327–35 (PMID 20421205, PMCID 2938207, DOI 10.1093/nar/gkq266)
- Meyer KD, Saletore Y, Zumbo P, Elemento O, Mason CE, Jaffrey SR, « Comprehensive Analysis of mRNA Methylation Reveals Enrichment in 3' UTRs and near Stop Codons », Cell, vol. 149, no 7, , p. 1635–46 (PMID 22608085, PMCID 3383396, DOI 10.1016/j.cell.2012.05.003)
- Dominissini D, Moshitch-Moshkovitz S, Schwartz S, Salmon-Divon M, Ungar L, Osenberg S, Cesarkas K, Jacob-Hirsch J, Amariglio N, Kupiec M, Sorek R, Rechavi G, « Topology of the human and mouse m6A RNA methylomes revealed by m6A-seq », Nature, vol. 485, no 7397, , p. 201–6 (PMID 22575960, DOI 10.1038/nature11112)
- Bokar JA, Shambaugh ME, Polayes D, Matera AG, Rottman FM, « Purification and cDNA cloning of the AdoMet-binding subunit of the human mRNA (N6-adenosine)-methyltransferase », RNA, vol. 3, no 11, , p. 1233–47 (PMID 9409616, PMCID 1369564)
- Harper JE, Miceli SM, Roberts RJ, Manley JL, « Sequence specificity of the human mRNA N6-adenosine methylase in vitro », Nucleic Acids Res., vol. 18, no 19, , p. 5735–41 (PMID 2216767, PMCID 332308, DOI 10.1093/nar/18.19.5735)
- Kane SE, Beemon K, « Precise localization of m6A in Rous sarcoma virus RNA reveals clustering of methylation sites: implications for RNA processing », Mol. Cell. Biol., vol. 5, no 9, , p. 2298–306 (PMID 3016525, PMCID 366956)
- Horowitz S, Horowitz A, Nilsen TW, Munns TW, Rottman FM, « Mapping of N6-methyladenosine residues in bovine prolactin mRNA », Proc. Natl. Acad. Sci. U.S.A., vol. 81, no 18, , p. 5667–71 (PMID 6592581, PMCID 391771, DOI 10.1073/pnas.81.18.5667)
- Bodi Z, Zhong S, Mehra S, Song J, Graham N, Li H, May S, Fray RG, « Adenosine Methylation in Arabidopsis mRNA is Associated with the 3' End and Reduced Levels Cause Developmental Defects », Front Plant Sci, vol. 3, , p. 48 (PMID 22639649, PMCID 3355605, DOI 10.3389/fpls.2012.00048)
- Fustin JM, Doi M, Yamaguchi Y, Hayashi H, Nishimur! a S, Yoshida M, Isagawa T, Morioka MS, Kakeya H, Manabe I, Okamura H, « RNA-Methylation-Dependent RNA Processing Controls the Speed of the Circadian Clock », Cell, vol. 155, no 4, , p. 793–806 (PMID 24209618, DOI 10.1016/j.cell.2013.10.026)
- Hastings MH, « m(6)A mRNA methylation: a new circadian pacesetter », Cell, vol. 155, no 4, , p. 740-1 (PMID 24209613, DOI 10.1016/j.cell.2013.10.028)
- Jia G, Fu Y, Zhao X, Dai Q, Zheng G, Yang Y!, Yi C, Lindahl T, Pan T, Yang YG, He C, « N6-methyladenosine in nuclear RNA is a major substrate of the obesity-associated FTO », Nat. Chem. Biol., vol. 7, no 12, , p. 885–7 (PMID 22002720, PMCID 3218240, DOI 10.1038/nchembio.687)
