Orbitale antiliante
Apparence
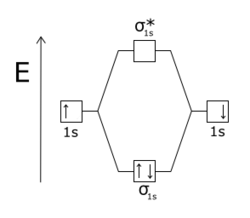
Une orbitale antiliante désigne un type de liaison chimique qui s'oppose à la stabilité de la molécule. Cela survient lorsque les phases d'électron et des orbitales atomiques à l'origine d'une orbitale moléculaire sont de signe opposé, c'est-à-dire que ces orbitales atomiques sont en opposition de phase : si des électrons occupent de telles orbitales antiliantes, ils se repoussent et tendent à dissocier la molécule.
L'effet d'une orbitale antiliante est plus sensible que celui d'une orbitale liante, la différence s'expliquant par la répulsion entre les noyaux atomiques.
 |
 |
Bibliographie
[modifier | modifier le code]- (en) Peter William Atkins, Julio de Paula et James Keeler, Atkins' Physical Chemistry, 2022, 12e éd., Oxford University Press (ISBN 9780198847816).
- (en) Milton Orchin et H.H. Jaffé, The Importance of Antibonding Orbitals, 1967, Houghton Mifflin (ASIN B0006BPT5O).
Articles connexes
[modifier | modifier le code]Liens externes
[modifier | modifier le code]- (en) Le prix Nobel de chimie de 1981, sur nobelprize.org
