Triaenops menamena
« Triaenops rufus » (jusqu'en 2009)
| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Classe | Mammalia |
| Ordre | Chiroptera |
| Sous-ordre | Yinpterochiroptera |
| Famille | Hipposideridae |
| Genre | Triaenops |
Triaenops menamena, improprement appelée « Triaenops rufus » jusqu'en 2009, est une espèce de chauves-souris de la famille des Hipposideridae, endémique de Madagascar. C'est un chiroptère de taille moyenne, l'avant-bras mesurant entre 50 et 56 mm chez le mâle et 46 à 53 mm chez la femelle. La couleur de la fourrure est variable, allant du brun-roux au gris ; le pelage est dans l'ensemble plus sombre que les autres espèces du genre Paratriaenops qui se rencontrent également à Madagascar. Comme les autres membres de sa famille, T. menamena possède une feuille nasale développée, avec une structure en trident au-dessus des narines. Le crâne possède un renflement nasal marqué et la seconde prémolaire est décalée en dehors de la rangée de dents. La fréquence maximale d'écholocation est en moyenne de 94,2 kHz et l'espèce peut aisément être reconnue par son cri.
Elle est appelée « Triaenops rufus » jusqu'en 2009, lorsque Steven M. Goodman et Julie Ranivo (d) s'aperçoivent que le matériel génétique associé à ce nom concerne Triaenops persicus, une espèce du même genre originaire du Moyen-Orient.
Triaenops menamena vit principalement dans les régions sèches de Madagascar. On la trouve essentiellement en forêt, mais elle peuple également d'autres habitats. Elle forme souvent de grandes colonies de repos et se nourrit d'insectes et notamment de lépidoptères. En raison de sa grande aire de répartition, de son abondance et de sa tolérance à la dégradation de son habitat, cette espèce n'est pas considérée comme en danger et elle est aujourd'hui classée comme de « préoccupation mineure » sur la liste rouge de l'Union internationale pour la conservation de la nature.
Description
[modifier | modifier le code]Biométrie
[modifier | modifier le code]| Sexe | Longueur totale | Queue | Pied postérieur | Oreille | Avant-bras | Poids |
|---|---|---|---|---|---|---|
| Mâle | 90-104 mm | 27-38 mm | 6-9 mm | 14-17 mm | 50-56 mm | 8,2-15,5 g |
| Femelle | 86-98 mm | 28-39 mm | 6-9 mm | 12-17 mm | 46-53 mm | 6,6-11,5 g |
| Les valeurs sont sous la forme « minimum-maximum ». 28 mâles (27 pour la longueur totale) et 67 femelles ont été mesurés. | ||||||
Triaenops menamena est une chauve-souris de taille moyenne à la coloration variable allant du brun-roux au gris. Elle est plus grande et plus sombre que Paratriaenops auritus et P. furculus, deux espèces relativement proches présentes à Madagascar[2]. Par rapport aux autres espèces actuelles du genre Triaenops, elle est plus petite que T. persicus et T. afer, mais un peu plus grande que T. parvus[3]. L'espèce éteinte Triaenops goodmani, connue seulement par trois mandibules, est également plus grande[4].
Face et corps
[modifier | modifier le code]La feuille nasale de T. menamena a des replis complexes, et comporte une structure en trident au-dessus des narines caractéristique des genres Triaenops et Paratriaenops, constituée de trois lancettes adjacentes sur la feuille postérieure[5]. Chez T. menamena, les deux lancettes externes sont courbes et plus courtes que celle du milieu[Note 1],[6]. La feuille antérieure comporte un processus large et plat et la feuille intermédiaire un processus pointu[7]. Les oreilles sont courtes et larges[5] et ont une encoche sur la marge interne[2]. Le pelage est soyeux et les poils du corps sont longs de 5 à 6 mm. La membrane de l'aile est sombre et translucide, et le bout de la queue dépasse généralement de l'uropatagium[7]. Les mâles sont en moyenne légèrement plus gros que les femelles[1]. L'envergure est de 270 à 305 mm[8].
Crâne
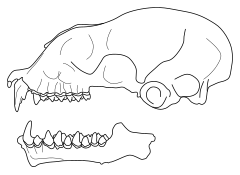
[modifier | modifier le code]Le crâne ressemble aux Paratriaenops malgaches, mais le prémaxillaire est plus allongé. Le rostre est robuste et comporte un gonflement nasal largement développé, mais beaucoup moins que chez Paratriaenops où ces renflements sont très bulbeux ; la dépression derrière ce renflement est relativement peu profonde[9]. Comparativement aux autres espèces du genre Triaenops, l'os du museau est étroit et court, semblable à celui de T. parvus[Note 2],[3]. Les arcs zygomatiques présentent d'épais bras antérieurs et possèdent une excroissance dorsale bien développée et plutôt rectangulaire, quand elle est assez réduite et triangulaire chez Paratriaenops[10]. Le neurocrâne est plus petit que chez les autres Triaenops[11]. La crête sagittale de T. menamena est peu développée et n'atteint pas la région interorbitale, quand elle est beaucoup plus développée chez les Paratriaenops malgaches[10]. Sur la mandibule, l'apophyse du coronoïde est épointée et arrondie et l'apophyse angulaire est réduite[12].
Sur la mandibule supérieure, les incisives sont bicuspides et inclinées vers l'intérieur ; les canines sont longues et tricuspides, avec la cuspide postérieure bien développée et pointue et les deux cuspides antérieures réduites[12]. La première prémolaire est en dehors de la rangée de dents, de sorte que la canine la précédant et la deuxième prémolaire la suivant se touchent[2]. Sur la mandibule inférieure, la première incisive a deux cuspides et la seconde en a trois[12]. Sur la seconde molaire, la cuspide protoconide est nettement plus grande que l'hypoconide, alors qu'elles sont de même taille chez T. goodmani[4].
Écologie et comportement
[modifier | modifier le code]Écholocalisation
[modifier | modifier le code]| Sexe | Signaux à fréquence constante (kHz) | Fréquence maximum (kHz) | Fréquence minimum (kHz) | Durée (ms) | Intervalle entre signaux (ms) |
|---|---|---|---|---|---|
| Mâle | 82,3 ± 1,43 79,6-84,0 |
83,6 ± 1,26 81,4-85,2 |
79,5 ± 3,21 72,2-82,3 |
7,5 ± 0,97 5,5-9,4 |
38,3 ± 30,15 9,8-107,4 |
| Femelle | 93,5 ± 1,47 90,0-96,8 |
94,7 ± 1,49 91,8-98,3 |
91,3 ± 2,00 87,6-95,4 |
7,8 ± 1,54 5,1-10,6 |
35,6 ± 24,75 14,9-127,4 |
| Les valeurs sont sous la forme « moyenne ± écart type ; minimum-maximum ». 11 mâles et 20 femelles ont été mesurés. | |||||
L'espèce peut facilement être reconnue par ses cris d'écholocalisation[14]. Le cri est constitué d'un élément à fréquence constante suivi d'un court à fréquence changeante. Selon les études acoustiques de Kofoky et al. publiées en 2009, le cri dure de 6,5 à 13,5 ms (10,1 ms en moyenne), et la période séparant deux cris est de 22,7 à 86,3 ms (42,7 ms en moyenne). Le maximum de fréquence est en moyenne de 94,2 kHz, le minimum de 82,0 kHz, et le maximum d'énergie du cri se situe vers 93,2 kHz[15]. En 2013, Ramasindrazana et al. publient de nouvelles données en distinguant le sexe des individus, montrant notamment que la femelle a une fréquence moyenne de cri plus élevée que le mâle, ce qui pouvait être attendu en raison de sa taille plus petite[13].
Régime alimentaire et parasitologie
[modifier | modifier le code]Les lépidoptères constituent la plus grande partie de l'alimentation de T. menamena, mais la chauve-souris consomme également des coléoptères, des hémiptères et quelques représentants d'autres ordres d'insectes volants[16]. Selon une étude menée dans le parc national de Tsimanampetsotsa, la chauve-souris a une alimentation variant dans l'année en fonction des arthropodes les plus abondants. Les coléoptères se trouvent en plus grande quantité durant la saison sèche, et représentent 69 % du volume consommé par T. menamena ; pendant la saison humide, les lépidoptères sont les insectes les plus abondants et représentent alors 90,5 % de l'alimentation du mammifère[17]. On ne sait pas en quelle mesure diffèrent les niches écologiques de Triaenops et de Paratriaenops furculus, moins fréquent, puisque les deux exploitent la même source de nourriture et occupent les mêmes régions[18].
Comme beaucoup de chiroptères, T. menamena peut être l'hôte de bactéries du genre Leptospira avec 8 individus sur 10 infectés selon une étude de 2012[19]. En 2014, une étude montre également que l'espèce semble être un hôte important pour les paramyxovirus, avec 63 % des individus testés positifs pour le virus[20].
Répartition et habitat
[modifier | modifier le code]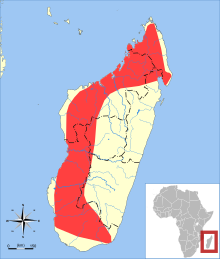
Triaenops menamena vit principalement dans les régions sèches de Madagascar, mais a également été trouvée dans des zones humides dans l'extrême sud-est et nord-est de l'île[21] et jusqu'à 1 300 m d'altitude[22]. Cette chauve-souris vit principalement en forêt[23] mais a également été observée en dehors du milieu forestier et n'en est pas dépendante[22]. Elle est en revanche toujours associée aux grottes[24] où elle forme souvent de grandes colonies : dans une grotte, on a estimé les effectifs de T. menamena à plus de 40 000 individus, en plus de 10 000 Paratriaenops furculus[25],[26]. La population est estimée à 121 000 individus[27].
Taxinomie
[modifier | modifier le code]Description et renommage
[modifier | modifier le code]En 1881, Alphonse Milne-Edwards décrit deux nouvelles espèces dans le genre Triaenops sur la base de spécimens collectés par Léon Humblot et censés provenir de Madagascar : Triaenops rufus de couleur rougeâtre et T. humbloti, gris et plus grand[28]. Jean Dorst, qui révise les Triaenops de Madagascar en 1947, retient les deux taxons comme espèces distinctes. Dans une autre révision, publiée en 1982, John Edwards Hill considère que les deux représentent la même espèce. En 1994, Karl Koopman considère que T. rufus est à rattacher à une espèce du Moyen-Orient, Triaenops persicus, une possibilité qu'avait également évoqué Hill[29],[30] mais la plupart des auteurs traitent les deux comme des espèces distinctes[31]. En 2006, Julie Ranivo et Steven M. Goodman révisent les Triaenops malgaches et trouvent peu de variations parmi les spécimens de ce qui est alors appelé T. rufus et provenant des différentes zones sèches de l'île[32].
Trois ans plus tard, ils publient un autre document qui montre que le matériel type de T. rufus et T. humbloti est différent des spécimens malgaches identifiés comme T. rufus mais se rapproche plutôt de T. persicus[33]. Lors de son voyage vers Madagascar, Humblot a séjourné en Somalie et au Yémen, et Goodman et Ranivo concluent donc qu'il y a probablement collecté les Triaenops, et que la provenance des holotypes a été mal enregistrée[34]. Ainsi ni rufus ni humbloti ne peuvent servir à désigner l'espèce malgache, et Goodman et Ranivo proposent un nouveau nom, Triaenops menamena, pour désigner ce qui était appelé T. rufus. L'épithète spécifique menamena est le mot malgache pour « roussâtre », et fait référence à la coloration de l'animal[21]. L'espèce n'a pas de nom vulgaire, mais plusieurs noms ont été proposés pour la désigner, comme le « Triaenops de Humblot » pour T. humbloti et « Triaenops roux » pour T. rufus[35].
Genre Triaenops
[modifier | modifier le code]
- Triaenops persicus
- Triaenops persicus et Triaenops parvus
- Triaenops afer
- Triaenops menamena
- Triaenops goodmani
Triaenops menamena est l'une des quatre espèces actuelles du genre Triaenops, depuis une révision du genre en 2009 par Petr Benda et Peter Vallo. Ils séparent l'espèce africaine T. afer et celle du Yémen T. parvus de T. persicus et excluent de ce genre trois autres espèces, dont deux de Madagascar, pour les placer parmi les Paratriaenops[36]. Une espèce éteinte, Triaenops goodmani, est également découverte dans le Nord-Ouest de l'île[4]. En 2007 et 2008, Amy Russell et al. mènent des études de phylogénie et de coalescence pour démêler l'histoire évolutive du groupe Triaenops. T. menamena (alors toujours nommée T. rufus) s'avère proche des Triaenops d'Afrique continentale, mais les chauves-souris du Moyen-Orient ne sont pas étudiées. Les chercheurs concluent que T. menamena et les espèces du genre Paratriaenops (alors toujours placées dans Triaenops) ont atteint Madagascar depuis l'Afrique de manière indépendante ; la colonisation de l'île par T. menamena date d'environ 660 000 ans[37]. Benda et Vallo étudient également les relations phylogénétiques dans le genre Triaenops en incluant les espèces du Moyen-Orient T. persicus et T. parvus dans leurs analyses. Les relations sont peu résolues au sein de Triaenops, mais il semble que T. menamena soit plus proche des espèces du Moyen-Orient que de T. afer d'Afrique continentale ; cela impliquerait que T. menamena ait atteint Madagascar depuis le Moyen-Orient ou le Nord-Est de l'Afrique. Benda et Vallo placent également la divergence de T. menamena comme plus ancienne, autour de 4 millions d'années[38].
Menaces et protection
[modifier | modifier le code]Sous le nom de Triaenops rufus, l'espèce est considérée comme de « préoccupation mineure » par l'Union internationale pour la conservation de la nature, en raison de son abondance sur sa vaste aire de répartition et de sa tolérance face aux modifications de son habitat par l'action de l'homme et notamment la destruction des forêts[22]. Par ailleurs, T. menamena est présente dans de nombreuses aires protégées, notamment les réserves spéciales d’Ankarana, d’Analamerana et d’Ambohitantely, et dans les parcs nationaux du Tsingy de Bemaraha, de Namoroka, de Tsimanampetsotsa, d’Ankarafantsika, de l’Isalo et de Masoala ainsi que dans la réserve naturelle intégrale de Tsaratanana[22].
Dans le Sud-Ouest de Madagascar, les chauves-souris sont parfois chassées pour leur chair. C'est principalement la grande Phyllorhine de Commerson (Hipposideros commersoni) qui est concernée, mais T. menamena peut être consommée occasionnellement[39].
Annexes
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]- Randolph L. Peterson, Judith L. Eger et Lorelie Mitchell, « Chiroptères », Faune de Madagascar, vol. 84, , p. 1-204
- (en) M. Yoshiyuki, « Two rare species of the bats, Triaenops rufus and Mormopterus jugularis (Mammalia, Chiroptera) from Madagascar », Bulletin of the National Science Museum Series A (Zoology), Tokyo, vol. 21, no 2, , p. 119-126
- Julie Ranivo et Steven M. Goodman, « Révision taxinomique des Triaenops malgaches (Mammalia, Chiroptera, Hipposideridae) », Zoosystema, vol. 28, no 4, , p. 963-985 (lire en ligne [PDF])
- (en) A.F. Kofoky, D. Andriafidison, F.H. Ratrimomanarivo, H.J. Razafimanahaka, D. Rakotondravony, P.A. Racey et R.K.B. Jenkins, « Habitat use, roost selection and conservation of bats in Tsingy de Bemaraha National Park, Madagascar », Biodiversity and Conservation, vol. 16, , p. 1039-1053 (ISBN 978-1-4020-6319-0, DOI 10.1007/978-1-4020-6320-6_14, lire en ligne [PDF])
- (en) A.A. Rakotoarivelo, N. Ranaivoson, O.R. Ramilijaona, A.F. Kofoky, P.A. Racey et R.K.B. Jenkins, « Seasonal food habits of five sympatric forest microchiropterans in western Madagascar », Journal of Mammalogy, vol. 88, no 4, , p. 959-966 (DOI 10.1644/06-MAMM-A-112R1.1)
- (en) A.F. Kofoky, F. Randrianandrianina, J. Russ, I. Raharinantenaina, S.G. Cardiff, R.K.B. Jenkins et P.A. Racey, « Forest bats of Madagascar: results of acoustic surveys (subscription required) », Acta Chiropterologica, vol. 11, no 2, , p. 375-392 (DOI 10.3161/150811009X485602).
- (en) Steven M. Goodman et Julie Ranivo, « The geographical origin of the type specimens of Triaenops rufus and T. humbloti (Chiroptera: Hipposideridae) reputed to be from Madagascar and the description of a replacement species name », Mammalia, vol. 73, , p. 47-55 (DOI 10.1515/MAMM.2009.011)
- (en) Petr Benda et Peter Vallo, « Taxonomic revision of the genus Triaenops (Chiroptera: Hipposideridae) with description of a new species from southern Arabia and definitions of a new genus and tribe », Folia Zoologica, vol. 58, , p. 1-45 (lire en ligne)
- (en) Beza Ramasindrazana, Steven M. Goodman, C. Fabienne Rakotondramanana et M. Corrie Schoeman, « Morphological and Echolocation Call Variation in Malagasy Trident Bats, Triaenops Dobson, 1871 (Chiroptera: Hipposideridae) », Acta Chiropterologica, vol. 15, no 2, , p. 431-439
Liens externes
[modifier | modifier le code]- (en) Référence Animal Diversity Web : Triaenops rufus (consulté le )
- (en) Référence BioLib : Triaenops persicus Dobson, 1871 (Syn. de Triaenops rufus) (consulté le )
- (en) Référence Catalogue of Life : Triaenops rufus A. Milne-Edwards, 1881 (consulté le )
- (fr + en) Référence ITIS : Triaenops rufus A. Milne-Edwards, 1881 (consulté le )
- (en) Référence Mammal Species of the World (3e éd., 2005) : Triaenops rufus Milne-Edwards, 1881 (consulté le )
- (en) Référence NCBI : Triaenops rufus (taxons inclus) (consulté le )
- (en) Référence UICN : espèce Triaenops rufus Milne-Edwards, 1881 (consulté le )
Notes et références
[modifier | modifier le code]Notes
[modifier | modifier le code]- Les lancettes de la feuille nasale sont plutôt de taille équivalente pour les espèces du genre Paratriaenops.
- Chez T. afer et T. persicus, l'os du museau est plus large.
Références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Triaenops menamena » (voir la liste des auteurs).
- Ranivo & Goodman (2006), p. 982
- Peterson, Eger & Mitchell (1995), p. 82
- Benda & Vallo (2009), p. 29
- (en) K.E. Samonds, « Late Pleistocene bat fossils from Anjohibe Cave, northwestern Madagascar », Acta Chiropterologica, vol. 9, no 1, , p. 39-65 (ISSN 1508-1109, DOI 10.3161/1733-5329(2007)9[39:LPBFFA]2.0.CO;2, lire en ligne)
- Yoshiyuki (1995), p. 119
- (en) Steven M. Goodman et Julie Ranivo, « A new species of Triaenops (Mammalia, Chiroptera, Hipposideridae) from Aldabra Atoll, Picard Island (Seychelles) », Zoosystema, vol. 30, no 3, , p. 681-693 (lire en ligne)
- Yoshiyuki (1995), p. 120
- (en) N. Garbutt, Mammals of Madagascar: A Complete Guide, A. & C. Black, , 304 p. (ISBN 978-0-7136-7043-1), p. 71
- Ranivo & Goodman (2006), p. 971
- Ranivo & Goodman (2006), p. 972
- Benda & Vallo (2009), p. 29-30
- Ranivo & Goodman (2006), p. 974
- Ramasindrazana et al. (2013)
- Kofoky et al. (2007), p. 1042
- Kofoky et al. (2009), p. 380, table 1, fig. 4a
- Rakotoarivelo et al. (2007), table 2
- (en) Beza Ramasindrazana, Balsama Rajemison et Steven M. Goodman, « Bio-écologie des chauves-souris du Parc National de Tsimanampetsotsa. 2. Variation interspécifique et saisonnière du régime alimentaire », Malagasy Nature, vol. 6, , p. 117-124 (lire en ligne)
- Rakotoarivelo et al. (2007), p. 964
- (en) Erwan Lagadec, Yann Gomard, Vanina Guernier, Muriel Dietrich, Hervé Pascalis, Sarah Temmam, Beza Ramasindrazana, Steven M. Goodman, Pablo Tortosa et Koussay Dellagi, « Pathogenic Leptospira spp. in Bats, Madagascar and Union of the Comoros », Emerging Infectious Disease, vol. 18, no 10, (lire en ligne)
- (en) David A Wilkinson, Julien Mélade, Muriel Dietrich, Beza Ramasindrazana, Voahangy Soarimalala, Erwan Lagadec, Gildas le Minter, Pablo Tortosa, Jean-Michel Heraud, Xavier de Lamballerie, Steven M. Goodman, Koussay Dellagi et Herve Pascalis, « Highly diverse Morbillivirus-related paramyxoviruses in the wild fauna of southwestern Indian Ocean islands: evidence of exchange between introduced and endemic small mammals », Journal of Virology, American Society for Microbiology, vol. 88, no 12,
- Goodman & Ranivo (2009), p. 54
- Union internationale pour la conservation de la nature
- Kofoky et al. (2007), p. 1049
- (en) P.A. Racey, S.M. Goodman et R.K.B. Jenkins, « The ecology and conservation of Malagasy bats », dans T.H. Fleming et P.A. Racey, Island Bats: Evolution, Ecology, and Conservation, University of Chicago Press, , 549 p. (ISBN 978-0-226-25330-5), p. 369-404
- (en) A. Olsson, D. Emmett, D. Henson et E. Fanning, « Activity patterns and abundance of microchiropteran bats at a cave roost in southwest Madagascar », African Journal of Ecology, vol. 44, , p. 401-403 (DOI 10.1111/j.1365-2028.2006.00661.x)
- Kofoky et al. (2007), p. 1047
- (en) A.L. Russell, S.M. Goodman et M.P. Cox, « Coalescent analyses support multiple mainland-to-island dispersals in the evolution of Malagasy Triaenops bats (Chiroptera: Hipposideridae) », Journal of Biogeography, vol. 35, , p. 995-1003 (DOI 10.1111/j.1365-2699.2008.01891.x)
- (fr) Alphonse Milne-Edwards, « Observations sur quelques animaux de Madagascar », Comptes rendus hebdomadaires des séances de l'Académie des sciences, Paris, vol. 91, , p. 1034-1038 (lire en ligne)
- Goodman & Ranivo (2009), p. 47
- Benda & Vallo (2009), table 1
- Benda & Vallo (2009), p. 7
- Ranivo & Goodman (2006), p. 963, 975
- Goodman & Ranivo (2009), p. 52
- Goodman & Ranivo (2009), p. 52-53
- (fr) Paul Rode, « Catalogue des Types de Mammifères du Muséum national d'Histoire naturelle - Ordre des chiroptères », Bulletin du Muséum national d'histoire naturelle, Paris, 2e série, vol. 13, no 4, , p. 227-252
- Benda & Vallo (2009), p. 34
- (en) A.L. Russell, J. Ranivo, E.P. Palkovacs, S.M. Goodman et A.D. Yoder, « Working at the interface of phylogenetics and population genetics: a biogeographical analysis of Triaenops spp. (Chiroptera: Hipposideridae) », Molecular Ecology, vol. 16, , p. 839-851 (DOI 10.1111/j.1365-294X.2007.03192.x, lire en ligne)
- Benda & Vallo (2009), p. 27-28
- (en) Steven M. Goodman, « Hunting of Microchiroptera in south-western Madagascar », Oryx, vol. 40, no 2, , p. 225-228 (DOI 10.1017/S0030605306000354)