Radioaktivnost









Radioaktivnost ili radioaktivno zračenje je spontano emitiranje alfa-čestica i beta-čestica iz kemijske tvari, često praćeno i emisijom gama elektromagnetskih valova, pri čemu kemijski elementi prelaze iz jednih u druge te se oslobađa energija u obliku kinetičke energije emitiranih čestica ili energije elektromagnetskih valova. Svaka atomska jezgra ima karakteristično vrijeme poluraspada.
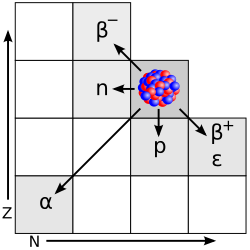
Radioaktivni raspad je pretvaranje jedne atomske jezgre u drugu uz emitiranje alfa-čestica ili beta-čestica i gama-zračenja. Već prema vrsti, to pretvaranje može biti alfa raspad, beta raspad i elektronski uhvat. Rjeđe se događaju raspadi emisijom jednog ili dva protona, neutrona, a teže jezgre mogu pri raspadu emitirati i ugljik 14C. Do radioaktivnoga raspada dolazi zbog nestabilnosti atomske jezgre. Neke su atomske jezgre prirodno nestabilne, a neke to mogu postati pošto su na njih djelovale čestice velike energije.[1]
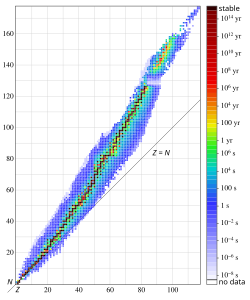
U radioaktivnim procesima, elementarne čestice ili elektromagnetska zračenja emitiraju se iz jezgri atoma. Najuobičajeniji oblici zračenja tradicionalno se nazivaju alfa-čestice (α), beta-čestice (β) i gama (γ) zračenjima. Zračenja iz jezgre se događaju i u drugim oblicima, uključujući emitiranje protona ili neutrona, te spontanih nuklearnih fisija (cijepanja) masivnih jezgri. Od svih jezgri koje su pronađene u prirodi, mnoge su stabilne. To je zbog toga što su se sve kratkoživuće radioaktivne jezgre raspale tijekom povijesti Zemlje. U prirodi se nalazi oko 270 stabilnih i oko 50 prirodnih radioaktivnih izotopa. Tisuće drugih radioaktivnih izotopa umjetno su stvarani u laboratorijima.
Radioaktivni raspad pretvara jednu jezgru u drugu ako nova jezgra ima veću energiju vezanja po nukleonu nego što je imala početna jezgra. Razlika u energiji vezanja (prije i poslije raspada) određuje koji se raspadi mogu energijski događati, a koji ne. Višak će energije vezanja izlaziti u obliku kinetičke energije ili mase čestica u raspadu.[2]
Nuklearni raspadi moraju zadovoljiti nekoliko zakona očuvanja energije, podrazumijevajući da vrijednost očuvane veličine nakon raspada (uzimajući u obzir sve produkte) ima jednaku vrijednost kao i za jezgru prije raspada. Očuvane veličine su ukupna energija (uključujući ekvivalent energije mase), električni naboj, linearna i kutna količina gibanja, broj nukleona, te leptonski broj (to jest suma broja elektrona, neutrina, te pozitrona i antineutrina, uzimajući antičestice s-1).[3]
Godine 1895. otkrio je W. C.Röntgen zagonetne X-zrake (rendgenske zrake) i izazvao velik interes za svjetlucanje raznih tvari. Ispitujući 1896. fosforescenciju, opazio je A. H. Becquerel da neke uranijeve soli bez ikakvog vanjskog povoda šalju neke nevidljive zrake, koje prolaze kroz metalne listiće i crne fotografsku ploču. Godine 1898. našla je M. Sklodowska-Curie isto takvo zagonetno zračenje kod torijevih spojeva. Malo zatim ona je utvrdila, da zračenje ne zavisi od kemijskog spoja i prema tome mora biti čista osobina atoma. Tražeći izvore novog zračenja, Sklodowska-Curie otkrila je u punom poletu pokusnog rada polonij i radij. Novootkriveni kemijski element, radij, zračio je oko milijun puta jače od uranija i po tome je dobio ime.
Prirodnu radioaktivnost otkrio je A. H. Becquerel 1896. uočivši da uranijeve soli emitiraju nevidljivo zračenje koje djeluje na fotografsku ploču kroz zaštitni papir slično rendgenskim zrakama te da pod utjecajem toga zračenja elektroskop gubi električni naboj. Primijetio je da uranijeve soli stalno u mraku fluoresciraju. Tako na primjer, čisti kalijev uranil sulfat u mraku stalno svijetli slabom zelenkastom luminiscentnom svijetlošću. Daljnjim ispitivanjem, Becquerel je pronašao da zračenje koje izazivaju uranijevi spojevi ioniziraju zrak (ionizirajuće zračenje), izazivaju fluorescenciju i prolaze kroz papir, pločice aluminija i bakra. Kroz zatvoreni spremnik one djeluju na fotografsku ploču, a djeluju i na našu kožu i klice raznih biljaka. Utvrdio je da ti zraci imaju slična svojstva kao rendgenske zrake (X – zrake), pa su se u početku te zrake nazivale i Becquerelove zrake. 1899. je Becquerel pronašao da te zrake skreću u magnetskom polju, pa se razlikuju od rendgenskih zraka, koje ne skreću u magnetskom polju.[4]
M. Curie-Skłodowska otkrila je 1898. takvo zračenje kod torijevih spojeva, te da se na zračenje ne može utjecati električnom strujom, zagrijavanjem, kemijskim reakcijama i slično, da se radioaktivni kemijski elementi pretvaraju jedni u druge i da je vjerojatnost raspada neovisna o starosti pojedinog atoma. Otkrila je da uranijev mineral uraninit (pehblend) emitira pet puta jače zrake nego čisti uranij. Kada je išla istraživati uraninit, pronašla je da se sastoji 75% od uranijevog oksida U3O8, a pronašla je još i neke druge kemijske tvari: PbS, CaO, SiO2, FeO, MgO i Bi. 1898. je Marie mjerila zračenje pojedinih udjela, pomoću osjetljivog elektroskopa, uz primjenu piezoelektriciteta i ionizacije zraka. Utvrdila je na primjer da bizmut, dobiven iz uraninita, ima 60 puta jače zračenje od čistog uranija. Pronašla je da bizmutovo jako zračenje nastaje zbog prisustva naznatne količine jednog nepoznatog kemijskog elementa, za koji se kasnije utvrdilo da je radij. Zato je predložila da se kemijski elementi koji izazivaju Becquerelove zrake nazovu radioaktivni elementi, a njihovo svojstvo radioaktivnost. Tek 1910. je uspjela izdvojiti radij.
E. Rutherford otkrio je 1899. da se zračenje radija sastoji od dvije komponente koje se različito apsorbiraju u tvarima. Onu vrstu zraka koje ne mogu proći kroz aluminijsku pločicu debljine 0,02 mm nazvao je alfa-česticama, a onu vrstu koja je prolazila i kroz deblje slojeve nazvao je beta-česticama. Na osnovu skretanja u magnetskom polju, utvrdeno je da alfa-čestice imaju pozitivni električni naboj, a beta-čestice negativan električni naboj.[5]
Godine 1899. pokazali su nezavisno Giesel, te Meyer i Schweidler, da zračenje može biti djelomično svinuto i rastavljeno jakim magnetom. Prema tome kako se ponašaju u magnetskom polju, možemo odmah razlučiti 3 vrste zraka. Jedne se svijaju kao struja pozitivno nabijenih čestica, druge kao struja negativnih čestica, a na treće uopće ne djeluje magnetsko polje. Prve su nazvane alfa-zrakama, druge beta-zrakama, a treće gama-zrakama. Alfa zrake i beta zrake mogu se ispitivati po Thomsonovoj ili Astonovoj metodi i tako odrediti omjer između naboja i mase čestica. Za beta-zrake dobije se isti omjer kao i kod katodnih zraka. Prema tome nije moglo biti sumnje da se tu radi o vrlo brzim elektronima. Pomoću scintilacije, Wilsonove komore ili Geiger-Müllerova brojila može se odrediti broj alfa-čestica koje emitira radioaktivna tvar. Istodobno može se izmjeriti i ukupna električna struja alfa-zračenja. Omjer između ukupnog električnog naboja i broja čestica daje električni naboj alfa-čestice. S velikom točnošću je izmjereno, da naboj alfa čestice iznosi +2e. Iz savijanja alfa-čestica u magnetskom polju može se izračunati omjer između električnog naboja i mase. Odatle izlazi da je masa alfa-čestice 4 puta veća od mase vodikova atoma. Alfa čestice su prema tome kanalne zrake helija. Što se tiče treće vrste zraka, one se ponašaju slično kao vrlo prodorne rendgenske zrake. Pokusi dokazuju nedvojbeno da su gama-zrake elektromagnetski valovi vrlo male valne duljine.
Najupadljivije je kod radioaktivnih pojava da se alfa i beta-čestice kreću s vrlo velikim brzinama. Brzina elektrona približuje se brzini svjetlosti. Najbrže čestice ispitivanih beta-čestica dostižu 99% brzine svjetlosti. Da se u laboratoriju s katodnim zrakama postignu tako velike energije, morao bi se upotrijebiti električni napon od preko milijun volti.
P. Villard je 1900. otkrio još prodorniju komponentu, gama-zrake. E. Rutherford i F. Soddy (1902.) na temelju analize gibanja zrakâ u magnetskom polju objasnili su prirodu radioaktivnosti. W. Pauli postavio je 1930. hipotezu o postojanju neutrina, tadašnjim detektorima neuhvatljive čestice koja odnosi dio energije u beta raspadu. E. Fermi postavio je 1933. prvu strogu teoriju beta raspada koja pretpostavlja da prijelaz neutrona u proton ili obratno uzrokuje slabo nuklearno međudjelovanje, a pritom dolazi do simultane emisije ili apsorpcije elektrona i neutrina. I. Joliot-Curie i F. Joliot-Curie prvi su 1934. umjetno izazvali radioaktivnost i proizveli umjetni radioizotop stabilnog elementa.
U početku su vladale sasvim pogrešne predodžbe o postanku zračenja. Kad se za 7 godina svestranog ispitivanja otkrilo veliko mnoštvo različitih radioaktivnih tvari, bivalo je sve jasnije da između njih mora postojati neka genetska veza. Godine 1903. dokazali su E. Rutherford i F. Soddy da se iz torija razvija jedan plin koji se kondenzira na temperaturi od - 120 °C. Iste godine našao je Dorn da se iz radija razvija jedna takva tvar koja se pretvara u tekućinu na temperaturi od - 150 °C. U toj odlučnoj godini utvrdili su Ramsay i F. Soddy da je snažno zračenje radijeve emanacije praćeno razvijanjem helijeva plina. Pod težinom svih tih pokusnih činjenica Rutherford je konačno izrekao zaključak da je radioaktivnost vezana s pretvorbama kemijskih elemenata. Radioaktivni atomi sami od sebe izbacuju elektrone i alfa-čestice i pri tom doživljavaju temeljnu promjenu svoje prirode.
Radioaktivne tvari se dijele prema tome da li njihovi atomi emitiraju alfa-čestice ili elektrone. Jedan atom koji izbaci helijev ion mora se, naravno, uvelike promijeniti. Prema Soddyju i Faillanceu za radioaktivno raspadanje vrijede ovi zakoni:
- emisija alfa-čestica prouzrokuje smanjenje rednog broja kemijskog elementa (atomski broj Z) za 2, a atomske težine A za 4;
- emisija elektrona (beta-čestica) ne mijenja se osjetno atomska težina kemijskog elementa A, ali se njegov redni broj Z poveća za 1;
- emisija gama-zraka ne uzrokuje pretvorbu kemijskog elementa.
Radioaktivne tvari proizlaze jedna iz druge u 3 nezavisna niza. Ishodište jedne porodice radioaktivnih tvari čini glavni uranijev izotop s masom 238 (238U). Iz uranija nastaje poslije nekoliko pretvorba radij, pa se ta porodica zove porodica uranija i radija. Radioaktivno raspadanje završava s olovom. Druga porodica počinje s rijetkim uranijevim izotopom 235 (235U). Prije se pogrešno za ishodište tog radioaktivnog niza uzimao aktinij. Ta porodica zove se porodicom aktinija. Treća porodica počinje s torijem.
Pri beta radioaktivnom raspadanju nastali kemijski element ima gotovo istu atomsku masu kao i početni; poslije dva beta raspadanja i rednog alfa raspadanja dobivamo isti kemijski element, koji ima atomsku masu manju za 4 jedinice od izvornog. Sve to pokazuje da masa nije svojstvena osobina kemijskog elementa. Vidi se odatle kako je važno da se izmjere mase pojedinih atoma elemenata, a ne smjese kao na vagi.
J. J. Thomson je na osnovu savijanja staza čestica u električnom i magnetskom polju izradio metodu za mjerenje omjera e/m. Ta metoda je zaista vrlo prikladna, dok su čestice koje jure kroz električni kondenzator laki elektroni. Međutim, za mnogo teže čestice kanalnih zraka ne mogu se postići na taj način točno mjerenje. Mase čestica kanalnih zraka često se vrlo malo razlikuju, pa bi se po opisanoj metodi dobile dvije usko priljubljene parabole, i teško bi bilo odrediti točnu vrijednost kvocijenta naboja i mase.
F. W. Aston je stoga promijenio uređaj tako da je kanalne zrake pustio najprije kroz električni kondenzator, a zatim kroz magnetsko polje. Uzmimo da su se u električnom kondenzatoru kanalne zrake svinule prema dolje. Aston tada uzima magnetsko polje tako da ono savija kanalne zrake prema gore. Na taj način magnetsko polje kompenzira savijanje u električnom polju. U električnom kondenzatoru bivaju jače svinute staze čestica koje imaju manju brzinu. No te jače svinute staze opet se jače savijaju u magnetskom polju. Djelovanje magnetskog polja suprotno je učinku električnog polja. Električni kondenzator rasipa staze, magnetsko polje ih skuplja. Jedinstveni snop kanalnih zraka koji je ušao u kondenzator sjedinjuje se opet u jednoj točki. Na ovom mjestu aparature postavlja se fotografska ploča. Sve čestice različitih brzina, ali istog omjera e/m padaju na istu točku. One ostavljaju jednu "spektralnu liniju". Izvedu li se pokusi s različitim kanalnim zrakama, tad i to sjecište ima različite položaje u prostoru. No sva ta sjecišta leže na istom pravcu. Očito je sada kako ispitivač treba da postupi. On mora staviti fotografsku ploču na taj zamišljeni pravac. Tad će se na ploči pojaviti "spektri" kanalnih zraka. Svakoj točki (crti) na ploči odgovara jedna vrsta čestica s određenim omjerom e/m.
Svoje prve pokuse izveo je Aston 1920. s kanalnim zrakama neona. Začudo, mjesto jedne crte dobio je on nekoliko crta. Nije moglo biti sumnje kako da se objasni opažanje. Kemijski element neon sastoji se od atoma različitih masa. Jedni atomi imaju masu 20, drugi 21, treći 22. Kemičari su neonu pripisali atomsku masu 20,2. U stvari, to je prosječna atomska masa tih triju vrsta atoma. U postocima od ukupne količine neona dolazi na pojedine sastavne dijelove: 90% 20Ne, 0,27% 21Ne i 9,73% 22Ne.
Atomi istog kemijskog elementa koji imaju različite mase zovu se izotopi. Izotopi imaju ista kemijska svojstva, ulaze u iste kemijske spojeve pa se prilikom kemijskih reakcija ne razdvajaju. Tako i prvi po redu element, vodik, ima dva izotopa. Uz obični vodik s atomskom težinom 1 dolazi 0,02% izotopa s masom 2.Teški elementi imaju veći broj izotopa. Kod najtežih elemenata broj izotopa kreće se oko 10, no ima elemenata i bez izotopa. Atomska masa elementa u kemiji prosjek je atomskih masa izotopa.[6]
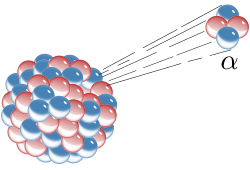
Alfa raspad promjena je atomske jezgre pri kojoj jezgra emitira alfa-česticu, maseni broj A se smanjuje za 4, a atomski broj Z za 2. Primjerice alfa-raspadom uranija-238 nastaju torij-234 i alfa-čestica. Ernest Rutherford zaključio da su alfa-čestice ustvari ioni helija ili samo atomska jezgra helija.[7]
Beta raspad promjena je atomske jezgre pri kojoj dolazi do emisije ili apsorpcije elektrona ili pozitivnog elektrona (pozitrona) i antineutrina ili neutrina. Pritom se maseni broj ne mijenja, a atomski broj elementa promijeni se za jedan. U prirodnim radioaktivnim nizovima pri takozvanom beta-minus-raspadu jedan neutron u jezgri raspada se na elektron, antineutrino i proton. Primjerice beta-raspadom torija-233 nastaju paladij-234, beta-minus-čestica i antineutrino. Prilikom umjetno izazvane radioaktivnosti može doći i do beta-plus-raspada, to jest emisije pozitrona i neutrina; maseni broj elementa ostaje isti, a atomski se broj smanji za jedan. Beta-čestice su ustvari elektroni velikih brzina, ali za razliku od elektrona u elektronskom omotaču atoma, nastaju iz atomske jezgre.
Elektronski uhvat pojava je pri kojoj jezgra zahvati jedan elektron iz atomskog omotača i smanji svoj pozitivni naboj za jedan. Udaljeni elektroni popunjavaju ispražnjena mjesta i pritom dolazi do emisije rendgenskoga zračenja.
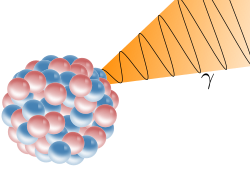
Gama-radioaktivnost prijelaz je između stanja više pobuđenosti atomske jezgre u stanje niže pobuđenosti ili u osnovno stanje, a elektromagnetsko zračenje visoke frekvencije koje se pritom emitira naziva se gama-zračenje. Tada se ne mijenjaju više atomski ni maseni broj elementa. Za gama-zračenje je utvrđeno da odgovaraju tvrdim rendgenskim zrakama. To su dokazali E. Rutherford i E. N. da Costa Andrade 1914., ogibom ili difrakcijom gama-čestica kroz odgovarajuću kristalnu rešetku, pomoću koje su uspjeli i odrediti i njihovu valnu duljinu. Prema dosadašnjim mjerenjima utvrđeno je da su valne duljine gama-čestica između 0,000 466 nm i 0,042 8 nm. Prema tome, gama-čestice odgovaraju kratkovalnom rendgenskom zračenju, ali za razliku od rendgenskog zračenja nastaju u atomskoj jezgri.
Unutarnja konverzija proces je pri kojem jezgra izravno predaje višak energije elektronu u unutarnjim slojevima atomskog omotača. Taj elektron napušta atom, a njegovo izbacivanje prati emisija rendgenskih zraka. Redni i maseni brojevi atoma ne mijenjaju se.
Zračenje nastalo radioaktivnošću razlikuje se po prodornosti, električnom naboju, građi i po procesima koji dovode do emisije. Alfa-zračenje može zaustaviti papir, beta-zračenje može zaustaviti aluminijski lim debeo nekoliko milimetara, a većinu gama-zračenja može zaustaviti desetak centimetara debela olovna ploča. U magnetskom polju alfa-zrake savijaju se kao pozitivno nabijene čestice, beta-zrake kao negativne ili pozitivne, a gama-zrake prolaze nesmetano.
Neutronsko zračenje je roj brzih neutrona, po masi slični protonima. Vrlo lako prodiru kroz neku kemijsku tvar, jer nemaju električni naboj. Neutronsko zračenje može biti posljedica nuklearne reakcije. Komponenta je kozmičkog zračenja i zračenja iz nestabilnih teških jezgri. Vrlo snažno neutronsko zračenje nastaje u nuklearnim reaktorima tijekom nuklearne lančane reakcije jezgri. Energija neutrona kod neutronskih zračenja iznosi od oko 10 MeV pa naniže. Ako se energija neutrona smanji na energije manje od 1 eV, nazivaju se termičkim neutronima.
Ostala zračenja se nazivaju prema česticama od kojih se sastoje: protonsko, deuterijsko, tricijsko, teškoionsko, i drugo. Takva zračenja mogu nastati u nuklearnim reakcijama, dio su kozmičkog zračenja, a nastaju i u nuklearnim reaktorima ili nuklearnim eksplozijama.
| Vrsta radioaktivnosti | Elementarne čestice koje sudjeluju | Novi kemijski element |
|---|---|---|
| Radioaktvno zračenje s emisijom protona i neutrona: | ||
| Alfa raspad | Alfa-čestica (A = 4, Z = 2) koja je emitirana iz atomske jezgre | (A − 4, Z − 2) |
| Protonsko zračenje | Proton izbačen iz atomske jezgre | (A − 1, Z − 1) |
| Neutronsko zračenje | Neutron izbačen iz atomske jezgre | (A − 1, Z) |
| Dvostruko protonsko zračenje | Dva protona izbačena iz atomske jezgre istovremeno | (A − 2, Z − 2) |
| Samostalna nuklearna fisija | Atomska jezgra se raspada u dvije ili vise manje atomske jezgre i ostale čestice | — |
| Teškoionsko zračenje | Atomska jezgra zrači određenu vrstu manjih atomskih jezgri (A1, Z1) koje su manje ili veće od alfa-čestica | (A − A1, Z − Z1) + (A1, Z1) |
| Različiti oblici beta raspada: | ||
| Beta- raspad | Atomska jezgra zrači elektron i elektronski antineutrino | (A, Z + 1) |
| Pozitronsko zračenje ili beta+ raspad | Atomska jezgra zrači pozitron i elektronski antineutrino | (A, Z − 1) |
| Elektronski uhvat | Atomska jezgra uhvati elektron iz orbite i zrači neutrino, pa je nova atomska jezgra u pobuđenom i nestabilnom stanju | (A, Z − 1) |
| Ograničeni beta raspad | Atomska jezgra zrači elektron i antineutrino, ali elektron bude uhvaćen u praznu K-ljusku; nova atomska jezgra u pobuđenom i nestabilnom stanju. Ta pojava je rijetka, osim kod ioniziranih atoma, koji imaju prazninu u K-ljusci. | (A, Z + 1) |
| Dvostruki beta raspad | Atomska jezgra zrači dva elektrona i dva antineutrina | (A, Z + 2) |
| Dvostruki elektronski uhvat | Atomska jezgra uhvati dva orbitalna elektrona i zrači dva neutrina – nova atomska jezgra u pobuđenom i nestabilnom stanju | (A, Z − 2) |
| Elektronski uhvat sa zračenjem pozitrona | Atomska jezgra uhvati orbitalni elektron i zrači poziton i dva neutrina | (A, Z − 2) |
| Dvostruko pozitronsko zračenje | Atomska jezgra zrači dva pozitrona i dva antineutrina | (A, Z − 2) |
| Prijelazno stanje istog atomskog jezgra: | ||
| Izometarski prijelaz | Pobuđena atomska jezgra zrači visokoenergetski foton (gama-zračenje) | (A, Z) |
| Unutarnja pretvorba | Pobuđena atomska jezgra prenosi energiju na orbitalni elektron, koji bude izbačen iz atoma | (A, Z) |

Ionizirajuće zračenje je pojava za koju ljudska osjetila nisu razvijena, za razliku od mnogih drugih pojava u prirodi. Izravne posljedice djelovanja ionizirajućeg zračenja na živi svijet većinom su zakašnjele i teško ih je povezati s uzrokom. Čovjek može biti izložen i smrtonosnoj dozi ionizirajućeg zračenja, a da u samom trenutku ozračivanja ništa ne osjeti. Posljedice ozračivanja, bez osjetilne veze s uzrokom zapažaju se tek nakon nekog vremena, od nekoliko sati do nekoliko dana ili čak godina, što ovisi o vrsti i svojstvima tog zračenja. Otuda je razumljiv čovjekov strah, a poznavanje osnovnih svojstava ionizirajućeg zračenja, međudjelovanja zračenja s tvari, a posebno djelovanja zračenja na živa bića, je neobično važno u stručnom i psihološkom smislu.
Ionizirajuće zračenje je pojava prijenosa energije u obliku fotona (kvanti elektromagnetskog zračenja) ili masenih čestica, a koje ima dovoljno energije da u međudjelovanju s kemijskom tvari ionizira tu tvar. Ionizirajuće zračenje posljedica je promjene stanja materije u mikrosvijetu. To su promjene u energiji ili u sastavu atoma ili atomske jezgre, pri čemu se emitiraju fotoni ili druge čestice. U međudjelovanju s tvari dolazi do izmjene energije i izmjene strukture ozračene tvari. Takve posljedice mogu biti korisne, ali i vrlo štetne.[8]

Vjerojatnost da će se pojedina atomska jezgra raspasti tijekom nekog vremenskog raspona (intervala) ne ovisi o dobi dotične jezgre ili o tome kako je ona stvorena. Iako se stvarno vrijeme života pojedine jezgre ne može predvidjeti, srednje (ili prosječno) vrijeme života nekog uzorka jednakih jezgri može biti izmjereno i predviđeno. Jednostavan način određivanja vremena života nekih izotopa je mjerenje vremena raspada polovice jezgri tog promatranog uzorka. To se vrijeme naziva vremenom poluraspada, t1/2. Od originalnog broja jezgri koje se nisu raspale, njih polovica će se raspasti ako čekamo drugi interval vremena poluraspada pa ih ostaje jedna četvrtina. Za još jedan interval vremena poluraspada ostat će ih samo osmina neraspadnutih, i tako dalje.
Broj jezgri nekog uzorka koji će se raspasti u datom vremenskom intervalu je razmjeran broju jezgri tog uzorka. To vodi na zaključak da je proces radioaktivnog raspada eksponencijalni proces. Broj N atomskih jezgri koje su ostale neraspadnute nakon vremena t, u odnosu na izvorni broj jezgri N0, je:
gdje se λ naziva konstanta radioaktivnog raspada i vrijedi:
a mjerna jedinica je recipročna sekunda, s-1.

Svijet u kojem živimo radioaktivan je od svog postanka. Postoji oko 60 radionuklida (radioaktivnih elemenata), koje možemo pronaći u tlu, zraku, vodi, hrani, a time i u svim živim bićima. Po tome kako su nastali dijele se na one koji su oduvijek prisutni na Zemlji, one koji nastaju kao posljedica djelovanja kozmičkih zraka, te one koji su posljedica ljudske tehnologije.
U prvoj su skupini radioaktivni elementi poput uranija-235, uranija-238, torija-232, radija-226, radona-222 ili kalija-40. Oni potječu još iz vremena stvaranja Zemlje, a karakterizira ih vrlo dugo vrijeme poluraspada, čak i do milijardu godina (iznimka je plin radon, čiji je poluživot 3,8 dana). Kozmičko zračenje nas neprestano pogađa. Izvor mu je uglavnom izvan našeg Sunčevog sustava, a sastoji se od raznih oblika zračenja: od vrlo brzih teških čestica, pa do visokoenergijskih fotona i miona. Ono međudjeluje s atomima u gornjim slojevima atmosfere i tako proizvodi radionuklide, koji su najčešće kraćih vremena poluživota. To su, na primjer, ugljik-14, tricij, berilij-7 i drugi.
Ljudi su svojim djelovanjem, poglavito razvojem nuklearnih reaktora i testiranjem nuklearnog oružja, stvorili još neke radioaktivne elemente, poput stroncija-90, joda-129, joda-131, cezija-137, plutonija-239 i tako dalje.



Aktivnost radioaktivnog uzorka mjeri se u bekerelima (Bq). Aktivnost od 1 Bq znači jedan radioaktivni raspad u sekundi. Kako su aktivnosti uzoraka često vrlo velike u upotrebi je i veća jedinica kiri (Cu). 1 Cu iznosi 3,7∗ 1010 Bq.
Da bi se mjerila energija, koju putem ionizirajućeg zračenja apsorbira određena tvar, koristi se jedinica grej (Gy). Omjer te energije i mase tijela koje ju apsorbira zove se apsorbirana doza. Ako se energija od 1 J apsorbira u 1 kg tvari govorimo o apsorbiranoj dozi od 1 Gy. Ovako definirana doza ne govori ništa o biološkim učincima apsorbiranog zračenja. Svaka vrsta zračenja (α, β, γ) ima drugačiji utjecaj na žive stanice, koji se opisuje faktorom Q. Zato se definira ekvivalentna doza, koju dobijemo tako da apsorbiranu dozu pomnožimo faktorom Q. Jedinica za ekvivalentnu dozu je sivert (Sv).
Od zračenja se nikamo ne možemo sakriti. Stoga svaki čovjek prima godišnju ekvivalentnu dozu zračenja od približno 3,5 mSv. To je prosječna doza, a sastoji se od sljedećih doprinosa:
- Udisanje radona - 2 mSv
- Ostali radionuklidi uneseni u tijelo - 0,39 mSv
- Zemljino zračenje - 0,28 mSv
- Kozmičko zračenje - 0,28 mSv
Tako ispada da je ukupna doza od prirodnih izvora 3 mSv, a ukupna doza od umjetnih izvora 0,5 mSv. Ukupna doza od umjetnih izvora proračunata je prema prosječnoj izloženosti medicinskom zračenju, korištenju raznih aparata, te doprinosu od testiranja nuklearnog oružja i rada nuklearnih elektrana. Najveći doprinos od umjetnih izvora daje medicinsko zračenje.
Prosječna doza koju primi stanovništvo u pojedinim dijelovima Hrvatske od vanjskog ozračivanja:[9]
- Osijek (najviše): 1,30 mSv/godina
- Zagreb: 1,14 mSv/godina
- Varaždin: 1,10 mSv/godina
- Rabac (najmanje): 0,66 mSv/godina
- prosjek: oko 1,00 mSv/godina
- više od 10 Sv izaziva tešku bolest i smrt u nekoliko tjedana.
- 2 - 10 Sv primljenih u kratkom roku izaziva smrt s vjerojatnošću od 50%.
- 1 Sv primljen u kratkom roku izazvao bi radijacijsku bolest (mučninu, gubitak kose), ali najvjerojatnije ne i smrt.
- 50 mSv godišnje je najmanja doza za koju postoje dokazi da izaziva rak.
Učinci velikih doza poznati su iz sudbina preživjelih ljudi iz Hirošime i Nagasakija, za koje je naknadno procijenjena doza zračenja koju su primili. O učincima malih doza govori se na temelju ekstrapolacije učinaka velikih doza i pretpostavke njihove linearnosti, jer je učinke malih doza teško direktno pratiti i razlučiti od brojnih drugih čimbenika koji utječu na zdravlje. Na taj je način izračunato da će od milijun ljudi koji prime dodatnu dozu zračenja od 1 mSv njih 50 zbog toga umrijeti od raka.
Radioaktivne jezgre mogu se dobiti bombardiranjem stabilnih jezgara protonima, alfa-česticama, neutronima i tako dalje. Glavni izvor umjetnih radioaktivnih elemenata su nuklearni reaktori i akceleratori čestica. Tijekom Drugog svjetskog rata i pedeset godina poslije razvijano je nuklearno oružje. Radioaktivni elementi mogu se dobiti i na umjetan način, na primjer tako da se prirodni element bombardira nuklearnim projektilima, protonima, alfa-česticama, neutronima i tako dalje, te u njemu izazove nuklearna transmutacija u novi element ili novi izotop istog elementa. Kao projektili za bombardiranje neutroni su jako pogodni jer nemaju naboja i stoga lako prodiru u jezgru atoma.
Izvori radioaktivnih elemenata mogu biti:
- primjena zračenja u medicini (radiobiologija, nuklearna medicina, radioterapija);
- pokusne nuklearne eksplozije:
- industrija;
- nuklearne elektrane (zrače manje od televizijskog zaslona);
- drugi izvori (aparati za radiobiologiju s rendgenskim zrakama ili neutronima, akceleratori čestica).
- ↑ radioaktivni raspad, [1] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2019.
- ↑ [2] Arhivirana inačica izvorne stranice od 31. srpnja 2017. (Wayback Machine) "Od rude do žutog kolača", Nuklearna elektrana Krško, 2011.
- ↑ [3] Arhivirana inačica izvorne stranice od 5. veljače 2017. (Wayback Machine) "4.1 FIZIKA NEK-a - Fisija", Nuklearna elektrana Krško, e-škola, 2011.
- ↑ [4] Arhivirana inačica izvorne stranice od 1. siječnja 2012. (Wayback Machine) "Povijest fizike", Ivan Supek, 2011.
- ↑ [5][neaktivna poveznica] "Kemija I", chem.grf.unizg.hr, 2011.
- ↑ Ivan Supek: "Nova fizika", Školska knjiga Zagreb, 1966.
- ↑ [6][neaktivna poveznica] "Uvod u nuklearnu energetiku", Prof. dr. sc. Danilo Feretić, 2011.
- ↑ [7] Arhivirana inačica izvorne stranice od 5. srpnja 2010. (Wayback Machine) "Ionizirajuće zračenje u biosferi", Nuklearna elektrana Krško, Mile Dželalija, Kemijsko-tehnološki fakultet, Sveučilište u Splitu, 2011.
- ↑ [8] Arhivirana inačica izvorne stranice od 25. studenoga 2012. (Wayback Machine) "Jedinica radioaktivnosti", www.radiobiologija.vef.unizg.hr, 2011.


