アミジン
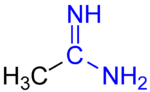
アセトアミジン
アミジン (amidine) は有機化学における官能基の一種で、R−C(=NR1)−NR2R3 で表される構造を持つものである。1つの炭素に二重結合で窒素原子が1つ、単結合で窒素原子が1つ付いている。
構造
[編集]オキソ酸 RnE(=O)OH のヒドロキシル基(-OH)がアミノ基(-NH2)、ケトン基(=O)がイミノ基(=NR)に置換した誘導体と見なすことができ、アミジンの一般式RnE(=NR)NR2 が誘導される[1][2][3]。基となるオキソ酸がカルボン酸のときのアミジンはカルボキシアミジン(carboxamidine)と呼び、一般構造は下図の通りである。

性質
[編集]非環状構造では容易に加水分解を受けるため不安定なことが多く、この官能基が天然物中に見出されることは少ない。一方、アミジンの部分構造を有する複素環式化合物としては、DBU や DBN などの合成試薬、あるいはイミダゾール、ピリミジン、プリンなどの各種誘導体が挙げられる。
アミジンは一般に強い塩基性を示す。その理由はプロトン化された共役酸が、正電荷を2つの窒素原子に分散(非局在化)させ安定化できるためである。
合成
[編集]非環式のアミジンを実験室で調製する場合、イミド酸エステル R−C(=NR1)−OR2 やイミド酸塩化物 R−C(=NR1)−Cl などのイミド酸誘導体に、アミンやアンモニアを作用させる手法が一般的である。官能基の種類によっては、ニトリルへのアミンの付加によりアミジンが得られる場合がある。
用途
[編集]強い塩基性を生かし、誘導体の DBU や DBN などは有機合成において求核性の低い強塩基として、脱ハロゲン化水素反応などに多用される。またイミダゾールやピリミジンなど複素環式化合物の合成原料としても用いられる。H2ブロッカーなど、医薬の部分構造としても多用される。
出典
[編集]- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). オンライン版: (2006-) "amidines".
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). オンライン版: (2006-) "carboxamidines".
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). オンライン版: (2006-) "sulfinamidines".
