イソシアニド
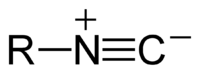
イソシアニド (isocyanide) は、有機化学において R-N≡C の構造を持つ化合物群を指す。無機化学では-N≡Cの部分が配位子として錯体を構成する。
有機化学ではイソニトリル (isonitrile) 、カルビルアミンとも呼ばれ、ニトリル (R-CN) と比べ、炭素と窒素の位置が逆転している。さまざまな有機窒素化合物への合成中間体としての反応性が知られ、分子量が小さいものに悪臭を持つものが多い。なお、IUPAC は「isonitrile」を廃止された呼称 (obsolete) としており、「isocyanide」を使うように推奨している。
接頭辞「イソシアノ–」または種類名「–イソシアニド」「イソシアン化–」を用いて命名される。
イソシアノ基
[編集]イソニトリルが持つ -NC の構造は、イソシアノ基 (isocyano group) と呼ばれる 1価の官能基である。一酸化炭素と同じ電子構造を持ち、下図のような共鳴式によりその反応性が理解されている。
合成
[編集]イソニトリルは通常、ギ酸のアミド(ホルムアミドの N-誘導体)の脱水により合成される。3級アミンの存在下、ホスゲンあるいはトリホスゲンなどが脱水剤として用いられる。
その後、ベンゾオキサゾールなどのオキサゾール誘導体にブチルリチウムなどの強塩基などを作用させて2位をリチオ化・開環し、リチオ化した部位を酸塩化物などによりアシル化することで、容易に官能基の付いたイソシアニドの合成が可能となった[1]。これらの高分子量のイソシアニドは、下記の反応を起こすものの、臭気が麦芽や石油、チェリー[要曖昧さ回避]様の穏和なもの、もしくは無臭となっている。
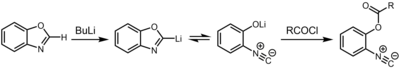
反応
[編集]共鳴式が示すように、イソシアノ基の炭素はカルベンとしての求電子性とカルバニオンとしての求核性とを合わせ持つ。そのため、求電子剤と求核剤ともに炭素上へ付加することができる。
有機リチウム化合物やグリニャール試薬はイソニトリルの炭素上に 1,1-付加する。
水素化アルミニウムリチウム (LAH) により還元され、メチルアミンに変わる。
イソニトリルを基質とする人名反応として、カルボン酸、アルデヒドとの 3成分で縮合してアミドを与えるパセリニ反応 (Passerini reaction)、そしてカルボン酸、アミン、アルデヒドとの 4成分で縮合してやはりアミドを与えるウギ反応 (Ugi reaction) が挙げられる。
一酸化炭素と同様に、遷移金属に対する配位子としてはたらく[2]。炭素-金属結合への挿入、金属触媒による重合反応などが知られる。
出典
[編集]- ^ Pirrung, M. C.; Ghorai, S. (2006). “Versatile, Fragrant, Convertible Isonitriles”. Journal of the American Chemical Society 128 (36): 11772–11773. doi:10.1021/ja0644374. PMID 16953613.
- ^ 伊藤嘉彦「イソニトリルの新反応」『有機合成化学協会誌』第58巻第5号、有機合成化学協会、2000年、381-383頁、doi:10.5059/yukigoseikyokaishi.58.381。
外部リンク
[編集]- isocyanides - IUPAC Gold Book
- "匂いのゴジラ"の無効化 - chem-station




