Biochimie

Biochimia este știința care se ocupă cu studiul proceselor chimice care au loc în sau care sunt legate de existența organismelor vii. Complexitatea vieții provine de la marea varietate a proceselor biochimice.[1]
Considerată multă vreme o ramură interdisciplinară aflată la granița dintre chimie și biologie, biochimia s-a dezvoltat în special în ultimele decenii ca o disciplină de sine stătătoare, abordând subiecte ca structura chimică a substanțelor din care sunt formate organismele, interacțiunile între aceste substanțe și transformările metabolice pe care acestea le suferă in vivo. În mare, se poate considera că biochimia are două ramuri: biochimia metabolică și biochimia structurală. Se mai pot considera ca și ramuri ale biochimiei și știința proteinelor și genetica moleculară.[2] Biochimia se concentrează pe înțelegerea modului în care biomoleculele dau naștere proceselor care au loc în interiorul celulelor vii și între acestea,[3] care ajută în continuare la înțelegerea funcționării țesuturilor, organelor și în final a organismelor, atât structural cât și funcțional. [4]
- Biochimia structurală se ocupă cu studiul moleculelor vieții: proteine și aminoacizi, glucide, lipide, acizi nucleici. De asemenea, această ramură studiază și vitaminele și enzimele.
- Biochimia metabolică studiază căile metabolice prin care nutrienții sunt procesați în interiorul celulelor vii (anabolism și catabolism).
Biochimia acizilor nucleici și studiul codului genetic, sinteza proteinelor (transcripția și translația), studiul fenomenelor de transport membranar și de transmitere a semnalelor sunt doar câteva domenii în care biochimia cunoaște un progres remarcabil în ultimii ani.
Istoric
[modificare | modificare sursă]Bioelemente
[modificare | modificare sursă]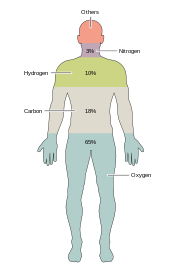
Aproximativ douăzeci din cele 92 de elemente chimice răspândite în natură sunt esențiale pentru diferitele forme de viață existente pe Pământ. Majoritatea elementelor chimice mai rare nu sunt necesare pentru viață (exceptând seleniul și iodul), în timp ce și unele foarte comune (precum aluminiul și titanul) nu sunt necesare. Majoritatea organismelor vii au aceleași cerințe în ceea ce privește necesarul de elemente, dar apar diferențe între organismele vegetale și animale. De exemplu, algele marine au nevoie de brom, dar viețuitoarele terestre și animalele nu necesită acest element. Toate animalele necesită sodiu, dar unele plante nu. Plantele au nevoie de bor și siliciu, dar animalele de obicei nu le necesită (sau au nevoie de ele în cantități extrem de mici).
Doar șase elemente—carbonul, hidrogenul, azotul, oxigenul, calciul și fosforul—alcătuiesc aproximativ 99% din masa celulelor vii, incluzându-le și pe cele din corpul uman. În plus față de aceste șase bioelemente majore care compun corpul uman, mai sunt necesare în cantități mici încă 18 elemente. Elemente chimice care se regăsesc în cantități extrem de mici, microelementele, reprezintă un procent de aproximativ 0,074% din materia vie.[5]
Biomolecule
[modificare | modificare sursă]În biochimie sunt considerate patru mari clase de biomolecule, care sunt molecule cu importanță biologică. Acestea sunt glucidele, lipidele, proteinele și acizii nucleici.[6] Multe molecule biologice sunt de natură polimerică, putând spune că monomerii în acest caz sunt micromolecule relativ mici legate împreună pentru a forma o macromoleculă. Când monomerii se leagă pentru a forma biopolimerul, sunt supuși unui proces de sinteză prin deshidratare. Diferitele macromolecule pot și ele să se asambleze în complecși de dimensiuni mai mari, de obicei fiind nevoie de ei pentru activitatea biologică pe care o posedă.
Glucide
[modificare | modificare sursă]Glucidele sau carbohidrații au în general rolul de depozitare al energiei și rol structural. De asemenea, au implicații importante în comunicarea și semnalizarea intercelulară.
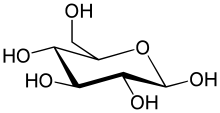
Cel mai simplu tip de glucidă este o monozaharidă, care este alcătuită din atomi de carbon, hidrogen și oxigen, în general în raport de 1:2:1 (cu formula generală CnH2nOn, unde n este cel puțin 3). Glucoza (C6H12O6) este una dintre cele mai importante glucide, iar printre alte exemple importante se numără fructoza (C6H12O6),[7][a] și dezoxiriboza (C5H10O4). Printre proprietățile ozelor se numără și aceea de a-și putea schimba forma moleculară din aciclică în ciclică și invers.

În aceste forme ciclice, ciclul este alcătuit uzual din 5 sau 6 atomi. Aceste forme sunt denumite furanozice și respectiv piranozice, prin analogie cu compușii heterociclici cu oxigen denumiți furan și piran. De exemplu, aldohexoza glucoză poate forma o legătură de tip hemiacetal între hidroxilul de la carbonul 1 și oxigenul legat de carbonul 4, obținându-se o formă moleculară cu un ciclu format din 5 atomi, denumită glucofuranoză. Aceeași reacție poate avea loc și între carbonii 1 și 5, când se obține analogul cu 6 atomi, denumit glucopiranoză.
Două monozaharide se pot lega între ele prin intermediul unei legături glicozidice sau eterice, formând o dizaharidă, într-o reacție de deshidratare (cu eliminarea unei molecule de apă). Reacția inversă de obținere a două molecule de monozaharide dintr-o singură moleculă dizaharidică se numește hidroliză, și se realizează în general enzimatic. Cea mai cunoscută dizaharidă este zaharoza, formată în urma legării dintre o moleculă de glucoză și una de fructoză. Un alt exemplu cunoscut este lactoza din lapte, formată în urma legării dintre o moleculă de glucoză și una de galactoză. Hidroliza lactozei are loc în prezența unei enzime denumite lactază, iar cantități scăzute din aceasta conduc la intoleranța la lactoză.
Când mai multe molecule de monozaharide (trei până la șase) se leagă, se obțin oligozaharide, și au diverse roluri biochimice, printre care se numără cea de semnalizare celulară.[8] Mai multe monozaharide legate formează o polizaharidă, iar structura acestei molecule mari poate fi de tip liniar sau ramificat. Cele mai comune exemple sunt celuloza, amidonul și glicogenul, toate alcătuite din unități repetitive de glucoză (alfa sau beta).
Glucidele pot fi caracterizare prin capacitatea lor reducătoare sau nereducătoare. Se spune despre o anumită glucidă că este reducătoare dacă un atom de carbon se află în echilibru în forma liniară de aldehidă (aldoză) sau de cetonă (cetoză). Dacă legarea monomerilor se face la acest atom de carbon, atunci grupa hidroxil a formelor piranozice sau a furanozice va fi schimbată cu o catenă laterală hidroxilată a unei alte zaharide, formându-se un acetal complet.
Lipide
[modificare | modificare sursă]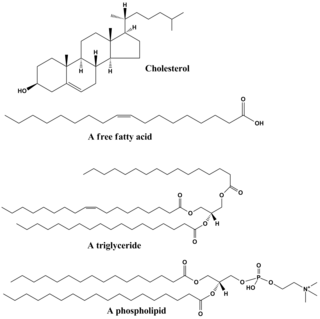
În categoria lipidelor se regăsesc multe molecule din clase chimice diverse, iar câteodată termenul de lipidă face referire la toți compușii de origine biologică nepolari și insolubili în apă. Printre cele mai comune exemple se numără cerurile, acizii grașii și derivații acestora, fosfolipidele, sfingolipidele, glicolipidele și terpenoidele (retinoidele și steroidele). Unele lipide sunt molecule alifatice liniare, în timp ce altele au structuri ciclice sau sunt aromatice. Unele sunt flexibile, altele au molecule rigide.[11]
Lipidele sunt de obicei alcătuite dintr-o moleculă de glicerol, care se leagă de alte molecule. În cazul trigliceridelor, principala grupă de lipide, molecula de glicerol se combină cu trei molecule de acizi grași. În acest caz, se poate considera că acizii grași sunt monomeri, și pot fi saturați (fără legături duble) sau nesaturați (una sau mai multe legături duble între atomii de carbon).[12]
Majoritatea lipidelor prezintă și un anume caracter polar, însă sunt majoritar nepolare. În general, cea mai mare parte a structurii moleculare lipide este nepolară sau hidrofobă, ceea ce înseamnă că acestea nu pot interacționa cu solvenții polari, precum apa. O altă parte a structurii lor, cea polară sau hidrofilă, are o tendință de asociere cu solvenții polari. De aceea, se spune despre moleculele lipidelor că sunt amfifile. În cazul colesterolului, partea polară este reprezentată de o grupă hidroxilică de tip alcool. În cazul fosfolipidelor, grupele polare sunt considerabil mai mari.[13]
Lipidele fac parte din dieta necesară zilnică. Majoritatea uleiurilor și a produselor lactate consumate sau utilizate la gătit (precum untul sau brânza) sunt compuse din grăsimi. Uleiurile vegetale sunt bogate în diverși acizi grași polinesaturați (PUFA). În timpul digestiei, alimentele ce conțin lipide sunt reduse la acizi grași și glicerol, care sunt produșii finali de degradare. Lipidele, în special fosfolipidele, au o importanță mare în domeniul farmaceutic, fiind folosite pe post de solubilizanți sau pentru transportul substanțelor medicamentoase (de exemplu, cu ajutorul lipozomilor).
Proteine
[modificare | modificare sursă]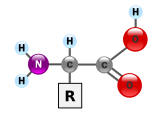
Proteinele sunt molecule macro-biopolimerice, adică sunt alcătuite din unități repetitive monomerice cunoscute pe larg sub denumirea de aminoacizi. Un aminoacid este alcătuit dintr-o catenă în care un atom de carbon are atașată o grupă amino, —NH2, catena se termină cu o grupă carboxil, —COOH (totuși trebuie menționat faptul că în condiții fiziologice, aminoacizii există sub formă de zwitterion, cu grupele de forma —NH3+ și —COO−), iar grupa R reprezintă orice grupare de atomi, putând fi chiar și un atom de hidrogen (în cazul glicocolului, cel mai simplu aminoacid). Catena laterală R diferă pentru fiecare aminoacid, astfel că există 20 de aminoacizi standard, iar aceasta este responsabilă și pentru proprietățile fiecărui aminoacid în parte. Fiecare catenă laterală are o influență deosebită asupra conformației tridimensionale finale a unei proteine. Unii aminoacizi au funcții separate, liberi sau în formă modificată; de exemplu glutamatul este un neurotransmițător important.
În urma unei reacții de deshidratare, are loc eliminarea unei molecule de apă și legarea a doi aminoacizi, identici sau diferiți, proces prin care se formează o legături peptidică. Molecula ce se obține se numește dipeptidă, iar moleculele formate prin unirea mai multor aminoacizi se numesc oligopeptide și respectiv polipeptide, după caz. Astfel, proteinele sunt macromoleculele formate prin unirea unui număr foarte mare din acești aminoacizi. De exemplu, albumina serică umană conține 585 de resturi de aminoacizi.[14]


Proteinele au atât rol structural, cât și funcțional. De exemplu, proteinele contractile actină și miozină sunt responsabile pentru contracția mușchilor scheletici. O proprietate comună a multor proteine este capacitatea acestora de a se lega specific de o anumită moleculă sau clasă de molecule, fiind astfel extrem de selective. Anticorpii sunt un bun exemplu de proteine care se leagă doar de un tip specific de molecule, fiind compuse din catene grele (mai mari) și ușoare. Cele două catene se leagă prin intermediul legăturilor disulfurice, realizate prin procese de modificare post-translaționale, iar specificitatea este datorată diferenței dintre domeniile N-terminale ale anticorpilor.[15]
Testul ELISA (engleză enzyme-linked immunosorbent assay), în cadrul căruia se folosesc anticorpi, este unul dintre cele mai sensibile teste medicale moderne utilizate pentru detecția diferitelor biomolecule, iar printre cele mai importante se numără enzimele. Practic, orice reacție biochimică ce se desfășoară într-o celulă vie necesită o anumită enzimă, care are ca scop diminuarea energiei de activare a reacției respective. Aceste molecule proteice recunosc specific moleculele de reactant, denumite în biochimie substrate, și catalizează reacția specifică dintre acestea. Prin micșorarea energiei de activare, enzimele măresc viteza unei reacții de aproximativ 1011 ori; astfel, o reacție care ar dura în mod normal peste 3.000 de ani să se desfășoare, în prezența enzimei potrivite va avea loc spontan, în mai puțin de o secundă. Este de menționat faptul că enzima nu se consumă în acest proces, și poate să catalizeze aceeași reacție de nenumărate ori, dacă are la dispoziție un noi set de substrate. Totuși, activitatea enzimatică are un control, astfel că mecanismele de reglare enzimatică au ca scop controlul metabolic total al celulei.
Structura proteinelor este descrisă, în mod tradițional, pe patru nivele. Structura primară a unei proteine descrie pur și simplu secvența liniară a aminoacizilor în catena polipeptidică, adică aranjamentul acestora. Un exemplu ar fi: "alanină-glicină-triptofan-serină-glutamat-asparagină-lizină-…". Structura secundară face referire la conformația locală a lanțului polipeptidic, și depinde de natura aminoacizilor constituenți. Unii aminoacizi au tendința de a induce catena sub formă de α-helix, iar altele sub formă de foi plisate β. Structura terțiară reprezintă aspectul tridimensional al macromoleculei proteice, și este direct determinată de secvența aminoacizilor. O simplă modificare a unui singur aminoacid din structura primară determină schimbarea întregii conformații tridimensionale. De exemplu, catena alfa a hemoglobinei conține 146 de resturi de aminoacizi; substituția unui rest glutamat cu unul de valină în poziția 6 schimbă atât de mult conformația încât produce boală denumită anemie falciformă sau siclemie. În cele din urmă, structura cuaternară, prezentă doar la unele proteine, descrie acele proteine care au funcție biologică doar când sunt formate din mai multe subunități, cum este de exemplu cazul hemoglobinei, o proteină tetrameră.[16]
Acizi nucleici
[modificare | modificare sursă]
Acizii nucleici, denumiți astfel datorită prezenței lor în nucleul celular, alcătuiesc o familie de biopolimeri complecși, cu masă moleculară mare, care au ca scop stocarea informației genetice în toate organismele vii, chiar și în cazul virusurilor.[2] Monomerii care stau la baza formării acizilor nucleici sunt denumiți nucleotide, iar fiecare este alcătuită din trei componente: o bază heterociclică cu azot denumită bază azotată (are la bază o purină sau o pirimidină), o zaharidă de tip pentoză (ori riboză, ori dezoxiriboză) și o grupare fosfat.[17]
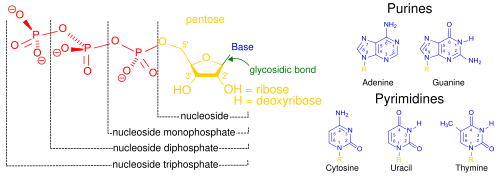
nucleozid-monofosfat, nucleozid-difosfat și nucleozid-trifosfat.
Cei mai comuni acizi nucleici sunt acidul dezoxiribonucleic (ADN) și acidul ribonucleic (ARN).[18] Grupa fosfat și zaharida fiecărei nucleotide se leagă pentru a forma catena acidului nucleic, în timp ce bazele azotate au rolul de a stoca informația genetică. Cele mai comune baze azotate sunt: adenina, citozina, guanina, timina și uracilul. Bazele azotate de pe fiecare catenă a unui acid nucleic vor forma legături de hidrogen cu bazele azotate din altă catenă complementară. Adenina se leagă de timină și de uracil, timina se leagă doar de adenină iar citozina și guanina se leagă între ele. Totuși, cele două tipuri de acizi nucleici diferă în ceea ce privește bazele azotate: cele comune sunt adenina, citozina și guanina; timina se află doar în ADN, iar uracilul se regăsește doar în ARN.
În afara rolului de material genetic celular, acizii nucleici mai au și un rol de mesager secund, formând, de asemenea, și o bază pentru molecula de adenozintrifosfat (ATP), molecula primară cu rol de transport și stocare al energiei în toate organismele vii.[19]
Metabolismul
[modificare | modificare sursă]O ramură importantă a biochimiei este reprezentată de biochimia metabolică, care are ca scop elucidarea mecanismelor prin care funcționează metabolismul în organismele vii, adică altfel spus modul în care organismele își procură, transformă și își depozitează energia.[20] Metabolismul este alcătuit dintr-un șir mare de reacții chimice ce au loc în interiorul celulei, iar unele dintre acestea sunt reunite în ceea ce se numește o cale metabolică.[20][21]
Căile metabolice contribuie la desfășurarea proceselor catabolice (degradative, exergonice, oxidative) și anabolice (biosintetice, endergonice, reductive), procese care sunt interdependente și controlate de către necesitățile de moment ale celulei (de exemplu, de factori precum creșterea, necesitatea mărită de energie, digestia) și de către activitățile fiziologice specifice organismului. Cele mai importante ramuri ale metabolismului sunt cel glucidic, lipidic, proteic și energetic.
Metabolismul glucidic
[modificare | modificare sursă]Metabolismul lipidic
[modificare | modificare sursă]Metabolismul proteic
[modificare | modificare sursă]Metabolismul energetic
[modificare | modificare sursă]Importanța biochimiei
[modificare | modificare sursă]- oferă cunoștințele necesare înțelegerii stării de sănătate și a mecanismelor patogenice în orice boală;
- permite tratarea cu succes a avitaminozelor, a insuficienței sau hiperfuncțiilor endocrine;
- explică modul de acțiune al medicamentelor, ca modulatori ai activității enzimatice, oferind datele necesare pentru sinteza de substanțe cu acțiune farmacologică dorită.
Relația cu alte științe biologice „la scară moleculară”
[modificare | modificare sursă]
Cercetătorii în biochimie folosesc tehnici specifice native din biochimie, dar le combină din ce în ce mai mult cu tehnicile și ideile dezvoltate în domeniile geneticii, biologiei moleculare și biofizicii. Nu există o linie definită între aceste discipline. Biochimia studiază chimia necesară activității biologice a moleculelor, biologia moleculară studiază activitatea lor biologică, genetica studiază ereditatea lor, ceea ce se întâmplă să fie purtată de genomul lor. Acest lucru este arătat în următoarea schematică care prezintă o perspectivă posibilă a relațiilor dintre câmpuri:
- Biochimia este studiul substanțelor chimice și al proceselor vitale care apar în organismele vii. Biochimiștii se concentrează puternic pe rolul, funcția și structura biomoleculelor. Studiul chimiei din spatele proceselor biologice și sinteza moleculelor biologic active sunt exemple de biochimie. Biochimia studiază viața la nivel atomic și molecular.
- Genetica este studiul efectului diferențelor genetice asupra organismelor. Acest lucru poate fi adesea dedus de absența unei componente normale (de exemplu, o genă). Studiul „mutanților” - organisme care nu au una sau mai multe componente funcționale în ceea ce privește așa-numitul „tip sălbatic” sau fenotip normal. Interacțiunile genetice (epistazie) pot confunda adesea interpretări simple ale unor astfel de studii „knockout”.
- Biologia moleculară este studiul bazelor moleculare ale proceselor de replicare, transcriere, translație și funcție celulară. Dogma centrală a biologiei moleculare unde materialul genetic este transcris în ARN și apoi tradus în proteine, în ciuda faptului că este simplificat, oferă încă un bun punct de plecare pentru înțelegerea câmpului. Imaginea a fost revizuită, având în vedere rolurile noi aparținând ARN. Biologia moleculară studiază viața la nivel molecular și celular.
- Biologia chimică încearcă să dezvolte noi instrumente bazate pe molecule mici care să permită perturbarea minimă a sistemelor biologice, oferind în același timp informații detaliate despre funcția lor. Mai mult, biologia chimică folosește sisteme biologice pentru a crea hibrizi non-naturali între biomolecule și dispozitive sintetice (de exemplu, capside virale golite care pot furniza terapie genică sau molecule de medicament).
Vezi și
[modificare | modificare sursă]Referințe
[modificare | modificare sursă]- ^ „Biochemistry”. acs.org.
- ^ a b Voet (2005), p. 3.
- ^ Karp (2009), p. 2.
- ^ Miller (2012). p. 62.
- ^ Nielsen (1999), pp. 283–303.
- ^ Slabaugh (2007), pp. 3–6.
- ^ Whiting (1970), pp. 1–31.
- ^ Varki (1999), p. 17.
- ^ Stryer (2007), p. 328.
- ^ Voet (2005), Ch. 12 Lipids and Membranes.
- ^ Fromm and Hargrove (2012), pp. 22–27.
- ^ Voet (2005), pp. 382–385.
- ^ Voet (2005), pp. 385–389.
- ^ Metzler (2001), p. 58.
- ^ „How antibodies fold”. Trends in Biochemical Sciences (în engleză). 35 (4): 189–198. . doi:10.1016/j.tibs.2009.11.005. ISSN 0968-0004. PMC 4716677
 .
.
- ^ Fromm and Hargrove (2012), pp. 35–51.
- ^ Saenger (1984), p. 84.
- ^ Tropp (2012), pp. 5–9.
- ^ Knowles (1980), pp. 877–919.
- ^ a b „Metabolic Biochemistry”, Whatislife.com, accesat în
- ^ David L. Nelson; Cox, Michael M. (). Lehninger principles of biochemistry (ed. 5th). New York: W.H. Freeman. p. 26. ISBN 978-0-7167-7108-1.
Bibliografia citată
[modificare | modificare sursă]- Amsler, Mark (). The Languages of Creativity: Models, Problem-solving, Discourse. University of Delaware Press. ISBN 978-0874132809.
- Astbury, W.T. (). „Molecular Biology or Ultrastructural Biology?” (PDF). Nature. 190 (4781): 1124. Bibcode:1961Natur.190.1124A. doi:10.1038/1901124a0. PMID 13684868. Accesat în .
- Ben-Menahem, Ari (). Historical Encyclopedia of Natural and Mathematical Sciences. Springer. p. 2982. ISBN 978-3-540-68831-0.
- Burton, Feldman (). The Nobel Prize: A History of Genius, Controversy, and Prestige. Arcade Publishing. ISBN 978-1559705929.
- Butler, John M. (). Fundamentals of Forensic DNA Typing. Academic Press. ISBN 978-0-08-096176-7.
- Chandan, Sen K.; Sashwati Roy (). „miRNA: Licensed to kill the messenger”. DNA and Cell Biology. 26 (4): 193–4. doi:10.1089/dna.2006.0567. PMID 17465885.
- Clarence, Peter Berg (). „The University of Iowa and Biochemistry from Their Beginnings”. ISBN 9780874140149.
- Edwards K.J.; Brown D.G.; Spink, N.; Skelly J.V.; Neidle S. (). „Molecular structure of the B-DNA dodecamer d(CGCAAATTTGCG)2. An examination of propeller twist and minor-groove water structure at 2.2 A resolution”. J. Mol. Biol. 226: 1161–1173. doi:10.1016/0022-2836(92)91059-x. PMID 1518049.
- Eldra P. Solomon; Linda R. Berg; Diana W. Martin (). Biology, 8th Edition, International Student Edition. Thomson Brooks/Cole. ISBN 978-0495317142. Arhivat din original la .
- Fariselli, Piero; Rossi, Ivan; Capriotti, Emidio; Casadio, Rita (). „The WWWH of remote homolog detection: the state of the art”. Briefings in Bioinformatics. 8 (2): 78–87. doi:10.1093/bib/bbl032. PMID 17003074.

- Fiske, John (). Outlines of Cosmic Philosophy Based on the Doctrines of Evolution, with Criticisms on the Positive Philosophy, Volume 1. Boston and New York: Houghton, Mifflin. Accesat în .
- Finkel, Richard; Cubeddu, Luigi; Clark, Michelle (). Lippincott's Illustrated Reviews: Pharmacology (ed. 4th). Lippincott Williams & Wilkins. ISBN 978-0-7817-7155-9.
- Krebs, Jocelyn E.; Goldstein, Elliott S.; Lewin, Benjamin; Kilpatrick, Stephen T. (). Essential Genes. Jones & Bartlett Publishers. ISBN 978-1-4496-1265-8.
- Fromm, Herbert J.; Hargrove, Mark (). Essentials of Biochemistry. Springer. ISBN 978-3-642-19623-2.
- Hamblin, Jacob Darwin (). Science in the Early Twentieth Century: An Encyclopedia. ABC-CLIO. ISBN 978-1-85109-665-7.
- Helvoort, Ton van (). Arne Hessenbruch, ed. Reader's Guide to the History of Science. Fitzroy Dearborn Publishing. ISBN 188496429X.
- Holmes, Frederic Lawrence (). Lavoisier and the Chemistry of Life: An Exploration of Scientific Creativity. University of Wisconsin Press. ISBN 978-0299099848.
- Horton, Derek, ed. (). Advances in Carbohydrate Chemistry and Biochemistry, Volume 70. Academic Press. ASIN B00H7E78BG.
- Hunter, Graeme K. (). Vital Forces: The Discovery of the Molecular Basis of Life. Academic Press. ISBN 978-0-12-361811-5.
- Karp, Gerald (). Cell and Molecular Biology: Concepts and Experiments. John Wiley & Sons. ISBN 9780470483374.
- Kauffman, G.B.; Chooljian, S.H. (). „Friedrich Wöhler (1800–1882), on the bicentennial of his birth”. The Chemical Educator. 6 (2): 121–133. doi:10.1007/s00897010444a.
- Kleinkauf, Horst; Döhren, Hans von; Jaenicke Lothar (). The Roots of Modern Biochemistry: Fritz Lippmann's Squiggle and its Consequences. Walter de Gruyter & Co. p. 116. ISBN 9783110852455.
- Knowles JR (). „Enzyme-catalyzed phosphoryl transfer reactions”. Annu. Rev. Biochem. 49: 877–919. doi:10.1146/annurev.bi.49.070180.004305. PMID 6250450.
- Metzler, David Everett; Metzler, Carol M. (). Biochemistry: The Chemical Reactions of Living Cells. 1. Academic Press. ISBN 978-0-12-492540-3.
- Miller G; Spoolman Scott (). Environmental Science - Biodiversity Is a Crucial Part of the Earth's Natural Capital. Cengage Learning. ISBN 1-133-70787-4. Accesat în .
- Nielsen, Forrest H. (). Maurice E. Shils ... et al.., ed. Ultratrace minerals; Modern nutrition in health and disease. Baltimore: Williams & Wilkins. pp. 283–303.
- Peet, Alisa (). Marks, Allan; Lieberman Michael A., ed. Marks' Basic Medical Biochemistry (Lieberman, Marks's Basic Medical Biochemistry) (ed. 4th). ISBN 160831572X.
- Rayner-Canham, Marelene F.; Rayner-Canham, Marelene; Rayner-Canham, Geoffrey (). Women in Chemistry: Their Changing Roles from Alchemical Times to the Mid-Twentieth Century. Chemical Heritage Foundation. ISBN 978-0941901277.
- Rojas-Ruiz, Fernando A; Vargas-Méndez, Leonor; Kouznetsov, Vladimir V (). „Challenges and Perspectives of Chemical Biology, a Successful Multidisciplinary Field of Natural Sciences”. Molecules. 16: 2672–2687. doi:10.3390/molecules16032672. ISSN 1420-3049. Arhivat din original la .
- Saenger, Wolfram (). Principles of Nucleic Acid Structure. New York: Springer-Verlag. ISBN 0-387-90762-9.
- Slabaugh, Michael R.; Seager, Spencer L. (). Organic and Biochemistry for Today (ed. 6th). Pacific Grove: Brooks Cole. ISBN 1133605141.
- Sherwood, Lauralee; Klandorf, Hillar; Yancey, Paul H. (). Animal Physiology: From Genes to Organisms. Cengage Learning. ISBN 978-0-8400-6865-1.
- Stryer L, Berg JM, Tymoczko JL (). Biochemistry (ed. 6th). San Francisco: W.H. Freeman. ISBN 978-0-7167-8724-2.
- Tropp, Burton E. (). Molecular Biology (ed. 4th). Jones & Bartlett Learning. ISBN 978-1-4496-0091-4.
- UNICEF (). Facts for life (PDF) (ed. 4th). New York: United Nations Children's Fund. ISBN 978-92-806-4466-1. Arhivat din original (PDF) la . Accesat în .
- Ulveling, Damien; Francastel, Claire; Hubé, Florent (). „When one is better than two: RNA with dual functions”. Biochimie. 93 (4): 633–644. doi:10.1016/j.biochi.2010.11.004. PMID 21111023.
- Varki A, Cummings R, Esko J, Jessica F, Hart G, Marth J (). Essentials of glycobiology. Essentials of glycobiology. Cold Spring Harbor Laboratory Press. ISBN 0-87969-560-9.
- Voet, D; Voet, JG (). Biochemistry (ed. 3rd). Hoboken, NJ: John Wiley & Sons Inc. ISBN 9780471193500. Arhivat din original la .
- Whiting, G.C (). „Sugars”. În A.C. Hulme. The Biochemistry of Fruits and their Products. Volume 1. London & New York: Academic Press. ISBN 0123612012.
- Ziesak, Anne-Katrin; Cram Hans-Robert (). Walter de Gruyter Publishers, 1749-1999. Walter de Gruyter & Co. ISBN 978-3110167412.
| ||||||||||||||||||||||||||||||||||
| ||||||||
| |||||||||||||||||||||||||||||||||||||||||||