Осмоза

Осмоза[1] представља дифузију молекула растварача кроз полупропустљиву мембрану која пропушта молекуле растварача али не пропушта молекуле растворене супстанце.[2][3][4] Осмоза се јавља кад су концентрације раствора са две стране мембране различите.[5][6] Пошто полупропустљива мембрана пропушта само молекуле растварача, али не и честице растворене супстанце, долази до дифузије растварача кроз мембрану тј. молекули растварача пролазе кроз мембрану како би се изједначиле концентрације са обе стране мембране. Молекули растварача се крећу из средине са мањом концентрацијом у средину са већом концентрацијом растворених супстанци. Представља врсту пасивног транспорта.[7]
При дифузији молекула растварача кроз мембрану долази до пораста нивоа течности на једној страни мембране и смањења нивоа течности на другом нивоу. Пораст нивоа течности на једној страни ствара хидростатички притисак који се супротставља осмози тј. осмотском притиску који дјелује на мембрану. Када се ова два притиска изједначе доћи ће до успоставе равнотеже и процес дифузије ће се завршити тј. неће више доћи до подизања нивоа течности. Притисак при коме се успоставља ова равнотежа се назива ефективни осмотски притисак. Осмотски притисак је већи што је концентрација раствора већа и обрнуто.
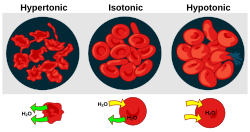
У природи постоји више примјера осмозе, као што је узимање воде из земљишта од стране биљака или улажење воде у ћелију итд. Ако се ћелије налазе у воденом раствору, вода (која у ћелији врши функцију растварача) ће тежити да прође кроз ћелијску мембрану у циљу да се изједначе концентрације са обе стране мембране. Тако, ако ћелију ставимо у хипотоничан раствор (раствор који је мање концентрације у однос на саму ћелију) доћи ће до улажења воде у ћелију, до њеног бубрења и прскања. У хипертоничном раствору (концентрованији од раствора у самој ћелији), вода ће излазити из ћелије и она ће се смежурати. Због тога је веома важно да се одржава сталан осмотски притисак, односно количина воде у организму што се назива осморегулација. Код сисара се осморегулација врши преко бубрега – вишак воде из крви прелази у мокраћу.
Историја
[уреди | уреди извор]


Неке врсте осмотског тока познате су од давнина, нпр. при изградњи египатских пирамида.[8] Жан-Антоан Нолет је први документовао посматрање осмозе 1748. године.[9] Реч „осмоза“ потиче од речи „endosmose“ и „exosmose“, коју је француски лекар Рене Жоахим Анри Дјутроше (1776–1847) формулисао од грчких речи ἔνδον (éndon „унутра“), ἔξω (éxō „спољашњи") и ὠσμός (ōsmós „потисак, импулсирање”).[10] Године 1867. Мориц Траубе је изумео високо селективне мембране за падавине, унапређујући уметност и технику мерења осмотског протока.
Механизам осмозе
[уреди | уреди извор]
1: Улаз морске воде,
2: Излаз слатке воде (40%),
3: Отпадна вода (60%),
4: Проток морске воде (60%),
5: Концентрисани одвод (гушћи од морске воде),
A: Проточна пумпа (40%),
B: Проточна пума,
C: Уређај за повратну осмозу с полупропусном мембраном,
D: Измењивач притиска.
Осмоза је процес у којем полупропусна мембрана одваја два раствора различитих концентрација. Полупропусна мембрана пропушта молекуле растварача док не пропушта честице растворених материја (јоне или молекуле). Молекули растварача се због разлике у концентрацијама растварача крећу с места мање концентрације према месту веће концентрације. Процес има тежњу одвијања све до изједначења концентрација с обе стране мембране; мање концентрисани раствор постаје концентрисанији, више концентрисаном раствору се смањује концентрација. Појава се може најједноставније објаснити кинетичком теоријом и чињеницом да на страни раствора с мањом концентрацијом растворених материја има више молекула растварача (воде) који зато прелазе на страну с мање молекула растварача.
При проласку молекула растварача кроз мембрану долази до пораста запремине растварача на једној страни мембране и смањења запремине растварача на другој страни. Пораст запремине растварача на једној страни ствара хидростатички притисак који се супротставља осмози, то јест осмотском притиску који делује на мембрану. Када се ова два притиска изједначе, успостави се динамична равнотежа, то јест више не долази до подизања нивоа раствора, док молекули растварача и даље пролазе кроз мембрану али у оба смера једнако интензивно. Притисак при коме се успоставља ова равнотежа назива се ефективни осмотски притисак. Осмотски је притисак већи што је разлика концентрација раствора већа, и обрнуто. Молекули растварача се крећу из раствора с нижом (хипотонични раствор) у раствор с вишом концентрацијом растворене материје (хипертонични раствор). Осмоза се може посматрати као посебан случај дифузије. Осмоларитет је релативна концентрација растворене материје у средини у којој се нађе ћелија.
Осмоза и дифузија
[уреди | уреди извор]Дифузија се не одвија само између хемијских материја које се додирују, него такође између материја које су одељене неком преградом, односно мембраном. Осим тога, дифузија течности може постојати и кроз преграде насупрот сили теже, и то с извесним притиском који се назива осмотски притисак. Ако се на пример одели раствор модре галице и води неком мембраном (на пример животињским мехуром) може се уочити да вода много брже продире кроз мембрану у модру галицу него модра галица у воду. Вода ће дотле продирати док не наступи равнотежа између хидростатског и осмотског притиска.
Дифузија кроз пропусне или полупропусне мембране (зидове) назива се осмоза. Притисак који због различите концентрације раствора покреће течности у смеру веће концентрације назива се осмотски притисак. При додиру две течности различитих концентрација течности настоје да своју концентрацију изједначе дифузијом. Будући да молекули модре галице не могу тако брзо да пролазе кроз полупропусну мембрану у воду, то се концентрација изједначава на тај начин да вода продире у раствор модре галице и њихове концентрације се изједначују.
Осмотски притисак је код неких раствора врло велик, тако је на пример код шећерног раствора 60 000 N/mm2 (0,6 bar). Осмоза је важна за живе организме. Зидови ћелија су опне које пропуштају само оне материје које су организму потребне за храну.[11]
Ћелијска осмоза
[уреди | уреди извор]Осмоза у ћелији наступа због разлике у осмоларитету цитоплазме с унутрашње, и раствора с спољне стране мембране, што доводи до смежуравања или бубрења ћелије. Чешћа појава бубрења и лизе ћелије наступа због веће концентрације растворених јона и малих органских молекула у ћелији, због чега је она хипертонична у односу на своју околину, те вода улази у ћелију. Ћелије се проблему високог осмоларитета прилагођавају, зависно од царства којем поједини организам припада:
- Ћелије биљака, алги, гљива, и већине бактерија обавијене су ћелијским зидом који је довољно чврст да спречи распрснуће ћелије у хипотоночном раствору. У њима се, услед уласка воде, ствара тургорски притисак који ону количину воде која уђе покреће ка спољашности, те су биљна ткива изузетно јака. У хипетоничном раствору излазак воде узрокује одвајање мембране од ћелијског зида, те доводи до процеса плазмолизе и увенућа биљке.
- Животињске ћелије проблем осмоларитета решавају активним избацивањем неорганских јона и смањивањем разлике у концентрацијама растворених материја (првенствено натријума) између ћелије и њене околине (натријум-калијумска пумпа или K пумпа). При томе троше значајне количине енергије.
Повратна осмоза
[уреди | уреди извор]Повратна осмоза, обрнута осмоза или реверзна осмоза је метода која служи за добијање питке воде из слане воде. Поступак користи полупропусну мембрану кроз коју пролази чиста вода а заостају соли. Притисак слане воде мора бити око 25 бар, што ову методу чини скупом за производњу већих количина свеже воде. Хлориди, амонијак и угљен диоксид су мали молекули, те пролазе кроз полупропусну мембрану. Њих је неопходно накнадно уклонити активним угљем. Неке бактерије и вируси такође пролазе кроз полупропусну мембрану, те је воду потребно дезинфицирати (хлорисање, озон, УВ светиљка, сунчева дезинфекција).[12]
Повратна осмоза или реверзна осмоза је скоро савршен процес филтрирања воде. Овај процес омогућава одстрањивање најситнијих честица из воде. Повратна осмоза се користи за пречишћавање воде и одстрањивање неорганских минерала, соли и осталих нечистоћа у циљу побољшања изгледа, укуса и осталих својстава воде. Тако се добива квалитет вода за пиће који задовољава све стандарде вода за пиће. Након познатих начина пречишћавање воде индустријском филтрацијом (градски водовод и фабрике), прокувавањем и хлорисањем, дошло се до технички скоро савршеног начина филтрирања воде, који готово од сваке загађене воде може начинити здраву питку вода. Осмотске мембране које се користе у овом поступку имају толико ситне отворе да кроз њих могу проћи готово само молекули чисте воде, а све нечистоће остају на мембрани и избацују се преко одвода као техничка отпадна вода. Оваквим начином филтрације воде добија се вода за пиће високог квалитета, која се може користити и у медицинске сврхе (вода за бебе).[13]
Види још
[уреди | уреди извор]Референце
[уреди | уреди извор]- ^ „osmosis Meaning in the Cambridge English Dictionary”. dictionary.cambridge.org.
- ^ „Osmosis”. Oxford English Dictionary (3rd изд.). Oxford University Press. септембар 2005. (Потребна је претплата или чланска картица јавне библиотеке УК.)
- ^ Osmosis, Encyclopædia Britannica on-line
- ^ Haynie, Donald T. (2001). Biological Thermodynamics
 . Cambridge: Cambridge University Press. стр. 130–136. ISBN 978-0-521-79549-4.
. Cambridge: Cambridge University Press. стр. 130–136. ISBN 978-0-521-79549-4.
- ^ Waugh, A.; Grant, A. (2007). Anatomy and Physiology in Health and Illness. Edinburgh: Elsevier. стр. 25—26. ISBN 978-0-443-10101-4.
- ^ Osmosis Архивирано 22 фебруар 2008 на сајту Wayback Machine. University of Hamburg. last change: 31 July 2003
- ^ „Statkraft to build the world's first prototype osmotic power plant”. Statkraft. 2007-10-03. Архивирано из оригинала 2009-02-27. г.
- ^ Hammel, H.T.; Scholander, P.F. (1976). Perspectives on the Mechanism of Osmosis and Imbibition In: Osmosis and tensile solvent. Springer-Verlag, Berlin, Heidelberg, New York. link.
- ^ L’Abbé Nollet (June 1748) "Recherches sur les causes du bouillonnement des liquides" (Researches on the causes of the boiling of liquids) Mémoires de Mathématique et de Physique, tirés des registres de l’Académie Royale des Sciences de l’année 1748, pp. 57–104; especially pp. 101–103. The Mémoires (1748) were printed in: Histoire de l’Académie Royale des Sciences Année 1748, which was published in 1752 and which contains a condensed version of Nollet's article on pages 10–19.
Original text : Avant que de finir ce Mémoire, je crois devoir rendre compte d'un fait que je dois au hasard, & qui me parut d'abord … singulier … j'en avois rempli une fiole cylindrique, longue de cinq pouces, & d'un pouce de diamètre ou environ ; & l'ayant couverte d'un morceau de vessie mouillée & ficelée au col du vaisseau, je l'avois plongée dans un grand vase plein d'eau, afin d'être sûr qu'il ne rentrât aucun air dans l'esprit de vin. Au bout de cinq ou six heures, je fus tout surpris de voir que la fiole étoit plus pleine qu'au moment de son immersion, quoiqu'elle le fût alors autant que ses bords pouvoient le permettre ; la vessie qui lui servoit de bouchon, étoit devenue convexe & si tendue, qu’en la piquant avec une épingle, il en sortit un jet de liqueur qui s'éleva à plus d'un pied de hauteur.
Translation : Before finishing this memoir, I think I should report an event that I owe to chance and which at first seemed to me … strange … I filled [with alcohol] a cylindrical vial, five inches long and about one inch in diameter; and [after] having covered it with piece of damp bladder [which was] tied to the neck of the vial, I immersed it in a large bowl full of water, in order to be sure that no air re-entered the alcohol. At the end of 5 or 6 hours, I was very surprised to see that the vial was fuller than at the moment of its immersion, although it [had been filled] as far as its sides would allow ; the bladder that served as its cap, bulged and had become so stretched that on pricking it with a needle, there came from it a jet of alcohol that rose more than a foot high.
- ^ Etymology of "osmosis" :
- Henri Dutrochet, L'Agent Immédiat du Movement Vital Dévoilé dans sa Nature et dans son Mode d'Action chez les Végétaux et chez les Animaux [The immediate agent of living movement, its nature and mode of action revealed in plants and animals] (Paris, France: Dentu, 1826), pp. 115 and 126.
- The intermediate word "osmose" and the word "osmotic" were coined by Scottish chemist Thomas Graham. See: Thomas Graham (1854) "VII. The Bakerian Lecture – On Osmotic Force," Philosophical Transactions of the Royal Society (London), vol. 144, pp. 177–288; see especially pp. 177, 178, and 227. See also: Thomas Graham and Henry Watts, Elements of Chemistry: Including the Applications of the Sciences in the Arts, 2nd ed. (London, England: Hippolyte Bailliere, 1858), vol. 2, p. 616.
- The word "osmosis" first appeared in: Jabez Hogg, The Microscope: Its History, Construction, and Application..., 6th ed. (London, England: George Routledge and Sons, 1867), p. 226.
- The etymology of the word "osmosis" is discussed in: Homer W. Smith (1960). „I. Theory of Solutions: A knowledge of the laws of solutions”. Circulation. 21 (5): 808—817 (810). PMID 13831991. doi:10.1161/01.CIR.21.5.808
 .
.
- ^ Velimir Kruz: "Tehnička fizika za tehničke škole", "Školska knjiga" Zagreb, 1969.
- ^ [1] "Reverzna osmoza", Englesko-hrvatski kemijski rječnik & glosar, www.glossary.periodni.com, 2012.
- ^ [2][мртва веза] "Kondicioniranje vode", www.grad.unizg.hr, 2012.
Литература
[уреди | уреди извор]- Шербан, М, Нада: Ћелија - структуре и облици, ЗУНС, Београд, 2001
- Гроздановић-Радовановић, Јелена: Цитологија, ЗУНС, Београд, 2000
- Пантић, Р, В: Биологија ћелије, Универзитет у Београду, београд, 1997
- Диклић, Вукосава, Косановић, Марија, Дукић, Смиљка, Николиш, Јованка: Биологија са хуманом генетиком, Графопан, Београд, 2001
- Петровић, Н, Ђорђе: Основи ензимологије, ЗУНС, Београд, 1998
- Lang KS, Lang PA, Bauer C, Duranton C, Wieder T, Huber SM, Lang F (2005). „Mechanisms of suicidal erythrocyte death”. Cellular Physiology and Biochemistry. 15 (5): 195—202. PMID 15956782. doi:10.1159/000086406.
- Kültz D, Burg M (новембар 1998). „Evolution of osmotic stress signaling via MAP kinase cascades”. The Journal of Experimental Biology. 201 (Pt 22): 3015—21. PMID 9787121. doi:10.1242/jeb.201.22.3015
 .
. - Kültz D (новембар 2007). „Osmotic stress sensing and signaling in animals”. The FEBS Journal. 274 (22): 5781. PMID 17944944. doi:10.1111/j.1742-4658.2007.06097.x
 .
. - „Unique Characteristics of Prokaryotic Cells”.
- Ho SN (јануар 2006). „Intracellular water homeostasis and the mammalian cellular osmotic stress response”. Journal of Cellular Physiology. 206 (1): 9—15. PMID 15965902. S2CID 21178769. doi:10.1002/jcp.20445.
- Brocker C, Thompson DC, Vasiliou V (август 2012). „The role of hyperosmotic stress in inflammation and disease”. Biomolecular Concepts. 3 (4): 345—364. PMC 3438915
 . PMID 22977648. doi:10.1515/bmc-2012-0001.
. PMID 22977648. doi:10.1515/bmc-2012-0001. - Erickson, Geoffrey R.; Alexopoulos, Leonidas G.; Guilak, Farshid (2001). „Hyper-osmotic stress induces volume change and calcium transients in chondrocytes by transmembrane, phospholipid, and G-protein pathways”. Journal of Biomechanics. 34 (12): 1527—1535. PMID 11716854. doi:10.1016/S0021-9290(01)00156-7.
- Kim, Jiyoung; Oh, Junsang; Sung, Gi-Ho (2016). „MAP Kinase Hog1 Regulates Metabolic Changes Induced by Hyperosmotic Stress”. Frontiers in Microbiology. 7: 732. PMC 4870262
 . PMID 27242748. doi:10.3389/fmicb.2016.00732
. PMID 27242748. doi:10.3389/fmicb.2016.00732  .
. - Pierce, Sidney K.; Politis, Alexander D.; Smith, Laurens H.; Rowland, Laura M. (1988). „A ca2+ Influx in Response to Hypo-Osmotic Stress May Alter Osmolyte Permeability by a Phenothiazine-Sensitive Mechanism”. Cell Calcium. 9 (3): 129—140. PMID 3138029. doi:10.1016/0143-4160(88)90016-4.
- Shahidullah, M.; Mandal, A.; Beimgraben, C.; Delamere, N.A. (2012). „Hyposmotic Stress Causes ATP Release and Stimulates Na,K‐ATPase Activity in Porcine Lens”. Journal of Cellular Physiology. 227 (4): 1428—1437. PMID 21618533. S2CID 22378117. doi:10.1002/jcp.22858.
- R.E. Pattle (2. 10. 1954). „Production of electric power by mixing fresh and salt water in the hydroelectric pile”. Nature. 174 (4431): 660. Bibcode:1954Natur.174..660P. S2CID 4144672. doi:10.1038/174660a0.
- S. Loeb (22. 8. 1975). „Osmotic power plants”. Science. 189 (4203): 654—655. Bibcode:1975Sci...189..654L. PMID 17838753. doi:10.1126/science.189.4203.654.
- United States Patent US4171409 Архивирано 2016-04-06 на сајту Wayback Machine
- Brogioli, Doriano (2009-07-29). „Extracting Renewable Energy from a Salinity Difference Using a Capacitor”. Physical Review Letters. American Physical Society (APS). 103 (5): 058501. Bibcode:2009PhRvL.103e8501B. ISSN 0031-9007. PMID 19792539. doi:10.1103/physrevlett.103.058501.
- Olsson, M.; Wick, G. L.; Isaacs, J. D. (1979-10-26). „Salinity Gradient Power: Utilizing Vapor Pressure Differences”. Science. American Association for the Advancement of Science (AAAS). 206 (4417): 452—454. Bibcode:1979Sci...206..452O. ISSN 0036-8075. PMID 17809370. S2CID 45143260. doi:10.1126/science.206.4417.452.