化學

  | |
  | |
  | |
| 唔同物質有唔同性質,由左到右、由上到下數: 錫(Sn)同硫(S); 鑽石(碳嘅一隻同素異形體)同 蔗糖(一隻碳水化合物); 氯化鈉(食鹽)同碳酸氫鈉(梳打粉)。 |
好多人嗌化學做「中心科學」(central science),噉係因為化學喺概念上處於好多領域嘅中間。好似係化學同物理學以及生物學之間嘅啦掕噉:物理學研究宇宙嘅基本定律(物理定律),原則上宇宙萬物-包括物質同唔係物質嘅嘢-都會跟從呢啲定律,亦即係話化學嘅研究對象冚唪唥都會守物理定律,所以化學知識需要建基喺物理學上,例子有用量子力學解釋一啲原子層面嘅現象(化學反應涉及原子之間交換電子)[4][註 1];另一方面,生物學研究嘅係生命,已知嘅生命全部都係由物質組成嘅-生物學研究嘅嘢冚唪唥都要守某啲化學上嘅法則,所以生物學需要用到化學上嘅知識(生物化學)了解生命嘅某啲特性,例如係研究碳水化合物等生命必需嘅化合物嘅合成過程噉[5]。總括嚟講,化學局部建基於物理學,又擔當「做生物學嘅基礎一部份」嘅角色,概念上位於呢兩個領域嘅「中間」[2]。
除咗理論研究之外,化學知識仲相當有實用價值,例如化學工程(chemical engineering)就係工程學當中專門用化學知識嚟設計人造系統嘅子領域,包括會用化學上嘅知識嚟合成好多對現代社會嚟講好有用嘅材料。化學咁有理論同實用價值,於是就廣泛噉畀人視為現代科學嘅重要一環[6][7]。
定位
[編輯]
基本哲學
[編輯]化學哲學(philosophy of chemistry)係門科學哲學,指哲學家同化學家對於「化學呢家嘢應該點搞」嘅睇法。喺呢方面,化學同第啲科學領域一樣,會跟足科學方法嚟去研究物質。化學界會:
- 根據手上已知係真嘅事實,諗一啲理論出嚟(「基於我哋經已觀察到嘅呢啲現象,我推測啲現象背後嘅法則係噉噉噉,令物質有呢啲行為」),呢啲理論好多時係用數學模型嘅方式嚟表達嘅;
- 跟手就靠邏輯性嘅思考,去諗吓呢柞理論會做點樣嘅預測(「如果我提倡嘅呢個理論係真確嘅,理應會...」);
- 然後就做實驗同觀察嚟攞數據,驗證吓個理論嘅預測係咪真確(「如果我呢個理論係真確,呢個實驗理應會得出某個某個結果,而個實際嘅實驗結果係...」);
- 如果數據顯示,個理論係做唔到準確嘅預測嘅話,就要一係根據攞到嘅數據睇吓個理論要點改先可以令佢做到準確啲嘅預測,一係就要諗新理論取代舊理論[8]。
上述嘅過程會係噉不斷重複,直至手上嘅理論做得到完全準確嘅預測為止-於是乎化學就有持續嘅發展,做到愈嚟愈準確嘅預測。到咗現代,化學經已有完整嘅理論體系,有多個理論解釋物質嘅本質,而呢啲理論每個都閒閒地俾化學家驗證過上百次-好經得起考驗,所以學界一般認為,呢啲理論係有返咁上下正確嘅模型(approximately accurate models)-能夠充分噉描述現實。而且化學仲會不斷噉去搵新嘅現象研究,睇吓呢啲理論能唔能夠解釋新現象,又或者使唔使諗新嘅理論[9][10]。
研究對象
[編輯]定義上,化學就係「研究物質(matter)嘅科學」,所以搞清楚咗「科學係咩」之後,另一樣要做嘅嘢就係答以下呢條問題:
| 「 | 何謂物質?
|
」 |
喺現代化學裏面,物質一般都係定義做具有以下呢啲特徵嘅嘢[6][11]:
當中頭嗰兩點齋靠普通日常觀察經已可以大致上得知。至於第三點,可以由化學反應嘅角度諗,想像以下呢兩句相對立(兩句嘢冇得同時成立)嘅假說[12]:
- 假說 1:物質冚唪唥都係由一大柞細細粒嘅嘢(原子;atom)組成嘅,呢啲細細粒嘅嘢係冇得再斬細啲嘅(原子論;atomic theory)[註 3];
- 假說 2:物質冇所謂嘅原子,是但攞一嚿物質,嚿物質都係連續(continous)嘅,即係(最少理論上)斬到幾細件都得嘅;
首先,由日常生活當中經已可以得知化學反應嘅現象:好多時,一隻物質喺接觸到某啲特定物質而且又有某啲特定環境條件嗰陣都會變樣,慢慢(或者好快)噉變做第隻物質,例如係生鏽嘅現象噉,就算一個人完全唔知現代嘅化學知識,佢都能夠觀察得到好多金屬-尤其係鐵-喺潮濕嘅環境下接觸到空氣(當中嘅氧)慢慢噉變質,變成唔同種嘅鏽[13][註 4]。

19 世紀初嘅英國化學家道耳頓(John Dalton)做咗大量嘅實驗同觀察。佢發現咗一個重要嘅事實:
| 「 | 」 |
已知質量唔會無端端少咗或者多咗,原子論能夠解釋得到呢種現象-想像錫同氧都係由一大柞細細粒、冇得斬件嘅原子組成嘅,錫原子同氧原子喺質量等特性上有差異,而兩者之間嘅化學反應涉及錫粒子同氧粒子結合,(例如)每粒錫粒子都會同一粒或者兩粒氧粒子結合,會出兩種唔同嘅產物;相比之下,如果假說 2 係真,就會出現「點解 100 克嘅錫唔能夠淨係消耗 20.25 克咁多嘅氧?」噉嘅問題[12][14]。基於以上呢個觀察同埋第啲打後嘅實驗證據,道耳頓等嘅早期化學家就主張,物質係由原子(冇得斬件嘅細粒粒子)組成嘅。到咗廿一世紀初,化學界同物理學界經已完全噉確立咗原子論-化學家都係以「物質冚唪唥都係由離散(discrete)嘅粒子組成嘅」為前題做化學上嘅研究[15]。
研究範疇
[編輯]現代化學包括咗研究物質嘅各種特性,大致上可以分做三大範疇[15]:
- 一方面,化學其中一個最緊要嘅課題就係研究物質之間會點樣互相有化學反應;化學性質(chemical properties)泛指物質喺化學反應入面表現出嚟嘅特質,例如係木噉,木燒得著,能夠同空氣入面嘅氧(O2)起反應變成第種物質,而呢種反應一超過咗特定嘅溫度就會自動發生(實驗顯示,冇咗氧或者冇返咁上下高溫度都唔會有呢種反應),途中會產生光同熱[16]。
- 另一方面,化學會研究物質嘅物理性質;物理性質(physical properties)係指物質喺化學反應以外表現出嚟嘅特質,例如由日常生活嘅觀察都可以得知,唔同嘅物質-水、鐵同氧呀噉-喺色水、硬度以及「喺室溫下會呈邊種相態(氣體定液體定固體?)」等嘅特性上都有差異,而呢啲差異唔使做化學反應都會展現到出嚟[17]。
- 除咗噉,化學對呢兩種性質嘅研究仲包括埋研究物質同能量之間嘅互動,例如係喺人工產生化學反應嘅時候,研究者有陣時會用電磁波(EM waves)嚟去激發或者加快啲化學作用[18]。而光譜學呢門領域就專門研究物質同光之間嘅互動[19]。
| 就噉睇(唔使做化學反應)都知唔同物質有唔同特性 | ||||||
|---|---|---|---|---|---|---|
|
物質基礎概念
[編輯]原子
[編輯]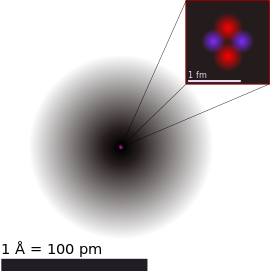
原子(atom)嘅概念可以話係現代化學嘅根基。化學元素(簡單講即係做得到化學反應嘅物質)冚唪唥都係由原子構成嘅。根據現代科學對原子嘅理解,一粒原子主要有以下嘅組成部份[20]:
當中原子核仲有得再細分做質子(proton)同中子(neutron)呢兩種再細啲嘅粒子,當中前者帶正電荷,後者冇電荷-所以原子核總體係帶正電荷。電子殼帶有若干數量帶負電荷嘅電子(electron)。質子同中子大粒過電子好多-據估計,質子嘅質量大約係電子嘅 1,836 倍咁多,但喺呈中性電荷嘅原子嗰度,電子殼入面嘅負電荷會啱啱好平衡到原子核入面嘅正電荷[20][21]。
發現原子
[編輯]電子同質子嘅發現源於 19 世紀中物理學上用映像管做嘅研究:當時啲物理學家發現,駁咗電嘅映像管(下圖嘅抽象圖解)條陰極(cathode)會射一啲肉眼睇唔到嘅、有質量而且帶有負電荷嘅嘢出嚟[22][23]-
- 下圖嘅 fluorescent screen(熒幕)係一塊特製嘅表面,已知呢種表面俾輻射射到嗰陣會變色;研究者發現,映像管條陰極對住嗰一忽「熒幕」會變色,而且佢哋仲發現如果佢哋搵嚿物體遮住條陰極,塊「熒幕」上面會有個「影」,即係有一笪空間冇變色(反映嗰笪冇俾輻射射到);上述嘅結果顯示,條陰極應該係射咗啲肉眼睇唔到嘅嘢出嚟。
- 條陰極射出嚟嘅嘢會推郁一啲輕嘅物體;噉即係表示,陰極射出嚟嗰啲嘢有動量(momentum),而一樣嘢有動量就表示嗰樣嘢有質量同速度。有關動量同速度等概念嘅詳情,可以睇吓古典力學。
- 條陰極射出嚟嘅嘢嘅郁動軌跡可以因為磁場(下圖嘅 deflecting coil)而彎曲;噉即係表示,陰極射出嚟嗰啲嘢有電荷(electric charge)-由打前少少嘅古典電磁學研究嗰度已知,係有電荷嘅物體先會因為磁場而改變郁動方向嘅。而且古典電磁學上仲有方法按件物體郁動方向點變(例如「向左定向右」同埋「變咗幾多角度」)嚟知道件物體帶嘅係正定負電荷同埋質量有幾大,進一步嘅分析顯示,條陰極射出嚟嘅嘢帶負電荷,而且質量好細(根據廿一世紀初嘅估計,一粒電子嘅質量大約係 9.1093837015 × 10-31 kg [24])。
而且打後嘅研究仲試過,搵多種用唔同材料造嘅陰極嚟搞同樣嘅實驗,發現用唔同材料造嘅陰極都出到噉嘅現象。於是科學界就萌生咗「電子」嘅概念-原子當中有質量極細、兼且帶負荷嘅組成部份[22][25]。而且電子嘅存在亦都表示,原子入面實係有一啲帶同等正電荷嘅嘢,所以原子整體先會帶中性電荷;而打後由紐西蘭物理學家盧瑟福(Ernest Rutherford)喺廿世紀頭嗰廿年做嘅一系列實驗顯示,用多種材料造嘅陽極會射出一啲帶正電荷、質量大過電子好多嘅嘢出嚟-萌生咗「質子」嘅概念[26][27];而量子力學上嘅發展亦都引致科學界喺 1930 年代初發現中子[28]。

元素
[編輯]元素概念
[編輯]對原子嘅研究引起咗元素(element)嘅諗頭:古希臘嗰陣嘅人經已有個諗法,諗住「元素係物質嘅基本,是但搵嚿物質,嚿物質都係由元素當中嘅若干款以某啲型式結合埋一齊形成嘅」[註 5][29];由 19 世紀尾至廿世紀初嘅原子研究表示,
- 物質都係由原子組成嘅(睇返上面原子論);
- 原子由質子同電子等再細粒啲嘅嘢組成;
呢兩個諗法自然引起咗一個猜想-「原子會唔會有好多唔同款,而呢啲款之間喺質子數量同電子數量上有差異?」[30]。事實係,早喺現代原子論成形打前,經已有煉金術同化學等領域[註 6]嘅研究者喺度觀念極大量唔同嘅化學反應,發現有某啲類型嘅物質係「冇得靠化學反應分解嘅」,呢啲物質一係就係同第啲物質結合又或者係做另外一啲物質結合嗰陣嘅副產物(「邊樣嘢係結合而成嘅產物」可以由重量等嘅資訊得知)[31];不過要去到廿世紀初,光譜學(spectroscopy;簡化噉講,電子數量唔同嘅原子喺俾光射到嗰陣會有唔同嘅行為,而呢啲差異可以攞嚟搵出一嚿物質有邊啲元素喺入面)等領域上有咗突破先至造就到現代化學上對元素嘅理解[32]。

週期表
[編輯]喺廿一世紀初嘅化學上,元素係跟原子序數(atomic number;定義係「隻元素每粒原子入面有幾多粒質子」)嚟排嘅[33]:
- 一隻化學元素係一個款嘅原子,一隻元素會有個特定嘅原子序數(簡稱「Z」),屬於一隻元素嘅原子冚唪唥都係原子核入面有 Z 咁多粒質子;例如氫(hydrogen;符號:,Z = 1)就係最簡單嗰隻元素,氫原子嘅原子核得嗰 1 粒質子;碳(carbon;符號:,Z = 6)原子嘅原子核有 6 粒質子;而鈾(uranium;符號:,Z = 92)係一隻好重嘅元素,鈾原子嘅原子核有成 92 粒質子咁多;元素係純嘅物質,如果一嚿物質入面嘅所有原子都屬同一隻元素,就冇得用化學方法嚟再去分解佢。而由元素組成嘅物質(包括水同人體)就叫做化學物質(chemical substance)-喺廿一世紀初,一般人日常會接觸到嘅物質都屬化學物質[34]。
- 同一隻元素可能有好多隻唔同嘅同位素(isotope)。「一隻元素嘅同位素」係指呢幾隻同位素之間喺原子序數上一樣,但質量數(mass number;定義係「粒原子入面質子數量同中子數量加埋得出嘅數」)唔同;好似係碳-13(carbon-13)同碳-14(carbon-14)噉就係同位素嘅出名例子,呢兩隻同位素都係原子核入面有 6 粒質子,所以都係屬碳,但碳-14 粒原子核嗰度多咗粒中子-所以碳-14 嘅原子核會重過碳-13 嘅,而且前者仲曉放輻射(可以睇埋放射性定年法)。同一種化學元素嘅同位素因為質子同電子數量一樣,所以化學特性會一樣,但佢哋喺物理特性上可以好唔同[35]。
- 廿一世紀初嘅化學興用元素週期表(periodic table;下圖)嚟列舉化學元素;元素週期表會按原子序數嚟排啲元素,由原子核入面得 1 粒質子嘅氫(Z = 1)開始數起;為咗方便起見,化學家幫每隻元素改好嗮名,而且隻隻元素都有個符號(化學符號)代表,每個符號由 1 至 3 個羅馬字母組成,例如氫嘅符號係「」而碳(Z = 6)嘅符號係「」-等啲人寫起化學相關嘅文章上嚟慳返好多時間精神,唔使吓吓都寫隻元素嘅全名出嚟;一般嚟講,喺元素週期表上同一個橫行或者同一個直行嘅元素都梗係會喺化學特性上有某啲相似性(可以睇吓電子殼同相關嘅概念)[36][37]。

其他重要概念
[編輯]
化學反應
[編輯]化學反應(chemical reaction)泛指令一柞化學物質(反應物;reagent)變成另外一柞化學物質(反應產物;product)嘅過程。化學反應發生嗰陣好多時都會有明顯、肉眼睇得到嘅變化-例如係出白煙(反應產物當中有白色嘅氣體)或者形成晶體(反應產物當中有曉結晶嘅固體)呀噉[38]。
化學反應有得分做好多唔同種類,而某啲種類嘅化學反應好常見,所以喺化學嘅學術研究上仲有咗一啲特定嘅名。例如中和反應(neutralization)就係泛指一種酸同一種鹼做化學反應,令到雙方嘅腐蝕性都冇咗[39]。
方程式
[編輯]喺廿一世紀嘅化學上,一場化學反應一般會攞化學方程式(chemical equation)嚟表達,一條化學方程式會用啲化學元素嘅符號嚟表示出嗰場化學反應入面有啲乜嘢元素郁咗同埋係點郁法,條式左邊嘅係反應物,而右邊嘅係反應產物,而且每嚿嘢仲會掕住個數表示每場反應要幾多粒嗰隻化學物質嘅粒子,即係好似下面條式噉[40][41]:
喺呢場反應入面,一粒氫分子()同一粒氟分子()首先各自折開變成兩粒氫原子同兩粒氟原子,而佢哋再結合形兩粒氟化氫( 粒 )分子-氫同氟呢兩種唔同嘅物質變咗做一種新物質。而除咗講清楚場反應涉及咗邊啲反應物同產物之外,一條化學方程式好多時仲會表示埋場反應產生嘅物理變化,例如放熱反應泛指發生嗰陣會釋放熱嘅化學反應[42],下面呢條式係表達緊甲烷()燃燒(同氧氣做反應)嘅過程:
- ;ΔH⚬ = - 890 kJ/mol
上面條式掕住嘅「ΔH⚬」係所謂嘅反應焓(enthalpy of reaction),簡單講就係反映場反應涉及嚿做反應嘅嘢出現咗幾多嘅熱能變化,負數就表示場反應釋放咗熱[43]。化學方程式嘅做法令到寫化學嘢嗰陣唔使吓吓都出嗮場化學反應啲物質嘅全名,而且又清楚。
反應率
[編輯]反應率(reaction rate)係指一場化學反應行得有幾快。化學反應率嘅定義可以噉樣諗[44]:
- 考慮一場噉嘅化學反應:
- ,
- 當中 同 係反應物(做反應嘅原料), 同 反應產物(場反應產生嘅物質),、、 同 反映化學計量數(簡化噉講即係「每 粒 同每 粒 會做反應出 咁多粒 同 咁多粒 」)[44];
- 假設場反應喺一個容量固定嘅封閉系統裏面發生,化學反應率()嘅定義可以係:
反應率可以受到好多因素影響,包括係溫度、(啲反應物嘅)濃度、壓力、溶劑同埋催化劑呀噉[45][46]。例如係溫度噉,有好多維持生命必需嘅化學反應,都係要喺適當嘅溫度之下先至行得到嘅(溫度唔啱會搞到反應率大跌),所以身體熱得滯或者凍得滯都可以搞到身體好多重要嘅化學反應行唔到,嚴重起上嚟可以引致死亡[47]。
化學鍵
[編輯]
化學鍵(chemical bond)最基本上係指原子等粒子之間形成嘅吸引力。考慮三點:
諗咗以上呢幾點之後一個自然嘅結論係,原子之間可以「黐埋一齊」,而「黐埋一齊」之後出嘅物質喺各種特性上可以同原先嗰啲物質有異;喺廣義上,呢啲令好似原子等做到化學反應嘅粒子「黐埋一齊」嘅力量就係所謂嘅化學鍵[48][49]。
化合物
[編輯]化合物(chemical compound)包括由多個一隻元素以固定比例同透過化學反應結合而成嘅物質,好似係水噉,水係一氧化二氫()-由氧()同氫()呢兩隻元素組成,而兩者喺水入面嘅比例係 1:2 -喺純水入面,每兩粒氫原子就有一粒氧原子。元素之間喺一種化合物入面嘅比例決定咗後者嘅化學特性。喺現代化學上,一隻化合物一般會用化學符號嘅形式寫出嚟,例如水嘅符號係「」,表示每粒水分子有兩粒氫()同一粒氧()組成[50]。
化合物最基本上可以分做有機(organic)同無機(inorganic)兩大類。有機化合物大致上係指有碳同氫之間嘅化學鍵嘅化合物,例子有碳水化合物(carbohydrate;碳水化合物又有好多唔同種,每種嘅成份都唔同)噉-碳嘅一個大特性係能夠同好多唔同嘅元素結合做化合物,產生好多唔同種嘅化合物,而有機化合物有成幾百萬種咁多,可以用嚟組成好多唔同款嘅賀爾蒙同組織[51];無機化合物基本上就係冇碳同氫之間嘅化學鍵嘅化合物,例如水就係一種無機化合物,有好多無機化合物都對生物嚟講有用,例如水喺生物嘅身體入面成日扮演溶劑(簡單講就係俾啲反應物溶喺入面,而呢樣嘢係好多化學反應嘅必要條件)嘅角色,俾好多維持生命必需嘅化學反應得以進行[52],而且無機化合物係地殼嘅重要組成部份[53]。

混合物
[編輯]要留意嘅係,化合物有異於混合物(mixture):混合物定義上係指一柞唔同嘅化學物質喺冇化學反應之下溝埋一齊(冇化學鍵)嘅產物[55],例如係將幾粒沙倒入水裏面,可以清楚睇到沙同水各自嘅化學特性都冇變-所以喺呢種情況下,兩者形成嘅係一種混合物;混合物嘅最大特徵係可以用唔涉及化學反應嘅方法嚟分返開,例如想像攞個筲箕,假設個筲箕上面啲窿夠細,將混合物倒落去個筲箕嗰度,就可以將沙同水分開。亦都有一啲化學物質就噉望落似係一種化合物,但查實係混合物,例如係空氣噉,古時嘅人好多時都諗住空氣係一種單一物質(睇古典元素當中嘅風),但用各種嘅分離過程做嘅研究發現,查實空氣係由氮氣()、二氧化碳()同氧等嘅多種氣體化學物質溝埋一齊形成嘅混合物[56]。
分離過程(seperation process)係化學嘅一個子領域,專門研究點樣將一樣混合物入面嘅各種唔同化學物質分返開。例如下圖就係喺實驗室做蒸餾(distillation)-一種成日用喺液體混合物身上嘅分離過程-用嘅架撐嘅抽象圖解[57][58]:

- 蒸餾嘅原理係,混合物入面嗰啲唔同嘅化學物質會保留各自嘅物理特性(混合物嘅定義),所以混合物唔同成份之間嘅沸點(指每隻物質喺咩溫度會蒸發)通常都會唔同,而如果隻混合物裏面嘅嗰啲唔同化學物質沸點有明顯嘅差異,就可以用蒸餾將佢哋分開;
- 喺附圖裏面嘅 13 同 14 等嘅部份會將隻混合物(裝喺 15 嗰個位)加熱;
- 加熱到咁上下,沸點最低嗰隻化學物質(暫且嗌佢做「液體 A」)會蒸發並且由啲管道引導去 8 嗰個位(同時研究者可能喺呢個時候調低 13 同 14 嘅熱度);
- 喺 8 嗰個位研究者會同隻化學物質做冷卻(例如想像 16 係一盤冰水),等變咗氣體嘅液體 A 凍到變返液體;
- 跟住研究者就可以攞走 8 嗰個容器-呢個容器會裝住純嘅液體 A,然後佢就要換過個新嘅容器落 8 嗰度同埋加返大 13 同 14 嘅熱度;
- 一路做上述嘅工序,做到攞到嗮啲想要嘅純化學物質為止。
鍵嘅類型
[編輯]根據廿一世紀初嘅化學知識,化學鍵係透過電子嘅分配將一嚿化合物入面嘅唔同原子黐埋一齊嘅力量,而且仲有得按「點分享電子法」分好多唔同種,例如係共價鍵同離子鍵呀噉[48]:
- 喺化學上嘅定義嚟講,一粒分子(molecule)係指由兩粒或者更多粒原子俾一啲化學鍵黐埋一齊嘅產物,而且成嚿嘢整體係冇帶電荷嘅;分子係化合物嘅最根本組織之一。好似係氧分子噉樣,氧分子嘅化學式係 -每粒氧分子入面都有兩粒氧原子由共價鍵連住,而且一粒氧分子嘅質子數量同電子數量一樣,所以整體嚟講唔帶電荷。好多常見嘅有機物質都係由分子所組成嘅,而海同大氣入面嘅物質大部份都係分子[59]。
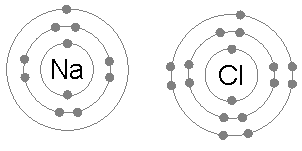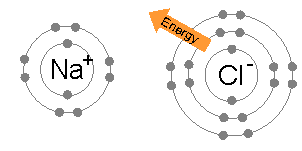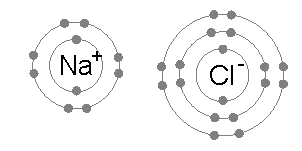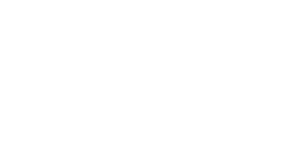
- 離子(ion)係一啲整體上帶電荷嘅粒子-即係原子或者分子做咗化學反應,少咗或者多咗電子而成嘅產物。例如係喺鈉(;Z = 11)同氯(;Z = 17)呢兩隻元素嘅化學反應入面,鈉原子會冇咗一粒電子,變成整體帶正電荷嘅正離子(),而氯原子會攞到一粒電子,變成整體帶負電荷嘅負離子()。呢兩隻離子跟住就會因為彼此之間帶嘅電荷相反而黐埋一齊(好似下面嗰幅想像圖解噉),形成一隻整體上帶中性電荷嘅化合物-食鹽();食鹽喺化學上嘅正式名係氯化鈉(sodium chloride)-表示呢隻物質係嗰兩隻元素嘅化合物[60],而呢種「以電子交流形成嘅異性電荷而黐埋一齊」嘅力量就係所謂嘅離子鍵。
... 等等。
定律
[編輯]
化學嘅基本目的就係要了解物質嘅變化,而呢門領域有唔少定律(law)。喺科學上,一條定律係句宣言,句宣言係由某啲實證嘅事實嗰度推導出嚟、能夠描述同預測某一類特定現象嘅,最好就係可以用數學方程式嘅方式表達出嚟[6]:
- 好似係身為化學根基嘅質量守恆定律(law of conservation of mass)噉,質量守恆定律喺化學上講緊嘅大致如下:
- 能量守恆定律(law of conservation of energy):能量呢家嘢冇得產生或者破壞;頂櫳只係有可能將能量由一款(例如係電能)變成另一款(例如係電流通過一條電線嗰陣,啲電能通常會有一部份變做熱而流失)[62]。可以睇吓熱力學方面嘅嘢。
... 等等。
子領域
[編輯]

化學仲可以再細分做好多個子領域:廿一世紀初嘅化學子領域之間差異頗大,好多時唔同子領域係專化到彼此之間因為行話多得滯而溝通有困難;通常一位化學家淨係會專攻化學其中一兩門嘅子領域,而唔係佢做嗰範嘅專業化學佢好有可能連睇都睇唔明;喺中學水平教嘅化學一般都係所謂嘅普通化學(general chemistry)-普通化學係化學嘅導論,為初學者提供一啲入門嘅基礎概念(例如係原子同化學反應呀噉),同專業嘅化學領域比起嚟並唔深入,但呢啲概念就算係打咗個基礎-就算係專業嘅化學家都仲會用嗰啲基礎概念嚟解釋同思考進階嘅化學知識[63][64]。
廿一世紀初嘅化學子領域主要有以下呢啲:
- 理論化學(theoretical chemistry):純科學(指純粹係求知而做嘅科研)嘅化學領域,追求建立能夠準確噉描述同預測物質相關現象嘅理論模型,例如原子論嘅研究就好多時都好理論化,做嚟純粹係為咗想解答「物質嘅本質係乜?」等冇乜直接應用價值嘅問題。
- 量子化學(quantum chemistry):攞量子力學同埋其他純理論嘅知識嚟解釋化學上嘅現象;研究量子化學嘅化學家會係噉留意住好似量子力學等解釋原子層面現象嘅物理理論有乜新發展,並且睇吓呢啲理論嘅概念有冇可能可以攞嚟解釋化學上撞到嘅問題(例如「量子力學上嘅新研究指,電子有陣時會有噉噉噉嘅行為,呢種行為有可能解釋到點解某啲化學反應會係噉噉噉...」)[65]。
- 運算化學(computational chemistry):用運算方法(例如係電腦模擬)嚟幫手解決化學上撞到嘅問題;包括化學反應在內等嘅化學現象都可以攞數學模型嚟模擬(例如係模擬化學反應率嗰啲方程式噉),化學家可以將呢啲數學模型寫做電腦程式行,用嚟模擬化學上嘅現象[66]。
- 分析化學(analytical chemistry):研究物質樣本以及點樣檢驗呢啲樣本嘅化學成份;分析化學對第啲化學子領域嚟講好有用。
- 儀器分析(instrumental chemistry):用實驗室有嘅架生做分析化學。
- 電化學分析(electroanalytical methods):用電相關嘅方法做分析化學;簡單例子:唔同物質嘅導電性能唔同[67]。
- 光譜學(spectroscopy):研究物質點樣同電磁波(包括光)互動,尤其係呢啲互動點樣受電磁波嘅頻率影響(某啲變數成電磁波頻率嘅函數);光譜學可以攞嚟做分析化學-簡化噉講,電子數量唔同嘅原子(唔同嘅元素或者離子)喺俾光射到嗰陣會有唔同嘅行為,所以呢啲差異可以攞嚟幫手鑑定一嚿物質有邊啲元素喺入面[68]。
- 分離過程(separation process):指將混合物入面嗰啲唔同化學物質分開嘅一系列技術同埋相關嘅研究,唔同混合物有唔同方法分開;例如蒸餾就係一種攞嚟將液體混合物分離嘅技術。
- 物理化學(physical chemistry):用物理學上嘅概念(好似係力、能量同時間呀噉)嚟研究化學系統,好多時會用微積分(calculus)去分析化學方程式。物理化學仲可以按照「集中用邊啲物理概念」嚟分做好多門子領域[69]:
- 電化學(electrochemistry):研究各種因為電而發生嘅化學反應或者會喺運作途中產生電嘅化學反應;例如日常生活度常見嘅電池就係電化學嘅研究成果[70]。
- 熱化學(thermochemistry):研究各種化學反應途中嘅熱能變化,例如係對放熱反應嘅研究噉。
- 凍化學(cryochemistry):研究極低溫(-150 °C 或者以下)之下嘅化學反應[71]。
- 聲化學(sonochemistry):研究化學物質同化學反應會點樣受到聲(尤其係超聲波)影響[72]。
- 光化學(photochemistry):研究化學物質同化學反應會點樣受到光(廣義上可以包埋可見光以外嘅電磁波)影響,例子可以睇吓光合作用(涉及植物靠太陽光嚟進行一啲化學反應,產生維生用嘅營養)[73]。
- 無機化學(inorganic chemistry):針對無機化合物嘅研究。
- 有機化學(organic chemistry):針對有機化合物(簡單啲嚟講即係有碳嘅化合物)嘅研究;有機化合物對同生命相關嘅化學過程(睇生物化學)嚟講好重要。
- 生物化學(biochemistry):研究喺生物入面各種化學物質同化學反應之間嘅互動過程,例如係動物嘅消化系統會由食落肚嘅嘢食嗰度吸收各種嘅營養,並且攞呢啲營養嚟建造或者修補身體各部份,而呢啲過程已經會涉及好多化學反應[75]。生物化學、有機化學同醫學之間嘅關係十分之密切,而且生物化學好多時都會俾人同分子生物學同埋遺傳學一齊嚟研究。
- 藥物化學(medicinal chemistry):研究化學物質點樣用喺藥物入面,從而改變藥物嘅功效,達到醫療嘅作用;藥物化學其實係幾個化學子領域(包括有機化學、生物化學、物理化學同埋幾個唔屬於化學嘅科學領域)撈埋嘅結果。
- 石油化學(petrochemistry):研究石油同天然氣等化石燃料相關物質嘅特性。
- 高分子化學(polymer chemistry):研究啲好大粒嘅分子(大分子同聚合物等),例如發泡膠就係一種大分子。
- 地球科學相關:
- 綠色化學(green chemistry):研究點樣運用化學反應減低污染[78]。
... 等等。
應用
[編輯]中心科學
[編輯]喺學界,化學又有個花名叫「中心科學」(central science)。噉係因為化學呢門領域喺概念上處於好多個科學領域嘅「中間」[6][79]:
- 物理學(physics):化學同物理學有好密切嘅關係(可以睇物理化學);兩門領域都會研究物質,而物質包含咗宇宙入面大部份嘅「嘢」,地球、水(海嘅主要成份)同人體等嘅嘢都係物質,所以化學同物理學成日都俾人一齊列做現代自然科學之中最緊要嘅領域;喺現代科學上,原子仲有得拆做再細啲嘅粒子,好似係電子、質子同中子,而物理學上對呢啲嘢嘅研究好多時都會幫到化學家了解原子,不過因為化學反應都係以原子嚟做單位嘅-所以一般認為細粒過原子嘅嘢理應係物理學嘅範圍[80],而原子或者大粒過原子嘅嘢先至屬於化學嘅研究對象[81]。噉講意思即係話,化學某程度上係「建基於」物理學知識嘅-化學嘅研究對象係物理學研究嘅對象嘅一個子集,所以化學嘅研究對象冚唪唥都要受制於物理定律[註 1]。
- 生物學(biology):化學又係同生物學有好密切嘅關係(可以睇生物化學);生物學研究嘅係有生命嘅嘢(生物),包括細菌、植物同各種嘅動物(人都係種動物)呀噉,呢啲已知嘅生命全部都係由物質嘅組成嘅,所以都要受制於化學上嘅定律,例如有好多化學反應可以搞到一隻生物嘅身體某啲部份(例如皮膚)變做第啲物質,並且因而喪失原有嘅功能同埋引致隻生物受傷或者死亡;生物化學係生物學同化學嘅一個交叉領域,會用化學上嘅知識了解化學反應喺生命過程當中扮演嘅角色,例如係好出名嘅米勒-尤里實驗(Miller–Urey experiment)噉:
- 地球科學(包括地質學同海洋學等)研究地球嘅各部份,而地球本質上就係一大嚿物質,所以實要考慮到化學上嘅知識,例如係考慮土地同海入面有啲咩化學反應進行緊,以及係呢啲化學反應會點樣影響土地同海嘅環境(「唔同化合物嘅濃度」係一個重要嘅環境變數)[83]。
- 應用科學:應用科學基本上係「實會講到物質」咁滯,例如
- 工程學研究嘅係機械同建築物等嘅人造系統嘅設計,而呢啲系統基本上實係用物質嚟整嘅,所以又要考慮化學上嘅知識:簡單例子有考慮生鏽(一種化學反應)會點樣影響一部機械運作順唔順暢或者影響一棟建築物穩唔穩陣,同埋諗方法防止(或者起碼減慢)啲機械同建築物生鏽... 呀噉[84];
- 醫學同第啲醫療相關領域會講到人體同埋藥(可能會同人體入面嘅嘢起化學反應),而呢啲嘢都係物質,所以又係要用到化學:例如廿一世紀初嘅醫療成日會用到驗血技術,即係用化學方法檢驗病人啲血,睇吓病人啲血入面有邊啲化學物質同埋呢啲物質嘅濃度係咩;打前嘅醫療研究已知,有好多病都會搞到病人啲血裏面某啲化學物質濃度異常-所以驗血可以攞嚟幫手判斷病人患嘅係乜嘢病[85][86];
... 等等。下圖係有人畫嘅一幅圖,表示唔同科學學科之間嘅啦掕,「學科 A 有個箭咀指去學科 B」表示「B 嘅知識局部建基於 A」。由幅圖嗰度睇到,物理學有個箭咀指住化學,而化學又有箭咀指住好多個學科-化學身處喺好多個學科嘅中間。

化學工程
[編輯]化學工程(chemical engineering),簡稱化工,專門思考工程設計當中用到嘅化學反應,包括思考點樣生產有用嘅化合物[87]。工業上有好多重要嘅生產過程都涉及化學反應,簡單嘅例子有由一啲原材料嗰度做化學反應,整出想要嘅有用材料,淨係呢樣嘢經已可以大把嘢搞-有好多化學反應都係需要喺適當嘅溫度、壓力或者催化劑環境之下先至發生得到嘅,而且就算一場化學反應行到,場反應嘅反應率可能都會因為溫度等嘅條件唔啱而唔夠快,唔夠快就表示生產效率會唔夠高;因為噉,化學工程係一門相當專業化嘅領域,專職做化工嘅工程師要好熟識好多種反學化應嘅特性(需要乜環境條件先行到,仲有係啲反應喺乜情況之下行得最快... 呀噉),用呢啲知識嚟幫手設計相關嘅系統,係現代嘅經濟活動當中好重要嘅一部分[88]。
化工仲包括咗好幾門嘅子領域:
- 生化工程:研究涉及有機分子甚至生物嘅化工過程-例如嘢食嘅生產基本上實會用到有機分子(碳水化合物同蛋白質都係有機分子)[89];
- 化學反應工程:研究化學反應器嘅設計,以及諗係呢啲反應器嘅設計(例如做唔做到保持溫度恆定)會點影響生產效率等等[90];
- 石油工程:涉及研究石油同天然氣等嘅化石燃料相關嘅化學反應;
... 呀噉。
|
史
[編輯]
公元前
[編輯]人類自從好耐之前就有喺度研究物質(廣義上嘅化學):最早嘅物質研究要數人類對火嘅研究-喺文明誕生(公元前 10,000 年至公元前 5,000 年,睇用乜嘢嚟定義文明[91])之前,人仲未有乜嘢特化嘅架生嚟做化學實驗,但佢哋經已有能力觀察火將一種物質變成另一種物質,例如係將木燒到變成炭噉;打後文明起源之後,人有大規模噉用火嚟整鐵同埋玻璃(兩者嘅製作都會涉及加熱同物質變樣)等嘅材料,而呢啲材料對文明嘅演進嚟講不可或缺[92][93]。
公元前嘅哲學家仲有喺度思考有關物質嘅理論性問題,例如古典元素(classical elements)就係由古希臘嘅人諗出嚟嘅模型,主張宇宙萬物由地水火風四種元素組成(睇埋東亞嘅五行),呢種諗法經已俾現代化學否決,不過的確算係對物質嘅理論性研究[29]。除此之外,古希臘同古印度等嘅古文明都經已有原子論嘅諗法,不過佢哋冇乜方法嚟驗證原子論,所以原子論喺當時都仲係停留喺哲學諗法嘅階段[94]。
公元後
[編輯]煉金術(alchemy)可以話係化學嘅前身:喺公元前頭嗰兩個千年,人類開始廣泛噉用同開採金呢種貴金屬[註 8][95],令到人對金嘅需求勁升。於是就引起咗煉金術喺中世紀(5 至 15 世紀)嘅歐洲崛起-煉金術研究嘅係點樣將物質變成金,係一種原科學(protoscience;指未有完整嘅科學方法,但有啲似現代科學)。煉金術最後並冇取得成功-現代化學上已知,金係一種元素,靠一般地球環境下嘅方法係唔能夠將第種元素變做金嘅,但煉金術士嘅研究當中發明咗好多將一種物質變做第種物質嘅技術,為現代化學鋪咗路[96][97]。
一般認為,化學係喺 19 世紀誕生嘅。當時科學方法發展成熟,而且有咗好多對現代化學嚟講必要嘅科學知識:質量守恆嘅諗頭喺 18 世紀嘅科學家之間經已好普遍[註 9][98];道耳頓喺 19 世紀初做咗大量嘅實驗同觀察發現支持原子論嘅實驗結果[12];而後嚟基於呢啲知識同埋物理學上對原子嘅研究(可以睇吓量子力學),引致俄羅斯化學家門捷列夫(俄文:Дми́трий Ива́нович Менделе́ев;Dmitri Mendeleev)喺 19 世紀尾奠定咗元素週期表,成為現代化學嘅基礎。喺 1901 年,諾貝爾化學獎成立,終於認定化學係一門對人類貢獻重大嘅科學[96]。
詞源
[編輯]喺粵文入面,啲人一般都係用
英文字 chemistry 據講係由 alchemy(煉金術)嗰度嚟嘅,反映咗化學嘅歷史-到咗家吓,煉金術已經俾人知佢係冇料到嘅,但煉金術士所學到嘅知識(例如係點樣將一種物質變做第種物質)演化咗做現今嘅人所講嘅化學-用科學方法由原子層面嚟去研究物質嘅一門學問[99][100]。
註釋
[編輯]- ↑ 1.0 1.1 不過噉唔代表化學上嘅現象可以齋靠物理知識嚟解釋。可以睇吓創發同相關嘅概念。
- ↑ 現代科學已知,有啲粒子係冇固有質量嘅,例如係光子噉,光子喺唔郁嗰陣係冇質量嘅。
- ↑ 根據現代物理學研究,原子查實係有可能再揼散啲嘅,但用一般地球環境下做到嘅方法正路做唔到揼散原子。
- ↑ 要留意埋化合物同混合物之間嘅差異(睇下面)。
- ↑ 古希臘人嘅元素觀念係所謂嘅古典元素-地水火風四種。根據現代化學,元素遠遠唔只有四種,不過古希臘人喺「一切物質都係由某一柞元素嗰度砌出嚟嘅」呢點上的確啱。
- ↑ 現代科學經已表明咗煉金術係流嘅,不過煉金術研究者的確有做物質轉化(化學反應)方面嘅實驗。
- ↑ 假設質量守恆
- ↑ 打前嘅時代都有某一啲社會會用金。
- ↑ 不過,質量守恆定律要去到成 1873 年先至由法國化學家拉瓦錫正式噉奠定。
相關領域
[編輯]

睇埋
[編輯]文獻
[編輯]大眾讀物
[編輯]- Atkins, P.W. Galileo's Finger. (Oxford University Press), 2003.
- Atkins, P.W. Atkins' Molecules. (Cambridge University Press), 1967.
- Kean, S. The Disappearing Spoon - and other true tales from the Periodic Table. (Black Swan) London, 2010.
- Levi, P. The Periodic Table. (Penguin Books), [1975] translated from the Italian by Raymond Rosenthal (1984).
- Stwertka, A. A Guide to the Elements. (Oxford University Press), 1996.
- 朗文化學詞典,朗文(香港),1997。
本科教科書
[編輯]- Atkins, P.W., Overton, T., Rourke, J., Weller, M. & Armstrong, F. Shriver and Atkins inorganic chemistry, 4th Ed., Oxford University Press, 2006.
- Chang, R. Chemistry, 6th Ed., Boston: James M. Smith, 1998.
進階教科書
[編輯]- Atkins, P.W. Physical Chemistry. (Oxford University Press)
- Atkins, P.W. et al. Molecular Quantum Mechanics. (Oxford University Press)
- McWeeny, R. Coulson's Valence. (Oxford Science Publications)
- Pauling, L. The Nature of the chemical bond. (Cornell University Press)
- Pauling, L., & Wilson, E. B. Introduction to Quantum Mechanics with Applications to Chemistry. (Dover Publications)
- Smart & Moore Solid State Chemistry: An Introduction. (Chapman and Hall)
- Stephenson, G. Mathematical Methods for Science Students. (Longman)
攷
[編輯]- ↑ Gauch, H. G. (2003). Scientific method in practice. Cambridge University Press.
- ↑ 2.0 2.1 Brown, Theodore L.; LeMay, Jr., H. Eugene; Bursten, Bruce E.; Murphey, Catherine J.; Woodward, Patrick M.; Stoltzfus, Matthew W.; Lufaso, Michael W. (2018). "Introduction: Matter, energy, and measurement". Chemistry: The Central Science (14th ed.). New York: Pearson. pp. 46–85.
- ↑ "Chemistry Is Everywhere". American Chemical Society.
- ↑ Philosophy of Chemistry. Chemistry International.
- ↑ Metzler, David Everett; Metzler, Carol M. (2001). Biochemistry: The Chemical Reactions of Living Cells. 1. Academic Press.
- ↑ 6.0 6.1 6.2 6.3 Reinhardt, C. (2001). Chemical Sciences in the 20th Century: Bridging Boundaries, Pages 1–2. Wiley-VCH, ISBN 3-527-30271-9.
- ↑ Selected Classic Papers from the History of Chemistry.
- ↑ Godfrey-Smith 2003, Chapter 14: "Bayesianism and Modern Theories of Evidence".
- ↑ Brigandt, Ingo; Love, Alan (2017), "Reductionism in Biology", in Zalta, Edward N. (ed.), The Stanford Encyclopedia of Philosophy (Spring 2017 ed.), Metaphysics Research Lab, Stanford University.
- ↑ Dougherty, E.R. (2008). "On the Epistemological Crisis in Genomics". Current Genomics. 9 (2): 69–79.
- ↑ Armstrong, J. (2012). General, Organic, and Biochemistry: An Applied Approach. Brooks/Cole. p. 48. ISBN 978-0-534-49349-3.
- ↑ 12.0 12.1 12.2 How Did We Figure Out Atoms Exist?. Space.com.
- ↑ Waldman, J. (2015): Rust - the longest war. Simon & Schuster, New York.
- ↑ John Dalton and Atomic Theory.
- ↑ 15.0 15.1 15.2 Theodore L. Brown, H. Eugene Lemay, Bruce Edward Bursten, H. Lemay. (1999). Chemistry: The Central Science. Prentice Hall; 8th Ed.
- ↑ Ragland, K. W., Aerts, D. J., & Baker, A. J. (1991). Properties of wood for combustion analysis. Bioresource technology, 37(2), 161-168.
- ↑ Yaws, C. L. (1997). Physical properties. In Handbook of Chemical Compound Data for Process Safety (pp. 1-26). Gulf Professional Publishing.
- ↑ Buchachenko, A. L., & Frankevich, E. L. (1993). Chemical generation and reception of radio-and microwaves. John Wiley & Sons.
- ↑ Hollas, J. M. (2004). Modern spectroscopy. John Wiley & Sons.
- ↑ 20.0 20.1 Burrows, A., Holman, J.; Parsons, An.; Pilling, G.; Price, G. (2009). Chemistry3. Italy: Oxford University Press.
- ↑ Housecroft, Catherine E.; Sharpe, Alan G. (2008) [2001]. Inorganic Chemistry. 3rd Ed. Harlow, Essex: Pearson Education.
- ↑ 22.0 22.1 Plücker, M. (1858-12-01). "XLVI. Observations on the electrical discharge through rarefied gases". The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 16 (109): 408–418.
- ↑ Leicester, H.M. (1971). The Historical Background of Chemistry. Courier Dover. pp. 221-222.
- ↑ Electron. Encyclopedia Britannica.
- ↑ O'Hara, J. G. (March 1975). "George Johnstone Stoney, F.R.S., and the Concept of the Electron". Notes and Records of the Royal Society of London. Royal Society. 29 (2): 265-276.
- ↑ Wien, Wilhelm (1904). "Über positive Elektronen und die Existenz hoher Atomgewichte". Annalen der Physik. 318 (4): 669–677.
- ↑ Petrucci, R. H.; Harwood, W. S.; Herring, F. G. (2002). General Chemistry (8th ed.). Upper Saddle River, N.J. : Prentice Hall. p. 41.
- ↑ Discovery of the Neutron.
- ↑ 29.0 29.1 Partington, J. R. (1937). A Short History of Chemistry. New York: Dover Publications.
- ↑ Lavoisier, A. L. (1790). Elements of chemistry translated by Robert Kerr. Edinburgh. pp. 175-6.
- ↑ Boyle, R. (1661). The Sceptical Chymist. London.
- ↑ Croswell, K. (1996). Alchemy of the Heavens. Anchor.
- ↑ Carey, G.W. (1914). The Chemistry of Human Life. Los Angeles.
- ↑ Hale, Bob (2013-09-19). Necessary Beings: An Essay on Ontology, Modality, and the Relations Between Them. OUP Oxford.
- ↑ Soddy, Frederick (12 December 1922). "The origins of the conceptions of isotopes" (PDF). Nobelprize.org. p. 393.
- ↑ Mazurs, E. G. (1974). Graphical Representations of the Periodic System During One Hundred Years. Alabama: University of Alabama Press.
- ↑ Van Spronsen, J. W. (1969). The Periodic System of Chemical Elements: A History of the First Hundred Years. Amsterdam: Elsevier.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd Ed. (the "Gold Book") (1997). Online corrected version: (2006–) "chemical reaction".
- ↑ Trummal, Aleksander; Lipping, Lauri; Kaljurand, Ivari; Koppel, Ilmar A.; Leito, Ivo (2016-05-06). "Acidity of Strong Acids in Water and Dimethyl Sulfoxide". The Journal of Physical Chemistry A. 120 (20): 3663–3669.
- ↑ Crosland, M.P. (1959). "The use of diagrams as chemical 'equations' in the lectures of William Cullen and Joseph Black". Annals of Science. 15 (2): 75–90.
- ↑ "Chemical Reaction Equation- IUPAC Goldbook". 原著喺2017年10月27號歸檔. 喺2017年11月4號搵到.〈存档副本〉。歸檔時間2017年10月27號。喺2017年11月4號搵到。
{{cite web}}: CS1 maint: bot: original URL status unknown (link) - ↑ Schmidt-Rohr, Klaus (2015). "Why Combustions Are Always Exothermic, Yielding About 418 kJ per Mole of O2". Journal of Chemical Education. 92 (12): 2094-2099.
- ↑ Standard Enthalpy of Formation and Reaction.
- ↑ 44.0 44.1 IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006-) "Rate of reaction".
- ↑ Frank, P., & Just, T. (1985). High temperature reaction rate for H+ O2= OH+ O and OH+ H2= H2O+ H. Berichte der Bunsengesellschaft für physikalische Chemie, 89(2), 181-187.
- ↑ Gunn, D. J., & Thomas, W. J. (1965). Mass transport and chemical reaction in multifunctional catalyst systems. Chemical Engineering Science, 20(2), 89-100.
- ↑ Deswal, K., & Chohan, I. S. (1981). Effects of hyperthermia on enzymes and electrolytes in blood and cerebrospinal fluid in dogs. International journal of biometeorology, 25(3), 227-233.
- ↑ 48.0 48.1 Pauling, L. (1931), "The nature of the chemical bond. Application of results obtained from the quantum mechanics and from a theory of paramagnetic susceptibility to the structure of molecules", Journal of the American Chemical Society, 53 (4): 1367-1400.
- ↑ March, Jerry (1992). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure. John Wiley & Sons.
- ↑ Leigh, G. J.; Favre, H. A; Metanomski, W. V. (1998). Principles of chemical nomenclature: a guide to IUPAC recommendations. Oxford: Blackwell Science.
- ↑ Spencer L. Seager, Michael R. Slabaugh. Chemistry for Today: general, organic, and biochemistry. Thomson Brooks/Cole, 2004, p. 342.
- ↑ Water, the Universal Solvent.
- ↑ Newman, D. K.; Banfield, J. F. (2002). "Geomicrobiology: How Molecular-Scale Interactions Underpin Biogeochemical Systems". Science. 296 (5570): 1071-1077.
- ↑ Fabbri, Emiliana; Schmidt, Thomas J. (5 October 2018). "Oxygen Evolution Reaction—The Enigma in Water Electrolysis". ACS Catalysis. 8 (10): 9765–9774.
- ↑ M. M. Avedesian; Hugh Baker. Magnesium and Magnesium Alloys. ASM International. p. 59.
- ↑ Ashworth, William; Littl1, Charles E., eds. (2001). "Mixture". The Encyclopedia of Environmental Studies. Online publisher:Science Online. Facts on File, Inc.
- ↑ Allchin, F. R. (1979). "India: The Ancient Home of Distillation?". Man. 14 (1): 55–63.
- ↑ Harwood, Laurence M.; Moody, Christopher J. (1 January 1990). Experimental Organic Chemistry: Principles and Practice (Illustrated ed.). Blackwell Scientific Publications.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd Ed. (the "Gold Book") (1997). Online corrected version: (2006–) "Molecule".
- ↑ University of Colorado Boulder (November 21, 2013). "Atoms and Elements, Isotopes and Ions 互聯網檔案館嘅歸檔,歸檔日期2021年5月13號,.". colorado.edu.
- ↑ Volkenstein, Mikhail V. (2009). Entropy and Information (illustrated ed.). Springer Science & Business Media. p. 20.
- ↑ Richard Feynman (1970). The Feynman Lectures on Physics Vol I. Addison Wesley.
- ↑ "What is Chemistry?". Chemweb.ucc.ie. 原著喺2018年10月3號歸檔. 喺2017年11月2號搵到.
- ↑ Chemistry. (n.d.). Merriam-Webster's Medical Dictionary. Retrieved August 19, 2007.
- ↑ Pullman, Bernard; Pullman, Alberte (1963). Quantum Biochemistry. New York and London: Academic Press.
- ↑ Cramer, C. J. (2013). Essentials of computational chemistry: theories and models. John Wiley & Sons.
- ↑ Wang, Joseph C. (2000). Analytical electrochemistry. Chichester: John Wiley & Sons.
- ↑ Philip R. Bunker and Per Jensen, Molecular Symmetry and Spectroscopy, NRC Research Press, Ottawa, (1998).
- ↑ Laidler, Keith (1993). The World of Physical Chemistry. Oxford: Oxford University Press.
- ↑ Badwal, Sukhvinder P. S.; Giddey, Sarbjit S.; Munnings, Christopher; Bhatt, Anand I.; Hollenkamp, Anthony F. (24 September 2014). "Emerging electrochemical energy conversion and storage technologies (open access)". Frontiers in Chemistry. 2: 79.
- ↑ Moskovits, M., and Ozin, G.A., (1976). Cryochemistry, J. Wiley & Sons, New York.
- ↑ Suslick, K. S. (1990). "Sonochemistry". Science. 247 (4949): 1439–45.
- ↑ Glusac, Ksenija (2016). "What has light ever done for chemistry?". Nature Chemistry. 8 (8): 734–735.
- ↑ Ashby, Michael; Hugh Shercliff; David Cebon (2007). Materials: engineering, science, processing and design (1st ed.). Butterworth-Heinemann.
- ↑ "What is biochemistry?". 原著喺2017年11月12號歸檔. 喺2017年11月4號搵到. 〈存档副本〉。原著喺2017年11月12號歸檔。喺2017年11月4號搵到。
- ↑ Brasseur, Guy P.; Orlando, John J.; Tyndall, Geoffrey S. (1999). Atmospheric Chemistry and Global Change. Oxford University Press.
- ↑ Coble, Paula G. (2007). "Marine Optical Biogeochemistry: The Chemistry of Ocean Color". Chemical Reviews. 107 (2): 402–418.
- ↑ Clark, J. H.; Luque, R.; Matharu, A. S. (2012). "Green Chemistry, Biofuels, and Biorefinery". Annual Review of Chemical and Biomolecular Engineering. 3: 183-207.
- ↑ Brown, T. L., LeMay, H. E., Bursten, B. E., & Brunauer, L. S. (1994). Chemistry: the central science (Vol. 8, pp. 3-4). Englewood Cliffs, NJ: Prentice Hall.
- ↑ American Physical Society.
- ↑ Coughlan, G.D., J.E. Dodd, and B.M. Gripaios (2006). The Ideas of Particle Physics: An Introduction for Scientists, 3rd ed. Cambridge Univ. Press.
- ↑ Habitability and Biology - page 5 The Miller-Urey Experiment 互聯網檔案館嘅歸檔,歸檔日期2014年4月17號,..
- ↑ Albarède, Francis (2007). Geochemistry : an introduction. Translated from the French. (5th ed.). Cambridge: Cambridge Univ. Press.
- ↑ Sharma, V., & Thind, T. (2013). Techniques for detection of rusting of metals using image processing: A survey. International Journal of Emerging Science and Engineering, 1, 60-62.
- ↑ MacLennan CA, van Oosterhout JJ, White SA, Drayson MT, Zijlstra EE, Molyneux ME (July 2007). "Finger-prick blood samples can be used interchangeably with venous samples for CD4 cell counting indicating their potential for use in CD4 rapid tests". AIDS. 21 (12): 1643-5.
- ↑ Lesser, Finnian D; Lanham, David A; Davis, Daniel (6 May 2020). "Blood sampled from existing peripheral IV cannulae yields results equivalent to venepuncture: a systematic review". JRSM Open. 11 (5): 205427041989481.
- ↑ "Top 50 Chemical Producers 互聯網檔案館嘅歸檔,歸檔日期2016年2月1號,.". Chemical & Engineering News 83 (29): 20–23. July 18, 2005.
- ↑ Coulson, J. M. (2001). Chemical engineering. Butterworth-Heinemann.
- ↑ Bailey, J. E., & Ollis, D. F. (2018). Biochemical engineering fundamentals. McGraw-Hill.
- ↑ Levenspiel, O. (1998). Chemical reaction engineering. John wiley & sons.
- ↑ Haviland, William; et al. (2013). Cultural Anthropology: The Human Challenge. Cengage Learning. p. 250.
- ↑ Jane C. Waldbaum, From Bronze to Iron: The Transition from the Bronze Age to the Iron Age in the Eastern Mediterranean (Studies in Mediterranean Archaeology, vol. LIV, 1978).
- ↑ McCray, W. Patrick (2007) Prehistory and history of glassmaking technology, American Ceramic Society.
- ↑ Kenny, Anthony (2004). Ancient Philosophy. A New History of Western Philosophy. 1. Oxford, England: Oxford University Press. pp. 26-28.
- ↑ Pohl, Walter L. (2011) Economic Geology Principles and Practice. Wiley. p. 208.
- ↑ 96.0 96.1 Chang, Raymond (1998). Chemistry, 6th Ed. New York: McGraw Hill.
- ↑ Jennifer M. Rampling (2020). The Experimental Fire: Inventing English Alchemy, 1300-1700. University of Chicago Press.
- ↑ Pomper, Philip (October 1962). "Lomonosov and the Discovery of the Law of the Conservation of Matter in Chemical Transformations". Ambix. 10 (3): 119–127.
- ↑ "History of Alchemy from Ancient Egypt to Modern Times". 原著喺2017年8月27號歸檔. 喺2017年10月29號搵到.〈存档副本〉。歸檔時間2011年6月8號。喺2020年2月4號搵到。
{{cite web}}: CS1 maint: bot: original URL status unknown (link) - ↑ Online Etymology Dictionary - Chemistry
- ↑ Berke, Heinz (2007). "The invention of blue and purple pigments in ancient times". Chemical Society Reviews. 36: 15-30.





























![{\displaystyle v=-{\frac {1}{a}}{\frac {d[\mathrm {A} ]}{dt}}=-{\frac {1}{b}}{\frac {d[\mathrm {B} ]}{dt}}={\frac {1}{p}}{\frac {d[\mathrm {P} ]}{dt}}={\frac {1}{q}}{\frac {d[\mathrm {Q} ]}{dt}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/50da96de2d35c863851f25312562e89d3a9b9385)
![{\displaystyle {\frac {d[\mathrm {A} ]}{dt}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2550a6cc5dd3eeee103a5c82ec86401427c14fa0)














