σ鍵
外观
此條目需要补充更多来源。 (2011年4月22日) |
此條目需要精通或熟悉化学的编者参与及协助编辑。 |

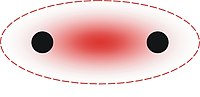
σ键(西格马键)是价键理论和分子轨道理论中一种化学键的名称。由两个相同或不相同的原子轨道沿轨道对称轴方向相互重叠而形成的共价键,叫做σ键。一般“单键”属于σ键,比如C-H, O-H, N-H, C-C, C-Cl等。
σ键是原子轨道沿轴方向重叠而形成的,具有较大的重叠程度,因此σ键比较稳定。σ键是能围绕对称轴旋转,而不影响键的强度以及键跟键之间的角度(键角)。根据分子轨道理论,两个原子轨道充分接近后,能通过原子轨道的线性组合,形成两个分子轨道。其中,能量低于原来原子轨道的分子轨道叫成键轨道,能量高于原来原子轨道的分子轨道叫反键轨道。以核间轴为对称轴的成键轨道叫σ轨道,相应的键叫σ键。以核间轴为对称轴的反键轨道叫σ*轨道,相应的键叫σ*键。分子在基态时,构成化学键的电子通常处在成键轨道中,而让反键轨道空着。
- σ键有方向性,两个成键原子必须沿着对称轴方向接近,才能达到最大重叠。
- 成键电子云沿键轴对称分布,两端的原子可以沿轴自由旋转而不改变电子云密度的分布。
- σ键是头碰头的重叠,与其它键相比,重叠程度大,键能大,因此,化学性质稳定。
共价单键是σ键,共价双键有一个σ键,π键,共价三键由一个σ键,两个π键组成。
参见
[编辑]
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 这是一篇與化学相關的小作品。您可以通过编辑或修订扩充其内容。 |