Chlorure de soufre
| Chlorure de soufre | |||

| |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | dichlorure de disoufre | ||
| No CAS | |||
| No ECHA | 100.030.021 | ||
| No CE | 233-036-2 | ||
| Apparence | liquide fumant, huileux, ambre à rouge, d'odeur âcre[1] | ||
| Propriétés chimiques | |||
| Formule | S2Cl2 | ||
| Masse molaire[2] | 135,036 ± 0,014 g/mol Cl 52,51 %, S 47,49 %, |
||
| Propriétés physiques | |||
| T° fusion | −77 °C[1] | ||
| T° ébullition | 138 °C[1] | ||
| Solubilité | dans l'eau : réaction[1] | ||
| Masse volumique | 1,7 g·cm-3[1] | ||
| T° d'auto-inflammation | 234 °C[1] | ||
| Point d’éclair | 118 °C (coupelle fermée)[1] | ||
| Pression de vapeur saturante | à 20 °C : 0,90 kPa[1] | ||
| Précautions | |||
| SGH[3] | |||
| H301, H314, H332, H400, EUH014 et EUH029 |
|||
| SIMDUT[4] | |||
  D1B, E, |
|||
| NFPA 704 | |||
| Transport | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
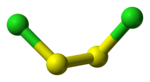
Le dichlorure de disoufre a pour formule S2Cl2. Il est aussi appelé (mono)chlorure de soufre, nom issu de sa formule empirique SCl. S2Cl2 a une structure pliée dans laquelle l'angle entre les plans Cla-S-S et S-S-Clb est d'environ 90°. Cette structure est gauche et est comparable à celle du peroxyde d'hydrogène H2O2. L'isomère de S2Cl2, S=SCl2, apparaît brièvement lors de l'exposition de S2Cl2 aux UV.
Synthèse
[modifier | modifier le code]S2Cl2 se forme par chloration ménagée du soufre :
- S8 + 4 Cl2 → 4 S2Cl2 ΔH = −58,2 kJ/mol
- S2Cl2 + Cl2 → 2 SCl2 ΔH = −40,6 kJ/mol
Comme indiqué ci-dessus, un excès de Cl2 convertit S2Cl2 en SCl2. Ces deux réactions sont réversibles. S2Cl2 est un sous-produit de la chloration du disulfure de carbone dans la synthèse du thiophosgène.
Propriétés
[modifier | modifier le code]Le chlorure de soufre est incolore à l'état pur mais les échantillons impurs sont souvent jaunes. Il se décompose en émettant de la fumée dans l'air humide à cause d'une réaction avec l'eau :
- 2 S2Cl2 + 2 H2O → SO2 + 4 HCl + 3/8 S8
Applications en synthèse
[modifier | modifier le code]S2Cl2 a été utilisé pour introduire des liaisons C-S. En présence de chlorure d'aluminium, S2Cl2 réagit avec le benzène pour donner le disulfure de diphényle :
- S2Cl2 + 2 C6H6 → (C6H5)2S + 2 HCl + 18 S8
Les anilines réagissent avec S2Cl2 en présence de NaOH pour donner des ortho-aminothiophénolates suivant la réaction de Herz, précurseur des colorants thioindigotiques. On s'en sert aussi pour préparer le gaz moutarde en le faisant réagir avec l'éthylène :
- S2Cl2 + 2 C2H4 → (ClC2H4)2S + 18 S8
Utilisation
[modifier | modifier le code]Le chlorure de soufre entre dans la composition d'additifs destinés à des lubrifiants soumis à de fortes pressions. Il est aussi employé pour vulcaniser le caoutchouc. On le retrouve également dans les insecticides ainsi que l'industrie pharmaceutique.
Références
[modifier | modifier le code]- MONOCHLORURE DE SOUFRE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 (16 décembre 2008)
- « Chlorure de soufre » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
Voir aussi
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]- (en) Holleman, A.F. ; Wiberg, E., Inorganic Chemistry, Academic Press, San Diego, 2001 (ISBN 0-12-352651-5).
- (en) W.W. Hartman, L.A. Smith et J.B. Dickey, Diphenylsulfide, Organic Syntheses, Coll. vol. 2, p. 242 ; vol. 14, p. 36.
- (en) R.J. Cremlyn, An Introduction to Organosulfur Chemistry, John Wiley & Sons, Chichester, 1996 (ISBN 0-471-95512-4).
- (en) Garcia-Valverde M., Torroba T., « Heterocyclic chemistry of sulfur chlorides - Fast ways to complex heterocycles », European J. Org. Chem., vol. 4, , p. 849-861.