Cortisol
Esta página ou se(c)ção precisa ser formatada para o padrão wiki. (Dezembro de 2020) |
Esta página ou seção foi marcada para revisão devido a incoerências ou dados de confiabilidade duvidosa. (Dezembro de 2020) |
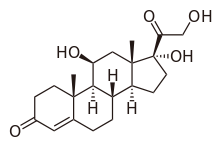
| |

| |
| Nome IUPAC (sistemática) | |
| 11,17,21-trihydroxy-,(11beta)- pregn-4-ene-3,20-dione | |
| Identificadores | |
| CAS | 50-23-7 |
| ATC | H02AB09 (and others) |
| PubChem | 5754 |
| Informação química | |
| Fórmula molecular | C21H30O5 |
| Massa molar | 362,465 |
| Farmacocinética | |
| Biodisponibilidade | ? |
| Metabolismo | ? |
| Meia-vida | ? |
| Excreção | ? |
| Considerações terapêuticas | |
| Administração | Oral, intravenosa, tópica |
| DL50 | ? |
O cortisol é uma hormona corticosteroide da família dos esteroides, produzido pela parte superior da glândula suprarrenal (no córtex suprarrenal, porção fasciculada ou média) diretamente envolvido na resposta ao estresse. Sua forma sintética, chamada de hidrocortisona, é um anti-inflamatório usado principalmente no combate às alergias, a artrite reumatoide e alguns tipos de cancro. O nome cortisol, deriva de córtex.
Tem três ações primárias: estimula a quebra de 1) proteínas, 2) gorduras e 3) providencia a metabolização da glicose no fígado. Considerado o hormônio do stress, ativa respostas do corpo ante situações de emergência para ajudar a resposta física aos problemas, aumentando a pressão arterial e o açúcar no sangue, propiciando energia muscular. Ao mesmo tempo todas as funções anabólicas de recuperação, renovação e criação de tecidos são paralisadas e o organismo se concentra na sua função catabólica para a obtenção de energia. Uma vez que o stress é pontual, superada a questão, os níveis hormonais e o processo fisiológico voltam à normalidade, mas quando este se prolonga, os níveis de cortisol no organismo disparam.
Síntese
[editar | editar código-fonte]A conversão envolve a hidroxilação dos C-11, C-17 e C-21. A síntese ocorre na zona fasciculata do córtex adrenal. O cortisol é a principal secreção do córtex adrenal, embora ele também produza aldosterona na zona glomerulosa e hormônios sexuais na zona reticulosa. O nome cortisol, deriva de córtex.
Na síntese do cortisol a glândula adrenal é estimulada pelo lóbulo anterior da hipófise através do hormônio adrenocorticotrófico (ACTH). A produção do ACTH é modulada pelo hipotálamo, através da secreção por parte deste do hormônio liberador de corticotrofina (CRH).
Entretanto, dependendo do tipo do material produzido nos salivettes os resultados poderão mascarar o nível basal.
A secreção de cortisol se dá a partir de um estímulo estressante (atividade física ou contusão em alguma parte do corpo), que transmite impulsos nervosos ao hipotálamo. Este, por sua vez, libera o fator liberador de corticotropina (CTH), que chega a hipófise, cujas células secretam hormônio adrenocorticotrópico (ACTH) que flui pelo sangue até o córtex supra-renal onde será produzido o cortisol.[1]
O cortisol, como qualquer esteroide, atravessa as membranas celulares e actua num receptor glicocorticoide, presente no núcleo e citoplasma. Este receptor recebe a designação de receptor de glicocorticoides do tipo II, pertence à superfamília dos receptores de esteroides, retinoides e hormônios tiroidianos. Surge em praticamente todos os tecidos, mas a sua concentração varia com o tipo celular e com o grau de diferenciação da célula.
O cortisol combina-se com o receptor de forma não covalente, alterando a sua estrutura; o complexo gerado liga-se ao elemento regulador dos glicocorticoides induzindo ou reprimindo a transcrição génica. A resposta genética é variável de célula para célula.
O receptor de glicocorticoides pode ligar outros esteroides e o elemento regulador dos glicocorticoides pode ligar, de igual modo, complexos hormona-receptor distintos, mas estes não desencadeiam resposta génica.
Os glicocorticoides provocam uma infrarregulação do próprio receptor.
O receptor de mineralocorticoides, recebe, muitas vezes, a designação de receptor do tipo I dos glicocorticoides; a designação justifica-se porque liga glicocorticoides com uma afinidade dez vezes maior que o respectivo receptor do tipo II, contudo, é um receptor de mineralocorticoides e fixa, sobretudo, mineralocorticoides.
Para concentrações basais reduzidas de glicocorticoide o receptor de mineralocorticoides medeia algumas das acções do cortisol.
É natural que outros mecanismos intracelulares sejam afectados pelo cortisol; apesar de não alterar os níveis de AMPc parece haver uma sinergia com este sistema, muitas das suas acções são mimetizadas por elevação dos níveis de AMPc. O cortisol pode alterar os níveis de GMPc e os fosfolipídidos da membrana.
Funções no metabolismo
[editar | editar código-fonte]O hormônio cortisol é conhecido pela sua função catabólica, no equilíbrio eletrolítico e no metabolismo de carboidratos, proteínas e lipídeos, além de possuir um potente efeito anti-inflamatório.[1]
A atuação do cortisol no organismo é antagônica à insulina, por conseguinte sendo análoga à do glucagon.
O cortisol é essencial à vida. Por muito que se faça terapeuticamente, substituindo as suas funções, a sobrevida humana após adrenalectomia é breve e tem três destinos após a celagem rins e esôfago.
O cortisol tem um claro domínio, em relação à corticosterona, na sua acção glicocorticoide, intervindo de forma marcada em quase todos os aspectos do metabolismo com um efeito global catabólico, ou antianabólico.
Não obstante, a sua acção é muitas vezes descrita como permissiva porque actua principalmente, permitindo que os processos ocorram e não iniciando-os, por exemplo, amplifica o efeito de outras hormonas em processos que não afecta substancialmente, de forma directa e isoladamente. Por exemplo, em vários passos enzimáticos aumenta os efeitos ou interactua sinergisticamente com a glicagina.
Alguns dos efeitos do cortisol, como a inibição da secreção de ACTH, são rápidos, manifestando-se em poucos minutos; mas a generalidade dos seus efeitos precisa de horas ou dias.
A acção mais importante é facilitar a conversão das proteínas em glicogénio; o cortisol acentua a degradação e inibe a síntese proteica, mobiliza sobretudo proteínas musculares, disponibilizando aminoácidos para a gliconeogénese. Exceptuando os aminoácidos que participam na neoglicogénese, como a alanina, aumentam os níveis plasmáticos de aminoácidos.
Várias enzimas da gliconeogénese são induzidas, sendo também activados mecanismos de depuração de derivados nitrogenados libertados dos aminoácidos.
Este tipo de resposta, numa intensidade normal, tem benefícios fisiológicos, mas os excessos prolongados de glicocorticoides acabam por depauperar as reservas proteicas corporais, particularmente no músculo, osso e conjuntivo. O efeito é independente do nível de ingestão alimentar, porque os processos de síntese estão inibidos.
Os glicocorticoides são fulcrais para a sobrevivência do ser humano em períodos de jejum e fome; sem eles não seria mobilizada a reserva lipídica e proteica. Contudo, nestes períodos, a sua secreção sofre aumentos muito ligeiros e a exposição a níveis normais consegue mobilizar a reserva aminoacídica.
Um papel semelhante é desempenhado na protecção contra as hipoglicemias associadas à insulina. Se as acções da glicagina e adrenalina são responsáveis primários pela recuperação dos níveis de glicemia, o cortisol, cria grandes reservas de aminoácidos, e, na fase final de recuperação da hipoglicemia, é responsável pela diminuição do consumo de glicose e aumento da sua produção. Adicionalmente, o cortisol também estimula a libertação de glicagina e, quando em concentração considerável, eleva os níveis plasmáticos de glicose, antagonizando as acções da insulina, por oposição de vias intracelulares.
Apesar de ter uma acção lipolítica fraca isoladamente, o cortisol é essencial para que a adrenalina, a hormona de crescimento e peptídeos lipolíticos provoquem uma estimulação máxima da lipólise. Esta acção é complementar à exercida no metabolismo proteico, na resposta ao jejum. Contudo, a acção no metabolismo lipídico é bem mais complexa, porque também aumenta o apetite e a ingestão calórica, é estimulada a lipogénese e a diferenciação de adipócitos em zonas corporais particulares (Adiposidade central, com distribuição da massa gorda pelo abdómen, tronco e face - aspecto Cushingóide - nos hipercortisolismos).
Então, o cortisol é hiperglicemiante e aumenta a resistência à acção da insulina (é diabetogénico), mas os efeitos hiperglicemiantes, lipolíticos e cetogénicos só são manifestos quando a sua secreção está aumentada, por situações de stress marcado e prolongado. Nestas situações, tem também marcadas acções catabólicas com depauperação da massa muscular.
Efeitos no tecido muscular
[editar | editar código-fonte]A acção muscular é ambígua, contribui para o catabolismo e perda muscular, mas, simultaneamente, na ausência da hormona a contractilidade dos músculos esquelético e cardíaco é reduzida.
Este efeito pode dever-se à indução da síntese de mediadores ou receptores como a acetilcolina e os receptores b-adrenérgicos, respectivamente. É exercido de forma constitucional, permanentemente, por concentrações basais de corticoides. O catabolismo e perda musculares verificar-se-ão para níveis mais elevados de corticosteroides.
Efeitos no tecido ósseo
[editar | editar código-fonte]O cortisol inibe a formação de novas estruturas ósseas, por redução da síntese de colagénio do tipo I ( componente fundamental da matriz óssea ), redução da velocidade de diferenciação de células osteoprogenitoras em osteoblastos activos, diminuição da absorção de Ca2+ a partir do tracto gastrointestinal (por antagonismo da vitamina D3), e, finalmente, por aumento da velocidade de reabsorção óssea.
Efeitos no tecido conjuntivo
[editar | editar código-fonte]No tecido conjuntivo, a inibição da síntese colagénica produz adelgaçamento cutâneo e das paredes vasculares, podendo provocar pequenas hemorragias cutâneas.
Efeitos no sistema vascular
[editar | editar código-fonte]No sistema vascular, o cortisol é essencial à reactividade arteriolar às catecolaminas e reduz a produção de prostaglandinas, de acção vasodilatadora; no global, ajuda a manter a pressão arterial porque diminui a permeabilidade vascular endotelial, evita perdas de volume circulante.
Efeitos nos rins
[editar | editar código-fonte]No rim, o cortisol aumenta a taxa de filtração glomerular, por diminuição da resistência pré-glomerular e aumento do fluxo sanguíneo; diminui a secreção da hormona antidiurética e a sua acção nos túbulos renais. O cortisol é necessário para a formação de amónia a partir do glutamato nas situações de acidose e aumenta a excreção de fosfatos, por diminuição da sua reabsorção nos túbulos proximais e distais.
Efeitos no sistema nervoso central
[editar | editar código-fonte]No sistema nervoso central (SNC) há múltiplos receptores, quer do tipo I quer do tipo II; o cortisol altera os padrões do sono. Em geral, os glicocorticoides atenuam a acuidade dos sentidos, olfativo, gustativo, auditivo e visual; contudo, melhoram a capacidade integrativa e geradora de respostas apropriadas. Em excesso, o cortisol pode provocar insónias e elevar ou deprimir, marcadamente, o humor; baixa também o limiar para a ocorrência de convulsões.
Efeitos no feto
[editar | editar código-fonte]No feto, o cortisol favorece a maturação do SNC, retina, pele, tracto gastrointestinal e pulmões. O cortisol auxilia a diferenciação da mucosa intestinal do fenótipo fetal para o fenótipo adulto, o que permite à criança usar dissacarídeos presentes no leite materno. No pulmão passa-se algo semelhante, a velocidade de desenvolvimento alveolar e do epitélio respiratório é acentuada pelo cortisol; e, mais importante, nas últimas semanas de gestação os glicocorticoides aumentam a síntese de surfactante (sendo usados para induzir a maturidade pulmonar em RN prematuros).
A acção nas respostas imunitária e inflamatória é complexa; as reacções de vasodilatação endotelial e aprisionamento de leucócitos circulantes (por acção de prostaglandinas, tromboxanos e leucotrienos) são inibidas por indução da lipocortina, uma fosfoproteína que inibe a actividade da fosfolípase A2. Para além deste efeito, os glicocorticoides também são responsáveis por uma estabilização da membrana lisossómica, reduzindo a libertação local de enzimas proteolíticas e hialuronidase.
Efeitos no sistema imunológico
[editar | editar código-fonte]O cortisol reduz a mobilização de leucócitos circulantes por inibição da produção, e ligação, de moléculas de adesão aos receptores; diminui a actividade fagocitária e bactericida dos neutrófilos, embora aumente a fracção destas células em circulação, por estimulação da sua libertação a partir da medula óssea.
O cortisol diminui o número de linfócitos circulantes, particularmente os T auxiliares, envolvidos na resposta a substâncias estranhas, e diminui, igualmente, a sua função. Toda a imunidade mediada por células está deprimida. O mecanismo de depressão desta resposta é complexo mas inclui uma redução na produção de mediadores intercelulares que activam o sistema imunitário e o bloqueio da progressão no ciclo celular das células envolvidas.
Há uma variação diária na capacidade de reacção imunitária, que é a recíproca da secreção de cortisol, visto que o cortisol deprime a resposta imunitária. Por outro lado, vários produtos imunitários, entre os quais a interleucina-1, estimulam a secreção do ACTH, constituindo um complexo sistema de "feedback" negativo.
A acção anti-inflamatória também inclui a supressão da resposta febril, por diminuição da produção de IL-1 (pirogénio endógeno).
Problemas associados a níveis elevados de cortisol
[editar | editar código-fonte]
Se a actividade metabólica e anti-inflamatória do cortisol são essenciais para a sobrevivência do doente traumatizado ou infectado, também é verdadeiro que altas doses e administração prolongada aumentam a predisposição à infecção, facilitam a sua disseminação e dificultam a cicatrização. Os androgénios suprarrenais têm fraca actividade; a sua actividade biológica depende da conversão em testosterona, nos tecidos periféricos.
Nas mulheres a sua actividade biológica é a manutenção da pilosidade púbica e axilar e estimular a eritropoiese. Nos homens, a testosterona produzida por esta via tem um significado muito reduzido, relativamente à que é produzida a nível testicular.
Fatores que afetam a concentração de cortisol no sangue
[editar | editar código-fonte]- Horário: A concentração de cortisol se altera durante as horas do dia, apresentando seu pico pelas primeiras horas da manhã. Logo ao despertar seus níveis vão declinando progressivamente ao longo do dia, ficando bastante baixos durante a noite.[1]
- Exercício físico: As concentrações de cortisol também aumentam durante o exercício, de maneira a aumentar o metabolismo proteico, liberando aminoácidos para serem utilizados pelo fígado no processo da gliconeogênese. Esse aumento do cortisol ocorre por estímulo do eixo hipotálamo-pituitária-adrenal (HPA).[2]
O cortisol é secretado pela glândula adrenal ou suprarrenal, que está localizado acima dos rins, para que ocorra essa secreção é necessário estímulos que iniciam no hipotálamo, transmitindo sinal para a Hipófise, gerando a secreção na glândula Adrenal, formando assim o eixo HHA, Hipotálamo-Hipófise-Adrenal. (Luis Henrique S. Dias; 2019).
A quantidade de cortisol presente no sangue sofre variação nas várias fases do dia (ritmo circadiano), com os níveis mais altos pela manhã e os níveis mais baixos à noite, várias horas após o início do sono. Informações sobre o ciclo luz/escuridão são transmitidas da retina para os núcleos supraquiasmáticos no hipotálamo. Mudanças no padrão de secreção de cortisol foram observadas associadas a níveis anormais de ACTH, depressão, stress psicológico, em situações de stress fisiológico, como hipoglicemia, febre, trauma, cirurgias, medo, dor, exercícios físicos e temperaturas extremas. O padrão de secreção varia de indivíduo para indivíduo, mas tende a se manter constante para o mesmo indivíduo.
O cortisol também inibe a secreção do CRH, resultando em feedback negativo da secreção do ACTH. Alguns investigadores acreditam que este feedback normal possa ser prejudicado quando os animais são expostos a stress crônico.
Com a libertação normal o cortisol tem diversas ações que buscam restaurar a homeostase, o equilíbrio interno do organismo, após o stress. Age como um antagonista fisiológico da insulina, por promover a quebra das moléculas de carboidratos, lipídeos e proteínas, desta maneira mobilizando as reservas energéticas. Isto aumenta a glicemia e a produção de glicogênio pelo fígado. Também aumenta a pressão arterial. Adicionalmente, as células inflamatórias e do sistema imune têm suas acções atenuadas, levando a uma diminuição da atividade do sistema imune como um todo. A osteogênese, formação óssea, também é diminuída pelo Cortisol.
Essas funções endógenas são a base das conseqüências fisiológicas do stress crônico. A secreção crônica de cortisol causa perda muscular e hiperglicemia, além de suprimir as respostas inflamatórias e imunes. As mesmas conseqüências advêm do uso de drogas glicocorticóides por longo prazo.
Além disto, a exposição de longo prazo ao cortisol resulta na danificação das células do hipocampo. Este dano leva à diminuição da capacidade de aprendizagem. Entretanto, a exposição de curto prazo ao cortisol ajuda no processo de criar memórias.
A maior parte do cortisol sérico, menos cerca de 4%, está ligada a proteínas, incluindo a transcortina ou globulina ligante de cortisol (CBG) e a albumina. Para muitos receptores, apenas o cortisol livre pode ativá-los.
O Cortisol é produzido na urina.
Como substância de uso oral ou injetável, o cortisol também é conhecido como hidrocortisona. Seus usos são como imunossupressores, tratamento para reações alérgicas severas, como anafilaxia e angioedema, em substituição à prednisolona em pacientes que necessitam corticoterapia, mas não podem usar medicações orais e em preparo pré-operatório em pacientes submetidos a corticoterapia de longo prazo, para evitar crises addisonianas. Pode ser usado de forma tópica por seu efeito anti-inflamatório em rashes alérgicos (eczema) e em certas outras condições inflamatórias. Comparada à prednisolona, a hidrocortisona tem cerca de 1/4 da sua potência. A dexametasona é 40 vezes mais potente que a hidrocortisona.
Ver também
[editar | editar código-fonte]Referências
- ↑ a b c Araújo, Marcelo Rangel de (junho de 2008). «A influência do treinamento de força e do treinamento aeróbio sobre as concentrações hormonais de testosterona e cortisol». Motricidade (2): 67–75. ISSN 1646-107X. Consultado em 30 de janeiro de 2021
- ↑ Bueno, Juliano Ribeiro (10 de setembro de 2011). «Cortisol e exercício: efeitos, secreção e metabolismo». Revista Brasileira de Fisiologia do Exercício (3): 178–180. ISSN 2675-1372. doi:10.33233/rbfe.v10i3.3443. Consultado em 30 de janeiro de 2021
}

